
氏名:黒田 浩介
金沢大学 理工研究域生命理工学系 准教授
2014年9月東京農工大学工学府生命工学専攻にて博士(工学)を取得。金沢大学特任助教、助教を経て2021年3月より現職。
イオン液体の自由さに惹かれて日々、新しい溶媒を創り続けています。イオン液体はどのような物性が出るか、実際に作ってみないとわからないので、毎日ワクワク研究をしています。
http://ionicliquid.w3.kanazawa-u.ac.jp
セルロース由来の第二世代バイオエタノールの実用化は困難である。それは、セルロースは結晶性が高く、化学反応に対して耐性が高いことが理由である。そのため、セルロースの結晶化度を下げる「前処理」と組み合わせる必要がある。しかし常温・常圧・短時間でセルロースを前処理できる溶媒がなく、セルロースの前処理に大きなエネルギーコストが掛かってしまっていた。その結果として、バイオエタノール生産と消費におけるエネルギー収支が負になっていた。
イオン液体と呼ばれる100 °C以下で液体の塩を用いると、セルロースを溶解できることが2002年に報告された1。それ以降、イオン液体が改良され、カルボン酸系あるいはリン酸系アニオンを有するイオン液体を用いると、常温・常圧・比較的短時間でセルロースを溶解できるようになった2,3。その結果として、前処理に掛かるエネルギーコストが大きく削減可能になった。しかしエタノールのエネルギー密度は小さく、エネルギーコストをさらに下げることが求められている。
そのため、次に達成すべきはプロセスの連続性である。セルロースをエタノールへ変換する際には「前処理」に加え、「加水分解」「微生物発酵」が必要になる。しかし、前処理に用いたイオン液体が酵母などの微生物に対して強い毒性を示すため、上記プロセスを一つの容器内(ワンポット)で連続的に完結させることができない。そこで我々は2017年ごろ、セルロースを溶解できる低毒性イオン液体を開発した4。
イオン液体が微生物へ毒性を示す機構5は以下のとおりである(Fig. 1 左)。イオン液体のカチオンが、リン脂質のリン酸アニオンに引き寄せられる。さらにカチオンのアルキル鎖が脂質部分へ疎水性相互作用によって挿入される。このようにカチオンが細胞膜に蓄積し、最終的に細胞膜が崩壊する。そこで我々は、カチオンのアルキル鎖と細胞膜との疎水性相互作用を低減させ、毒性を低下させることを発想した(Fig. 1 中央)。具体的には、高極性アニオンをカチオンのアルキル鎖の末端に共有結合で導入し、疎水性アルキル鎖が存在しない構造とした。この構造はカチオンとアニオンが共有結合で結ばれているため、双性イオンと呼ばれる。
このとき、双性イオンはイオン液体と比べても固化しやすく、基本的に100 °C以下で固体である。我々は、「スルホン酸系双性イオンにオリゴエーテルを導入すると常温付近で液体になる」という藤田らの報告6を参考にして液体のカルボン酸系双性イオン、すなわち双性イオン液体を合成した。典型的な双性イオン(C1imC3C、構造はFig. 1 中央)の融点は100 °C以上であったのに対し、オリゴエーテルを導入した双性イオン液体(OE2imC3C、構造はFig. 1 右)の融点はなく、ガラス転移点が−62 °Cに観測された。後に、過冷却状態が非常に安定で、1ヶ月程度放置すると常温でも固化し、融点が64 °Cに現れることを確認7したが、常温においても液体として利用可能であることがわかった。OE2imC3Cは100 °Cで最大6 wt%のセルロースを溶解できた。
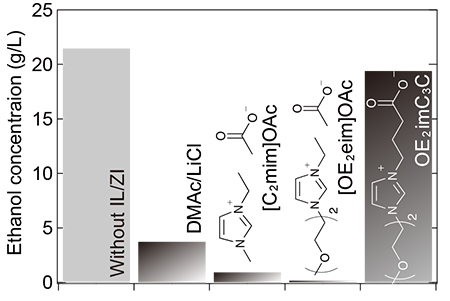
エタノール発酵可能な大腸菌E. coli KO11を用い、OE2imC3Cが発酵に与える影響を調べた。OE2imC3Cを含まない培地中でグルコースを発酵すると、21.5 g/Lのエタノールが得られた(Fig. 2)。0.5 mol/LのOE2imC3Cを添加した場合には、19.4 g/Lのエタノールが得られ、OE2imC3Cは発酵をほとんど阻害しなかった。0.5 mol/Lのイオン液体([C2mim]OAc、[OE2eim]OAc、構造はFig. 2参照)を添加した場合のエタノール濃度は、わずか1 g/L程度であった。これらのことからOE2imC3Cは「セルロース溶解能」と「効率的なエタノール発酵」の両方を可能にした。
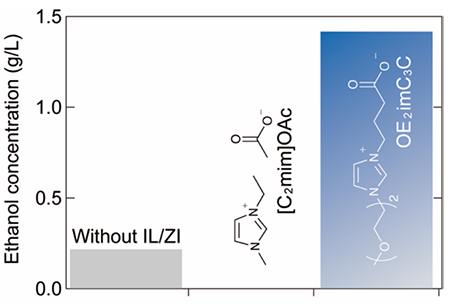
サトウキビの搾りかすであるバガスを、ワンポットで連続的にエタノールへ変換した。バガスを120 °C のOE2imC3Cで前処理した後、酢酸緩衝液を加え(OE2imC3C濃度:0.5 mol/L)、セルラーゼおよびE. coli KO11によって加水分解、発酵した。OE2imC3Cを利用した場合、1.41 g/Lのエタノールが得られた。それに対して[C2mim]OAcを用いた場合には大腸菌が死滅し、エタノールが全く得られなかった。前処理をしなかった場合でもエタノールが得られたが、その濃度はわずか0.2 g/Lであった。これらの実験結果からOE2imC3Cによって、ワンポットエタノール変換が可能となった4,8。
ここまで、OE2imC3Cは優れた低毒性セルロース溶媒であることを示した。しかし、OE2imC3Cの高い粘度は欠点となる。常温でのOE2imC3C は水飴のような高粘度の液体である。OE2imC3Cの80 °Cでの粘度は935 cPであり、常温の水の約1000倍であった。セルロースを溶解するとさらに粘度が上昇し、7 wt%のセルロースを加えると撹拌子が回らなくなってしまった。
この問題を解決するため、我々は共溶媒を利用した。通常のイオン液体においても、有機溶媒の添加によって粘度を下げ、セルロースを溶解しやすくできることが知られる9。共溶媒としてジメチルスルホキシド(DMSO)を選択した。例えば40 wt%のDMSOを添加すると、粘度が大きく低下し、14 wt%のセルロースを溶解できた。またOE2imC3C/DMSO混合溶液は、OE2imC3Cと同程度に低毒性であった。以上の結果から、DMSOの添加により、毒性を上げずにセルロース溶解能を向上できた8。
双性イオン液体は「セルロース溶解能」と「低毒性」という複数の性質を実現できる高機能溶媒であることを述べた。私は、双性イオン液体自体は歴史がまだ浅く、まだまだ改良の余地が残されているように感じている。セルロース系バイオエタノールの実用化へ向けて、私はこれからも、より良い双性イオン液体を提案していくつもりである。