 |
ケラタン硫酸(KS)プロテオグリカン(PG)合成不全による遺伝病は糖鎖合成不全の場合とコアタンパク質合成不全の場合の二つに分類できる。ヒト角膜におけるKS-PGのコアタンパク質としてはsmall leucine-rich repeat proteinであるlumican, keratocan, mimecanが知られている。このうちkeratocanをコードする遺伝子(KERA)の変異は、角膜の形が平らとなり屈折率が低下して遠視となる家族性扁平角膜(cornea plana)の原因として報告されている(1)。しかしながら他のKS-PGは産生されていることから、コアタンパク質をコードする遺伝子の変異による表現型は糖鎖の機能喪失ではなくコアタンパク質自体の機能不全であると考えられている。このことから本項目では割愛する。
ヒト角膜のKS合成にはゴルジ体に局在する4種類の酵素(β4GalT4、β3GnT7、CHST1、CHST6)が関わっていると考えられているが(本シリーズの「ケラタン硫酸生合成およびその硫酸化制御」参照)、この中でヒトの遺伝病に関係すると報告されている酵素は現在のところCHST6のみである。CHST6の不活性型変異は斑状角膜ジストロフィー(macular corneal dystrophy, MCD)を引き起こす。MCDは5-9歳以降から角膜実質内に斑状の混濁が現れ出し、年齢と共にその混濁が大きくなって視覚に影響を及ぼすようになり、いずれ角膜全体が混濁して失明するという症状を示す常染色体潜性(劣性)の様式を示す遺伝病である(2)。アイスランドにはMCDの大きな家系が存在することが知られている。
MCDの症状は角膜にのみ現れており、他の臓器での症状は今のところ確認されていない。QuantockらはMCD患者の角膜を詳細に解析し、混濁以外に角膜厚の減少が見られ、また角膜実質のコラーゲン線維の間隔が減少していることを報告している(3)。生化学的にはMCD患者の角膜や血中には高硫酸化KSが検出されないと報告されたが(4)、後に高硫酸化KSを検出する抗体5D4との反応性から、1) 高硫酸化KSが角膜にも血清中にも検出されないI型、2) I型とほとんど同じであるものの、高硫酸化KSが角膜実質細胞中にのみ検出されるIA型、3) 高硫酸化KSが角膜にも血清中にも検出されるII型、の3種類に分類されると報告された(5)。MCDの大多数はI型であり、角膜実質の細胞外マトリックスには高硫酸化KSが検出されないことから、KSの生合成異常がMCDの原因であると考えられた。NakazawaらはMCD患者の角膜を放射性単糖を含む培養液で組織培養して疾患角膜が合成するPGを解析し、MCDの角膜では硫酸修飾されていないKS-PGが合成されていることを突き止めてKSの硫酸化が阻害されていることを明らかにした(6)。
MCDの原因となる遺伝子変異は家系解析により、第16番染色体長腕のq22-23に位置することが報告され(7)、その責任領域にある糖鎖硫酸転移酵素を探索することにより発見された。この責任領域にはヒトでは2種類の糖鎖硫酸転移酵素遺伝子(CHST5, CHST6)が位置しているが、そのうちのCHST6上の変異がMCDの原因と結論づけられている。この2つの遺伝子は霊長類にのみ存在しており、それ以外の動物種ではどちらか一方の遺伝子しか存在しない(8)。CHST5とCHST6は30 kbpしか離れていない隣り合った遺伝子同士であり、遺伝子全体にわたって相同性があることから遺伝子重複により生じたものと考えられている。CHST6はN-アセチルグルコサミン(GlcNAc)6-O-硫酸転移酵素CHST6(corneal GlcNAc6ST/GST4β/GlcNAc6ST-5とも呼ばれる)をコードしており、MCD I型の患者の遺伝子解析では酵素の不活性化を伴う変異(遺伝子欠損やフレームシフト変異、ミスセンス変異)のホモ接合体あるいは複合型ヘテロ接合体として変異が検出されている。一方でAkamaらはMCD II型の患者の遺伝子解析にてCHST6のプロモータ領域と思われる遺伝子上流付近に隣の遺伝子であるCHST5との組み換え型の変異(欠失や置換)を検出しており、さらにMCD II型の患者の角膜上皮細胞におけるCHST6の遺伝子発現の消失をin situハイブリダイゼーションにて見つけたことから、MCD II型は角膜組織におけるCHST6発現の抑制に起因するものと結論づけた(9)。角膜では長鎖長のKSを大量に合成しなければならないため、MCD I型におけるCHST6酵素の不活性化やMCD II型におけるCHST6発現の抑制は角膜組織中の糖鎖合成に大きく影響を与えるものと推察される。
CHST6の活性消失はGlcNAcに硫酸修飾のないKSの合成を引き起こす。ガラクトースの硫酸化を行うCHST1 (KSガラクトース6-O-硫酸転移酵素とも呼ばれる)はGlcNAcに6-O硫酸修飾のある基質に対して効率的に硫酸化を行うので(10)、CHST6の不活性化はガラクトースの硫酸化も抑制し、ポリN-アセチルラクトサミン(polyLacNAc)の合成を誘導する可能性がある。PolyLacNAcは電荷がなく疎水性が比較的高いためKSと比較して水に溶けにくい。角膜実質ではコラーゲン線維の周りをKS-PGが取り囲み、線維間を水分子とKS-PGを含む親水性高分子物質で充填し角膜の強度と透明度を維持しているので、KS-PGが減少することでコラーゲン線維間の距離が短くなって角膜厚が薄くなり、また疎水性の高いpolyLacNAcが増加することで凝集・沈殿が生じ角膜白濁の原因となっているものと考えられる。
CHST5はin vitroにおいて硫酸転移酵素活性が確認されているもののKS合成活性はない(11, 12)。MCD II型の患者の中にCHST5が欠損しているホモ接合体が見つかっているが、MCDの表現型以外の症状は報告されていない(9)。現在のところCHST5の生物学的機能は不明である。
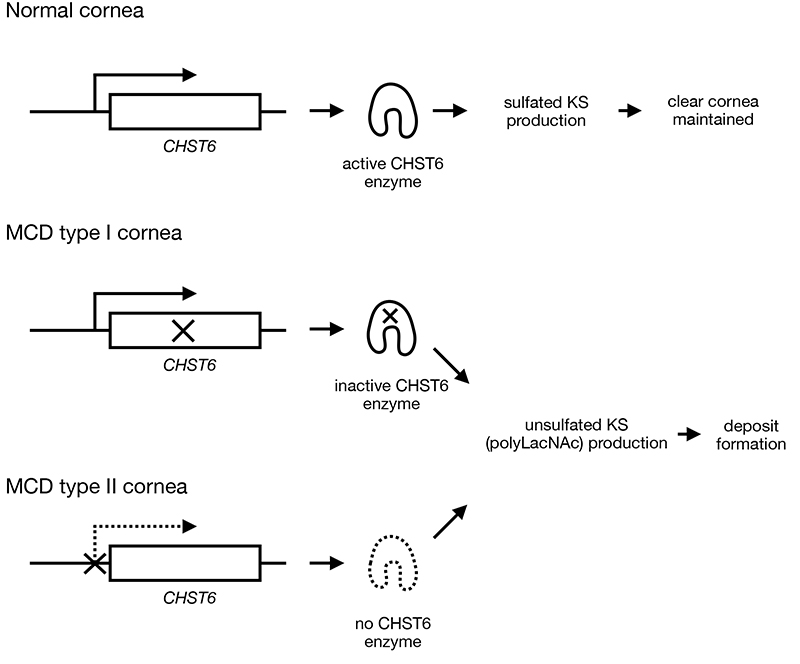
図 1. MCDの発症機序
ヒト角膜実質にあるKS-PGは細胞外にてコラーゲン線維に結合して線維を取り囲み、線維の秩序立った配置に関わると同時に線維間を水溶性高分子と水分子で充填し、高い透明性の維持に寄与している。MCD患者の角膜ではKSの硫酸化酵素であるCHST6が不活性となる変異が入っている(MCD I型)、あるいはCHST6が発現すべき細胞で発現できない変異が入っている(MCD II型)ため、角膜細胞から硫酸化のないKSであるpolyLacNAcが産生されてしまう。PolyLacNAcはKSに比べ疎水性が高いので角膜実質中で凝集・沈澱してしまい、これが角膜混濁の原因になっているものと考えられている。
|
赤間 智也(関西医科大学医学部薬理学講座)
| References |
| (1) |
Pellegata NS, Dieguez-Lucena JL, Joensuu T, Lau S, Montgomery KT, Krahe R, Kivelä T, Kucherlapati R, Forsius H, de la Chapelle A: Mutations in KERA, encoding keratocan, cause cornea plana. Nat. Genet. 25, 91-95, 2000 |
| (2) |
Singh S, Das S, Kannabiran C, Jakati S, Chaurasia S: Macular corneal dystrophy: An updated review. Curr. Eye Res. 46, 765-770, 2021 |
| (3) |
Quantock AJ, Meek KM, Ridgway AE, Bron AJ, Thonar EJ: Macular corneal dystrophy: reduction in both corneal thickness and collagen interfibrillar spacing. Curr. Eye Res. 9, 393-398, 1990 |
| (4) |
Thonar EJ, Meyer RF, Dennis RF, Lenz ME, Maldonado B, Hassell JR, Hewitt AT, Stark WJ Jr, Stock EL, Kuettner KE, Klintworth GK: Absence of normal keratan sulfate in the blood of patients with macular corneal dystrophy. Am. J. Ophthalmol. 102, 561-569, 1986 |
| (5) |
Klintworth GK, Oshima E, al-Rajhi A, al-Saif A, Thonar EJ, Karcioglu ZA: Macular corneal dystrophy in Saudi Arabia: a study of 56 cases and recognition of a new immunophenotype. Am. J. Ophthalmol. 124, 9-18, 1997 |
| (6) |
Nakazawa K, Hassell JR, Hascall VC, Lohmander LS, Newsome DA, Krachmer J: Defective processing of keratan sulfate in macular corneal dystrophy. J. Biol. Chem. 259, 13751-13757, 1984 |
| (7) |
Vance JM, Jonasson F, Lennon F, Sarrica J, Damji KF, Stauffer J, Pericak-Vance MA, Klintworth GK: Linkage of a gene for macular corneal dystrophy to chromosome 16. Am. J. Hum. Genet. 58, 757-762, 1996 |
| (8) |
Akama TO, Fukuda MN: Carbohydrate (N-acetylglucosamine 6-O) sulfotransferase 5 and 6 (CHST5,6). In: Handbook of Glycosyltransferases and Related Genes. Taniguchi N, Honke K, Fukuda M, Narimatsu H, Yamaguchi Y, Angata T (editors), Springer Tokyo, Tokyo, Japan, 1005-1014, 2014 |
| (9) |
Akama TO, Nishida K, Nakayama J, Watanabe H, Ozaki K, Nakamura T, Dota A, Kawasaki S, Inoue Y, Maeda N, Yamamoto S, Fujiwara T, Thonar EJ, Shimomura Y, Kinoshita S, Tanigami A, Fukuda MN: Macular corneal dystrophy type I and type II are caused by distinct mutations in a new sulphotransferase gene. Nat. Genet. 26, 237-241, 2000 |
| (10) |
Fukuta M, Inazawa J, Torii T, Tsuzuki K, Shimada E, Habuchi O: Molecular cloning and characterization of human keratan sulfate Gal-6-sulfotransferase. J. Biol. Chem. 272, 32321-32328, 1997 |
| (11) |
Akama TO, Nakayama J, Nishida K, Hiraoka N, Suzuki M, McAuliffe J, Hindsgaul O, Fukuda M, Fukuda MN: Human corneal GlcNAc 6-O-sulfotransferase and mouse intestinal GlcNAc 6-O-sulfotransferase both produce keratan sulfate. J. Biol. Chem. 276, 16271-16278, 2001 |
| (12) |
Akama TO, Misra AK, Hindsgaul O, Fukuda MN: Enzymatic synthesis in vitro of the disulfated disaccharide unit of corneal keratan sulfate. J. Biol. Chem. 277, 42505-42513, 2002 |
2023年10月12日
|
|---|







