 |
プロテオグリカン(proteoglycan, PG)が最も豊富に存在する組織は軟骨で、その主成分となるPGはアグリカン(aggrecan, Acan)である。Acanは代表的な細胞外マトリックス(extracellular matrix, ECM)型巨大プロテオグリカンとして知られ、現在Acan (1)、バーシカン(versican, Vcan)(2)、ニューロカン、ブレビカン等のファミリーメンバーがAcanファミリーに属する(レクチンモチーフをG3ドメイン内にもつことからレクチカンファミリーとも呼ばれている)。Acanファミリーのコアタンパク質はN-、C-末端にそれぞれG1、G3という球状ドメインを有し、中央にコンドロイチン硫酸(chondroitin sulfate, CS)結合ドメインが存在する(図1)。AcanにはG2と呼ばれるもう1つの球状ドメインが存在する。G1ドメインはA、B、B’の3つのサブドメインから成り、ヒアルロン酸(hyaluronan, HA)と特異的に結合する。G1ドメインの相同分子リンクタンパク質はHAのみならずAcanやVcanのG1ドメインと特異的に結合する。リンクタンパク質(htaluronan and proteoglycan binding link proteins, HAPLNs)にも4つのファミリーメンバーが存在し、Acanファミリーメンバー、HAとの三者の相互結合により安定なPG会合体が形成されECMに沈着する(図1)。現在はMouse Genome Informatics(MGI)のウェブサイトに殆どの遺伝子改変マウスの情報が掲載されている(https://www.informatics.jax.org/)。本稿ではAcanとVcanの遺伝子変異マウスとその表現型等の意義に関して解説する。
自然発症Acan遺伝子変異マウスにはcartilage matrix deficiency (cmd) とcmd-bcの二系統がある。cmdではG1ドメイン内のBサブドメインをコードするエクソン5に7 bpの欠損が存在し、フレームシフトにより生じた新たな終始コドンにより翻訳が止まる。Cmd-bcではイントロン1内にブレークポイントがありエクソン2からエクソン18の3’-非翻訳領域までの部位が欠損している。cmd/cmdは成長板軟骨細胞の柱状構造が乱れ、内軟骨骨化の障害により短肢症を呈し、出生直後に死亡する。cmd/+は軽度の短肢症の他、脊椎の湾曲症を発症する。また軟骨リンク蛋白質(cartilage link protein, HAPLN-1)の遺伝子欠損マウスでは軟骨におけるAcanの沈着は約25%にまで低下し、cmd/cmdマウスと同様で軽度の症状を呈する。このことは生体内においてもHAPLN-1が安定なPG会合体の形成維持に寄与することを示している。Acan分子は脳内のペリニューロナルネット(perineuronal net, PNN)に存在する。Acan発現を脳特異的に欠失させたマウスではPNN構造の破壊と神経可塑性の亢進が観察されることから、AcanはPNNの構造と機能に必須分子と考えられる(3)。
Vcanの発現パターンは特徴的で、成体期に一定量恒常的に発現しECMの構成分子として機能する場合と胎生期に一過性に過剰発現したのち急速に消失する場合とがある。現在、一過性に発現するVcanは局所において仮設ECMの中核分子として機能するという概念が提唱されている。一過性に発現するVcanは、局所において一定のスペースを形成し、このスペースに細胞が遊走、分化して本来あるべきECMが形成され、この過程でVcanは消失し、仮設ECMは本来のECMに置き換わっていく。
Gene Trap法によって初めて作出されたVcan遺伝子変異heart defect (hdf)マウスのホモ接合体(hdf/hdf)は、胎生約10.5日に重篤な心形成不全により死亡する。G1ドメインのAサブドメインをコードするエクソン3にネオマイシン耐性遺伝子を挿入して作出されたVcan Δ3/Δ3マウスは、野生型と比較してAサブドメインの欠失したVcanを低発現する。このマウスのC57Bl/6系はhdf/hdfと同様に心形成異常を発症して胎生期10.5日に死亡するが、Balb/cとの雑種では出生期まで成長する個体も存在し、出生したマウスは心室中隔欠損(ventricular septal defect, VSD)を呈する(4)。HdfのヘテロマウスにおいてもVSDを発症することから、心形成過程でダイナミックな発現パターンを示すVcanは、心形成各時期の各部位において特有の機能を果たすと考えられる。また、Vcanは軟骨原基の間充織凝集部位に一過性に高発現することから軟骨発生に重要な機能を発揮すると推測されてきた。同凝集部位のVcan発現を欠失させたPrx1-Vcanマウスは、TGFβシグナルの変化を通じて軟骨細胞分化の遅延と関節の形成異常を呈するが、軟骨組織自体は形成されることがわかった(2)。
炎症や腫瘍浸潤等でECMが変容する際、Vcanは線維芽細胞と浸潤マクロファージにおいて高発現している。宿主間質細胞のVcan発現を欠失させたマウスに腫瘍細胞を皮下移植すると、腫瘍細胞の増大とコラーゲン線維の脆弱化とが観察される。腫瘍のVcan発現と悪性度は正の相関を示すとの研究成果が多数報告されているが、宿主発現VcanはECM構造を維持することによって腫瘍の増大をむしろ抑制していると考えられる(2)。Vcanには主として4種類のスプライスバリアントが存在する(図2)。一過性に発現するVcanがV0、V1であるのに対し、V2は脳に恒常的に発現している。V0とV2の発現を特異的に欠失させる目的で作出されたVcan (tm1Zim) マウスは出生し発育するが、Ranvier結節のECMのtenascin-Rとphosphacanの沈着低下等の構造変化を呈する(5)。
Acanの軟骨と脳における機能の解明は軟骨再生と脳機能向上へ向けた研究の基盤を提供する。Vcanは炎症と修復や腫瘍浸潤等のECMの変容を司る分子であり、ECM構築と破壊における機能の解明は、これらの病態制御に繋がると期待される(6)。
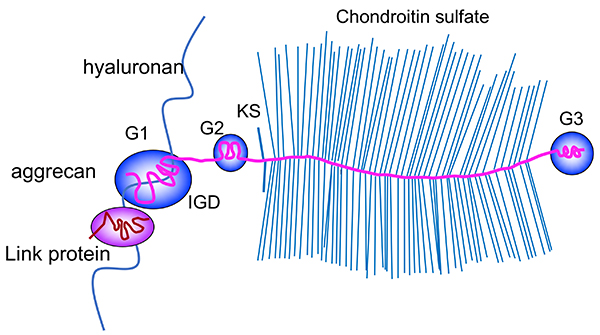
図 1. アグリカン会合体の構造
Acanのコアタンパク質はG1、G2、G3の3つの球状ドメイン及びケラタン硫酸(KS)結合ドメイン、コンドロイチン硫酸(CS)結合ドメインの2つのグリコサミノグリカン結合ドメイン、さらにはG1ドメインとG2ドメイン間に位置する球状間ドメイン(interglobular domain、IGD)をもつ。N-末端測のG1ドメインはヒアルロン酸と結合し、その結合はG1ドメイン相同性分子の軟骨リンクタンパク質(cartilage link protein、別名hyaluronan and proteoglycan binding link protein-1、HAPLN-1)によって安定化する。100本以上のCS鎖が、Acanコアタンパク質と結合し、水分の貯留に寄与している。
|
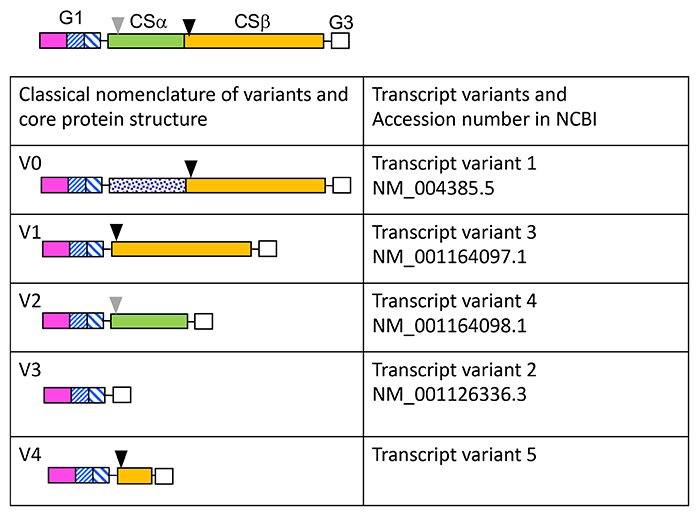
図 2. バーシカンバリアント
上部にVcanコアタンパク質のG1、G3ならびに2つのコンドロイチン硫酸ドメイン(Csα、緑色:CSβ、辛子色)を含めた構造を記載している。黒色と灰色の矢頭は各々ADAMTSsバーシカナーゼによる主要な決断部位、第二の切断部位を示している。古典的なVcanのバリアントはV0、V1、V2、V3(左カラム)だが、National Center for Biotechnology and Information (NCBI)によるとこれらは各々transcript variant 1、3、4、2となっている。近年さらにもう1つのバリアントが報告された(7)。しかしNCBIには未だ登録されていない。
|
渡辺 秀人(愛知医科大学分子医科学研究所)
| References |
| (1) |
Watanabe H, Yamada Y, Kimata K: Roles of aggrecan, a large chondroitin sulfate proteoglycan, in cartilage structure and function. J. Biochem. 124, 687-693, 1998 |
| (2) |
Islam S, Watanabe H: Versican: A dynamic regulator of the extracellular matrix. J. Histochem. Cytochem. 68, 763-775, 2020 |
| (3) |
Rowlands D, Lensjo KK, Dinh T, Yang S, Andrews MR, Hafting T, Fyhn M, Fawcett JW, Dick G: Aggrecan directs extracellular matrix-mediated neuronal plasticity. J. Neurosci. 38, 10102-10113, 2018 |
| (4) |
Hatano S, Kimata K, Hiraiwa N, Kusakabe M, Isogai Z, Adachi E, Shinomura T, Watanabe H: Versican/PG-M is essential for ventricular septal formation subsequent to cardiac atrioventricular cushion development. Glycobiology 22, 1268-1277, 2012 |
| (5) |
Dours-Zimmermann MT, Maurer K, Rauch U, Stoffel W, Fassler R, Zimmermann DR: Versican V2 assembles the extracellular matrix surrounding the nodes of ranvier in the CNS. J. Neurosci. 29, 7731-7742, 2009 |
| (6) |
Watanabe H: Aggrecan and versican: two brothers close or apart. Am. J. Physiol. Cell Physiol. 322, C967-C976, 2022 |
| (7) |
Kischel P, Waltregny D, Dumont B, Turtoi A, Greffe Y, Kirsch S, De Pauw E, Castronovo V: Versican overexpression in human breast cancer lesions: known and new isoforms for stromal tumor targeting. Int. J. Cancer 126, 640-650, 2010 |
2023年 6月15日
|
|---|








