 |
外傷の処置法について紀元前17世紀の古代エジプトで記されたEdwin Surgical Papyrusには、すでに脊髄損傷についての記載があり、「治療不可能」との文言が見て取れる。現代においてもこの状況は変わらず、わが国でも年間5000件の新規受傷があり、患者は重篤な運動感覚麻痺を生じる。この病態の本質は、神経軸索の切断とその再生不能にある。神経軸索は通常1つの神経細胞から1本伸びる長い神経突起であり、主に情報の出力を担う。われわれヒトにおいても、最も長い軸索は約1メートルにも及ぶ。脊髄はまさにこの神経軸索の束であり外傷などにより損傷を受けると、この神経軸索が切断され神経回路の断絶が生じる。損傷を受けた神経細胞自体の多くは生存しているものの、軸索を再度伸ばして神経回路を再形成することはない。
19世紀から20世紀にかけて活躍したスペインの神経解剖学者Santiago Ramón y Cajalは損傷脊髄を具に観察し、損傷した神経軸索の先端部が空胞を内包した異常腫大構造を呈していることを見出し、これをdystrophic endballと名付け、この異常構造の形成こそが、中枢神経軸索の再生を不可能にしていると考察した。
1900年代後半にはAguayoらは損傷脊髄の中枢側と末梢側を末梢神経束によりバイパスし、この末梢神経束の中を中枢神経が再生することを見出した。このことから、中枢神経軸索が再生しないのは、神経細胞自体の性質というよりもむしろ中枢神経系の環境にあると考えられるようになった。実際に、いくつもの「軸索再生阻害因子」が同定された。コンドロイチン硫酸もその一つである。コンドロイチン硫酸は損傷部におけるグリア性瘢痕により産生され、神経軸索再生を強力に阻害する。脊髄損傷ラットにおいて損傷部に豊富に存在するコンドロイチン硫酸をコンドロイチン硫酸分解酵素であるコンドロイチナーゼABCにより分解することで、損傷後の運動機能回復を促進できる(1)。また重要なことにin vitroにおいて細胞外のコンドロイチン硫酸は神経軸索先端部にdystrophic endballを誘導する(2)。さらに神経軸索におけるコンドロイチン硫酸受容体として、受容体型チロシンホスファターゼに属するプロテインチロシンホスファターゼ(PTPσ)が同定された(3)。興味深いことにPTPσはすでにコンドロイチン硫酸と同じグリコサミノグリカンの一つであるへパラン硫酸の受容体として知られており、へパラン硫酸により二量体化され不活化される。一方、コンドロイチン硫酸がリガンドとしてはたらくと単量体化され活性化される(4)。しかしながらdystrophic endballが形成される細胞生物学な機構や、PTPσが基質として脱リン酸化する標的タンパク質については永らく不明であった。
著者らはdystrophic endball内にオートファゴソームが異常蓄積していることを見出した。オートファゴソームはリソソームと融合してオートライソゾームとなるが、このリソソームとの融合が強力に抑制されていた。一方リソソーム阻害剤やオートファゴソーム-リソソームの融合に必須のSNAREタンパク質をノックダウンにより人為的にオートライソゾームの融合を阻害すると、健常軸索にdystrophic endball様の異常構造を誘導することができた。これらのことから、オートライソゾームの形成阻害はdystrophic endballの形成に必要十分な現象であることが示された(5)(図)。
上述のように、コンドロイチン硫酸は受容体であるPTPσと結合すると単量体化し、細胞内のチロシンホスファターゼドメインを活性化することが予測されていたが、その基質については不明であった(4)。著者らは前述のdystrophic endballの表現型から、オートファゴソームとリソソームの融合に関与する分子に重点を置き、cortactinがPTPσの基質であることを同定した(5)。Cortactinはsrcなどのチロシンキナーゼにより421番目のチロシンがリン酸化されるとリソソーム表面へリクルートされ、ここでアクチン線維を安定化させ、オートファゴソームとリソソームの融合に必要な足場を提供する。PTPσはリン酸化cortactinを直接脱リン酸化し、この過程を阻害する。実際に、dystrophic endballでは健常軸索先端部と比べて優位にcortactinが脱リン酸化されていた。またcortactinのノックダウンにより健常軸索先端部にdystrophic endballが誘導された。このことからcortactinがPTPσの下流においてdystrophic endballを誘導する責任分子であることが示された(図)。
最近、軸索腫大構造はアルツハイマー病のAβプラークによって直接誘導され、神経伝導を阻害することが明らかにされた(6)。この構造の中にもオートファゴソームや多小胞体(multivesicular body:MVB)が異常貯留していることが判明し、dystrophic endballとの共通性や違いが注目される。
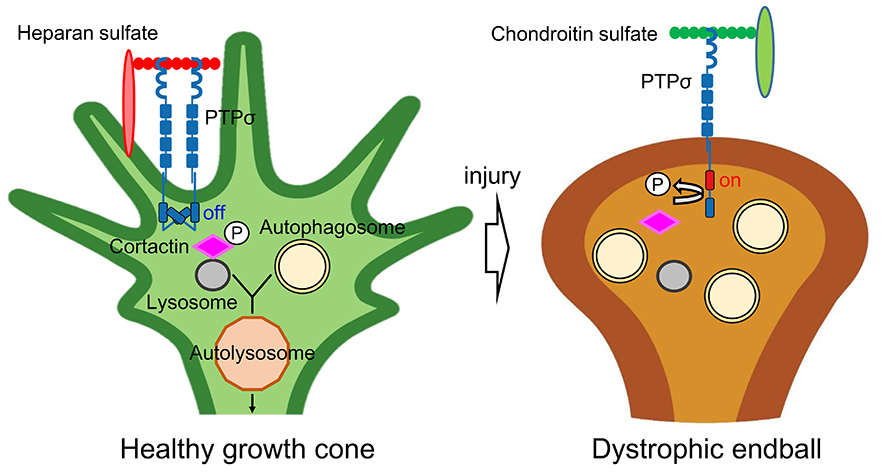
図
健常成長円錐(左)ではへパラン硫酸がPTPσを多量体化・不活性化している。この状況では軸索先端部でのオートファジーは円滑に進行し、軸索は伸長する。中枢神経損傷時(右)では、グリア性瘢痕由来のコンドロイチン硫酸がPTPσを単量体化・活性化する。PTPσはCortactinを脱リン酸化し、オートファゴソームとライソゾームの融合が阻害される。この結果軸索先端部にオートファゴソームが異常蓄積し、dystrophic endballが誘導される。
|
坂元 一真(名古屋大学・糖鎖生命コア研究所)
| References |
| (1) |
Bradbury EJ, Moon LD, Popat RJ, King VR, Bennett GS, Patel PN, Fawcett JW, McMahon SB: Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature 416, 636–640, 2002 |
| (2) |
Tom VJ, Steinmetz MP, Miller JH, Doller CM, Silver J: Studies on the development and behavior of the dystrophic growth cone, the hallmark of regeneration failure, in an in vitro model of the glial scar and after spinal cord injury. J. Neurosci. 24, 6531–6539, 2004 |
| (3) |
Shen Y, Tenney AP, Busch SA, Horn KP, Cuascut FX, Liu K, He Z, Silver J, Flanagan JG: PTPsigma is a receptor for chondroitin sulfate proteoglycan, an inhibitor of neural regeneration. Science 326, 592–596, 2009 |
| (4) |
Coles CH, Shen Y, Tenney AP, Siebold C, Sutton GC, Lu W, Gallagher JT, Jones EY, Flanagan JG, Aricescu AR: Proteoglycan-specific molecular switch for RPTPσ clustering and neuronal extension. Science 332, 484-488, 2011 |
| (5) |
Sakamoto K, Ozaki T, Ko YC, Tsai CF, Gong Y, Morozumi M, Ishikawa Y, Uchimura K, Nadanaka S, Kitagawa H, Zulueta MML, Bandaru A, Tamura JI, Hung SC, Kadomatsu K: Glycan sulfation patterns define autophagy flux at axon tip via PTPRσ-cortactin axis. Nat. Chem. Biol. 15, 699–709, 2019 |
| (6) |
Yuan P, Zhang M, Tong L, Morse TM, McDougal RA, Ding H, Chan D, Cai Y, Grutzendler J: PLD3 affects axonal spheroids and network defects in Alzheimer’s disease. Nature 612, 328–337, 2022 |
2023年 6月15日
|
|---|







