 |
リンクプロテインは豊富に存在する軟骨組織の細胞外マトリックス(extracellular matrix, ECM)主要成分の1つとして発見された。軟骨組織から分離されたECM成分の生化学的解析や電子顕微鏡を用いた観察から、軟骨組織の主要プロテオグリカン(proteoglycan, PG)であるアグリカン(aggrecan, ACAN)1分子に対して、リンクプロテイン1分子が結合しヒアルロン酸への非共有結合を相乗的に安定化することが明らかとなった。リンクプロテインの分子構造はヒアルロン酸に結合するアグリカンファミリー(あるいはC型レクチンモチーフを G3ドメイン内にもつことからレクチカンファミリーとも呼ばれている)のN末端G1ドメインに非常に相似している。すなわち、リンクプロテインは A, B, B’の3つのサブドメインから成り、ヒアルロン酸と特異的に結合する構造となっている。B, B’サブドメインは約100アミノ酸残基の長さで、proteoglycan tandem repeat(PTR)あるいはlink moduleとも呼ばれ、ヒアルロン酸結合性をもつlink module superfamilyに多く含まれる。分子生物学的手法により他のファミリーメンバーが発見されるまで、軟骨組織に豊富なリンクプロテインはcartilage link protein (CRTL1)と呼ばれた。2000年以降に他の3つのファミリーメンバーがクローニングされ、hyaluronan and proteoglycan link protein(HAPLN)遺伝子ファミリーと命名された(1)。興味深いことに、4つのHAPLN遺伝子はすべてACANなどのレクチカンPG遺伝子とペアを作ってゲノム上に存在する。ヒアルロン酸結合性をもつlink module superfamilyは脊椎動物に固有の遺伝子であり、進化の過程で4つのペア遺伝子が作られたものと考えられる。
HAPLN1欠損マウスでは軟骨形成の異常と骨形成の遅延が見られ、手足が短く、頭蓋顔面の異常が見られた(2)。そしてほとんどのマウスは生後間もなく呼吸不全で死亡した。自然発症型Acan変異(cmd/cmd)マウスより軟骨異形成症状が軽度ではあるものの、ACAN の沈着は約25%にまで低下し、成長板軟骨細胞の柱状構造は乱れていた。これらの結果からHAPLN1はPG凝集体の形成、軟骨細胞の分化と正常な組織化に重要であることが示唆された(2)。また、HAPLN1欠損マウスで心臓発生期にバーシカン(VCAN)の発現が減少し、心室中隔欠損などの異常を認めたことから、VCAN-ヒアルロン酸-HAPLN1凝集体形成が心臓発生に重要と考えられる。
HAPLN遺伝子ファミリーのうち、Hapln2, Hapln4は中枢神経系特異的な発現を示し、Hapln1も軟骨以外に脳・心血管系の発現が確認される。Hapln3発現は遍在することがわかっている(1)。個々のHAPLNが組織および時期特異的に発現し、レクチカンPGのヒアルロン酸への結合の安定化を制御することにより機能していると考えられる。
脳の発達においては、HAPLN1は胎生期から幼若期に発現のピーク、HAPLN2, HAPLN4は成熟期にかけて発現の増加があり。その時期的パターンは前者の方がニューロカン(neurocan, NCAN)やVCAN V0/V1(Vはスプライシングバリアントを示す)と後者の方はACANやブレビカン(brevican, BCAN)、VCAN V2と時期的には一致する(図1)。時期的発現の違いに加えて、これらECM成分が神経細胞・グリア細胞から発現するかが、脳の部位特異的ヒアルロン酸結合のPG凝集体の形成に関係している。その中で、HAPLNの発現開始は凝集体形成のトリガーと考えられる。また、脳において軟骨組織のACAN凝集体との違いはテネイシンによるレクチカンG3ドメインのクロスリンクがあることである。ヒアルロン酸-レクチカン-テネイシンの頭文字をとってHLTモデルと命名されている(3)。
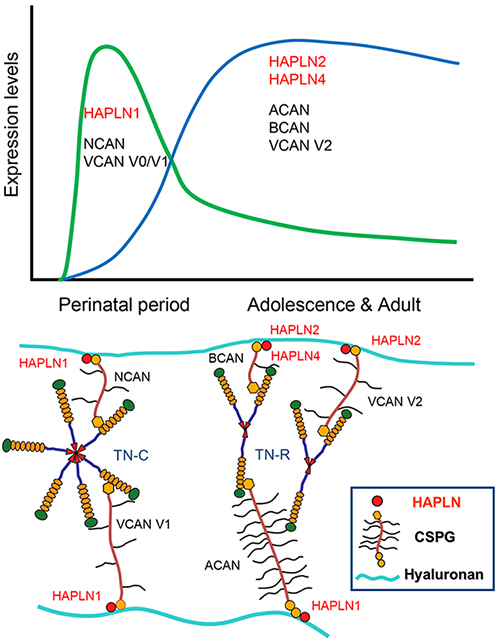
図 1. 脳の発達期におけるHAPLNとコンドロイチン硫酸プロテオグリカン(CSPG)遺伝子の発現
略語: TN-C, tenascin C; TN-R, tenascin R
|
GolgiやRamon y Cajarらによって発見されたペリニューロナルネット(PNN)構造は、特定の神経細胞の細胞体および樹状突起にみられる網目状の構造であるが、細胞膜表面に高度に凝縮したECM構造である。HAPLN1全身欠損マウスは軟骨異形成により生後早期に致死となるので軟骨での発現をレスキューさせた(Crtl1-/-/Crtl1-Tg+/+)マウスで生後に発達するPNNを解析したところ、PGの全体の発現レベルに大きな影響を及ぼさずに大脳皮質のPNN集積が大きく減弱した(4)。さらに同マウスは成体においても眼優位可塑性を維持した。この結果は、HAPLN1がPNNの形成とその可塑性制御に非常に重要な役割を果たすことを示している。一方HAPLN4は小脳や脳幹部の神経核に主に発現しており、しかしここにはHAPLN1も共局在する。HAPLN4欠損マウスのこれら神経核では、BCANの局在パターンに影響を与え、ACANには影響を与えない。深部小脳核においてはプルキンエ細胞からの抑制性シナプスの減少を招き、選択的シナプス形成能が認められた(5)。
HAPLN2の発現はもっぱら脳の白質に発現しており、顕著にランビエ絞輪(NOR)に局在する。有髄神経にみられるNORは、神経軸索を覆うミエリン鞘とミエリン鞘の間に存在し、電位依存型ナトリウムチャンネルが集積しており、活動電位が発生する場となっている。我々は、中枢神経NORにおけるHAPLN2の局在が、レクチカンPGのVCAN V2の局在と一致することを見いだした(6)。さらに、BCAN,NCANがすべてのNORではないが多くの中枢神経NORに局在することを示した。視神経を使った免疫染色、免疫沈降実験、BCAN欠損マウスの結果から、特にBCANは軸索直径の太いNORにのみ局在し、そこにテネイシン-R、ホスファカンが集積することを示した。テネイシン-RのフィブロネクチンIII型リピートはBCANのG3ドメインと高い結合親和性をもつことにより、この現象は説明できる。軸索直径の太いNORほど、コンドロイチン硫酸鎖などの強い陰性荷電糖鎖を含み、より複雑なECM会合体を集積していることとなり、これは太い有髄神経ほど跳躍伝導速度が速いことと何らかの関連性があることが考えられた(6)。
脳においては、古くより知られ近年では神経可塑性制御や精神疾患・記憶などの機能について注目されつつあるペリニューロナルECMの形成にHAPLNは中心的役割を果たし、上記の2種類のペリニューロナルなECMはさまざまなシグナルが交錯する「場」を作っていると考えられる(7)。
大橋 俊孝(岡山大学 学術研究院医歯薬学域 分子医化学分野)
| References |
| (1) |
Spicer AP, Joo A, Bowling RA Jr: A hyaluronan binding link protein gene family whose members are physically linked adjacent to chondroitin sulfate proteoglycan core protein genes: the missing links. J. Biol. Chem. 278, 21083-21091, 2003 |
| (2) |
Watanabe H, Yamada Y. Mice lacking link protein develop dwarfism and craniofacial abnormalities. Nat. Genet. 21, 225-229, 1999 |
| (3) |
Oohashi T, Edamatsu M, Bekku Y, Carulli D: The hyaluronan and proteoglycan link proteins: Organizers of the brain extracellular matrix and key molecules for neuronal function and plasticity. Exp. Neurol. 274, 134-144, 2015 |
| (4) |
Carulli D, Pizzorusso T, Kwok JC, Putignano E, Poli A, Forostyak S, Andrews MR, Deepa SS, Glant TT, Fawcett JW: Animals lacking link protein have attenuated perineuronal nets and persistent plasticity. Brain 133, 2331-2347, 2010 |
| (5) |
Edamatsu M, Miyano R, Fujikawa A, Fujii F, Hori T, Sakaba T, Oohashi T: Hapln4/Bral2 is a selective regulator for formation and transmission of GABAergic synapses between Purkinje and deep cerebellar nuclei neurons. J. Neurochem. 147, 748-763, 2018 |
| (6) |
Bekku Y, Vargová L, Goto Y, Vorísek I, Dmytrenko L, Narasaki M, Ohtsuka A, Fässler R, Ninomiya Y, Syková E, Oohashi T: Bral1: its role in diffusion barrier formation and conduction velocity in the CNS. J. Neurosci. 30, 3113-3123, 2010 |
| (7) |
Fawcett JW, Oohashi T, Pizzorusso T: The roles of perineuronal nets and the perinodal extracellular matrixin neuronal function. Nat. Rev. Neurosci. 20, 451-465, 2019 |
2023年 6月15日
|
|---|







