|
Starch synthase (SS)は、ADPグルコースをドナー基質として澱粉のα-1、4 グルカン鎖の非還元末端を伸長する澱粉合成の中核を担う糖転移酵素である。緑色植物のSSには、多くのアイソザイムが存在する。SSは、アミロペクチンの生合成に関与するsoluble starch synthase (SS)とアミロース合成に関与するgranule-bound starch synthase (GBSS)に分けられる。すべてのSSは、いわゆるデノボ合成(即ち、グルコース1残基からマルトースを合成する)ができず、マルトースより長いプライマーが必要である。
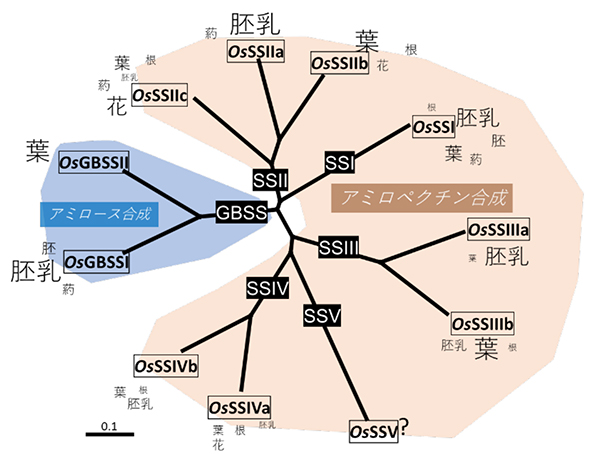
アミロペクチンの生合成に関与するSSのサブファミリーはSSI、 SSII、 SSIII、 SSIVであり、SSI以外のサブファミリーは、さらに複数のアイソザイムをもつことが多く、発現する器官も異なる(図)。SS遺伝子は、核にコードされ、貯蔵器官ではアミロプラスト、緑葉では葉緑体で働くことから、それらプラスチドの二重膜を通過するためのトランジットペプチドをN末端側に保有する。各SSアイソザイムにはC末端側に活性中心を含む相同性が高い領域が存在し、N末端伸長部分の長さは、各アイソザイムによって異なる。
各SSアイソザイムの機能は、様々な植物種の欠損変異体や組換え体等の解析や精製酵素のインビトロ解析により明確になってきた。植物種により、各アイソザイムの貢献度は異なるが、SSI、 SSII、 SSIII、GBSSIでは概ね植物種間でその機能は共通している。また、特定のアイソザイムの欠損が間接的に他のアイソザイムの発現量に影響を与える場合があり、それが澱粉構造や性質に大きな影響を与える。
GBSSは、アミロースを合成する酵素で、緑色植物に広く存在する。GBSSI欠損変異体は、最も古くから知られたモチ変異体で、アミロースをもたないか、激減する。モチ性を示すトウモロコシやイネでは、アミロースをもつウルチ性の澱粉とは全く異なる性質を示すため、食品加工用途として広く使われている。
SSI欠損変異体は、シロイヌナズナやイネ(1)で単離されている。イネのSSIは、可溶性画分のSS活性の過半数を占めるにもかかわらず、SSI欠損変異体の種子の重量は野生型と変わらないため、他のSSアイソザイムの相補が考えられる。一方、野生型と比べてグルコースの重合度(DP) 6-7および16-19のアミロペクチン鎖が増加し、DP8-12が減少していた。以上のことから、SSIは、アミロペクチンのDP6-7の短い枝をDP8-12へと少しだけ伸長する機能があることが明らかになった(1)。
SSII欠損変異体はエンドウ、シロイヌナズナ、ジャガイモ、コムギ、イネなどで単離されているが、いずれも概ねアミロペクチンのDP12以下の短鎖が増加し、DP13-24の中鎖が減少するものであった。この変化は澱粉の糊化温度を大きく低下させ、調理する際にも大きな影響を与える。イネでは、多くのインディカ米のSSIIa活性は強い(野生型)が、ジャポニカ米の多くは弱い。そのため、ジャポニカ米の熱糊化温度はインディカ米と比べて10℃程度低い(2)。
SSIII欠損変異体は、トウモロコシ、ジャガイモ、イネ、緑藻のクラミドモナス等でも単離された。SSIII欠損の直接的な影響は、アミロペクチンのクラスターを連結する長い鎖(DP≥33)が減少することである。これに加え、間接的な影響としてGBSSIの発現量が増加するため、アミロース含量が増加する(3)。
シロイヌナズナで単離されたSSIV欠損変異体は、葉緑体に蓄積される澱粉粒の数が激減し、1つの澱粉粒が大きくなったことから、澱粉粒の合成のイニシエーションに関与していることが示唆された(4)。しかし、この現象は緑色植物で普遍的ではないようである。イネで単離されたSSIVb欠損変異体の胚乳澱粉の性質は、野生型とほとんど変化がなかったが、SSIIIaとの二重欠損変異体の結果から、イネのSSIVbの機能は、SSIIIaと同様、アミロペクチンの長鎖を伸長することであることがわかった(5)。以上のようなシロイヌナズナとイネのSSIVの機能の違いは、両者のSSIVアイソザイムの数の違い、また、主として澱粉を蓄積する器官の違いが原因かもしれない。
藤田 直子(秋田県立大学 生物資源科学部 生物生産科学科)
| References |
| (1) |
Fujita N, Yoshida M, Asakura N, Ohdan T, Miyao A, Hirochika H, Nakamura Y: Function and characterization of starch synthase I using mutants in rice. Plant Physiol. 140, 1070-1084, 2006 |
| (2) |
Nakamura Y, Francisco PB Jr, Hosaka Y, Sato A, Sawada T, Kubo A, Fujita N: Essential amino acids of starch synthase IIa differentiate amylopectin structure and starch quality between japonica and indica rice varieties. Plant Mol. Biol. 58, 213-227, 2005 |
| (3) |
Fujita N, Yoshida M, Kondo T, Saito K, Utsumi Y, Tokunaga T, Nishi A, Satoh H, Park JH, Jane JL, Miyao A, Hirochika H, Nakamura Y: Characterization of SSIIIa-deficient mutants of rice: the function of SSIIIa and pleiotropic effects by SSIIIa deficiency in the rice endosperm. Plant Physiol. 144, 2009-2023, 2007 |
| (4) |
Roldán I, Wattebled F, Mercedes Lucas M, Delvallé D, Planchot V, Jiménez S, Pérez R, Ball S, D'Hulst C, Mérida A: The phenotype of soluble starch synthase IV defective mutants of Arabidopsis thaliana suggests a novel function of elongation enzymes in the control of starch granule formation. Plant J. 49, 492-504, 2007 |
| (5) |
Toyosawa Y, Kawagoe Y, Matsushima R, Crofts N, Ogawa M, Fukuda M, Kumamaru T, Okazaki Y, Kusano M, Saito K, Toyooka K, Sato M, Ai Y, Jane JL, Nakamura Y, Fujita N: Deficiency of Starch Synthase IIIa and IVb Alters Starch Granule Morphology from Polyhedral to Spherical in Rice Endosperm. Plant Physiol. 170, 1255-1270, 2016 |
2023年 6月15日
|
|---|