
Ulf Lindahl 教授
Ulf. Lindahl博士は1940年にスウェーデンのSolnaに生まれた。彼は1966年にウプサラ大学からMD/PhDを授与された。学位論文は「ヘパリンータンパク結合部位の構造」であった。1962-64年にはシカゴのLaRabida大学でResearch Student Assistantとして研究した。1965年にはウプサラ大学へ帰り、1967年には医学・生理化学の助教授に任命された。博士は1971年医学研究評議会のCareer investigatorとなった。1973年にはスウェーデン農業科学大学・王立獣医学校へ医学・生理化学教授として移動し、その後そこで8年間学部主任教授を務めた。1991年医学・生理化学教授としてウプサラ大学へ帰り、1998年にはウプサラ大学医化学・微生物学部の主任教授となった。
彼の数多くの名誉ある地位から2つほどあげると;1986-92年、スウェーデン医学研究評議会化学研究セクション議長および分子生物学委員会委員;1988-90年国立生化学委員会長官
受賞または業績;1980年生物化学会Anniversary Prize (FEBS); スウェーデン王立科学アカデミーからHilda and Alfred Erikssons Prize(1984年);複合糖質学会から国際Karl Meyer賞(1991年);Anders Jahres Store Nordiske Medisinske Pris (1993年);Owren Lecturer(Oslo,1989年);更に、5つの学会の名誉会員;8つのJournalの編集委員;約200の科学論文、これらは主にヘパリンと関連多糖の構造、生合成および機能に関するもの
近年、ヘパラン硫酸プロテオグリカンのもつ多彩な役割が注目されている。このプロテオグリカンは細胞表面に存在して、細胞増殖因子、酵素、プロテアーゼインヒビターなどさまざまな生理活性タンパク質と結合しその活性制御に関わる一方、細胞外マトリックス中にも存在して、細胞の係留、生理活性タンパク質の保持、物質透過の制御などの機能にも関与することなどが知られている。
ヘパラン硫酸は分子量2-3万にもなる高分子多糖であり、その構造は変化に富んでいる。この糖鎖のどのような構造がこれらの多様な機能に関わっているのか。また、細胞はどのようにしてこの複雑な糖鎖を作り出すのか。これらの疑問への解答は現代の糖質科学の最も興味ある課題の一つであろう。
ウルフ リンダール教授は、ヘパリン研究の草創期からのリーダーである。その多大な業績の中で、血液凝固を抑制するヘパリン活性糖鎖の構造解明は、以後のヘパラン硫酸糖鎖の活性ドメイン研究の端緒となる画期的な意義をもたらした。その後リンダール教授は、ヘパリン糖鎖の一連の生合成プロセスを解明され、ヘパラン硫酸の生合成研究にも多大な影響を与えた。
本インタビューでは、このような経験豊かな先生に、ヘパリン研究を始めたたいきさつや、研究のプロセスなどをご紹介していただき、ヘパラン硫酸のもつ生物学的意義、今後の展望などについてお考えを伺った。
Qリンダ−ル博士、先生は長い間ヘパリン研究に専念され、この分野で多大な貢献をされましたが、この研究を始められるようになった契機は何ですか?
それは全く幸運だったのでしょうね。私はウプサラの医科大学で学んでおりましたが、有機化学の教室を担当していたLenart Roden先生が、たまたま私のセミナ−グル−プの指導者になられたのです。私は2-3のセファデックスカラムの扱いを先生に教わったところで、先生はシカゴ大学に赴任され、そこで仕事の大部分を多糖とタンパク質の結合領域に関する研究にあてておられました。しばらくして、先生は私に手紙を下さって、私が大学院学生として仲間に加わらないかと訊ねてこられました。私も望むところでしたので、妻Birgittaと一緒に先生の所で多糖体に共有結合しているアミノ酸の起源について研究を始めました。そして、私はRoden先生と一緒にヘパリンータンパク質結合部位を発見したのです。ヘパリン糖鎖のもっと非還元末端方向についても調べようということになったのは自然の成り行きでした。それから時を経て、ヘパリンとヘパラン硫酸の関係がより明瞭になるにつれて、研究分野も大変拡大してゆきました。私にとっては、一生涯の研究に十分値するものだと思うようになりました。
Qヘパリン、ヘパラン硫酸の研究で抗凝固活性部位を単離し、その活性と構造を解明した先生の研究は以後の研究に大変な影響を与えました。この発見はどのようにしてなされたのでしょうか?
ヘパリンが種々のタンパク質に結合しうることはずっと前からよく知られていました。タンパク質を分画する目的で最初のヘパリンセファロ−スカラムを使用したのは、70年代初期我々の学部(Per-Henrik Iveriusによって)でした。それ以前に、Ulrich Abildgaadはアンチトロンビン作用物質としての“ヘパリンコファクタ−”を同定しており、ひき続いてRobert Rosenbergはアンチトロンビンはヘパリンと結合することによって、より効果的な凝固関連プロテアーゼの阻害因子に変わることを見いだしました。これは鍵となる発見でした。全てのヘパリン分子がこの活性を持っているかどうかを疑うことは当然のことでした。そこで我々はアンチトロンビン固定化カラムによるアフィニテイ−クロマトグラフィ−を試みました。同様の実験がボストンのRosenberg により、またストックホルムのLars-Olov AnderssonとKabi製薬会社の共同研究者によってほとんど同じ時期に行われました。これらの3つの研究グループは同じ結論に達したのです:すなわち、ヘパリン分子のほんのわずかな画分がアンチトロンビンに強い親和力で結合すること、この画分は出発材料中の抗凝固活性のほとんど全てであるということです。我々が高親和性型と低親和性型のヘパリンの構造上の違いを明確にし、おそらくその違いはたった一個の硫酸基に起因していると考えても不思議ではないと考えるのにさらに4年間を要しました。アンチトロンビン結合性五糖配列中の「ユニ−ク」なグルコサミン3-O硫酸残基の発見は、思いがけぬ興味ある波及効果をもたらしました。特に、グリコサミノグリカン構造体の化学合成の方法論の著しい発展がPierre SinayとMaurices Petitouによって行われることになったと云えるかもしれません。
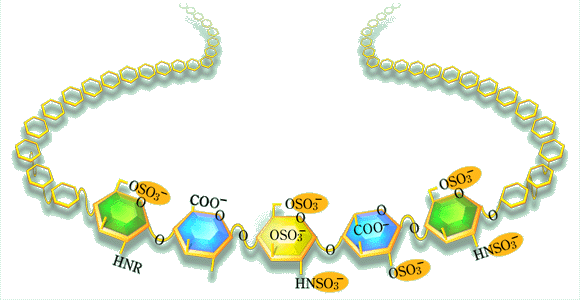
Qヘパリンは医薬としてゆるぎない地位を獲得していますが、生体における役割は不明瞭のようです。なぜ、ヘパリンはマストセル(肥満細胞)の中にのみあるのでしょうか?このことについてどう考えますか。
良い質問です。ヘパリンはマストセル中で何をしているか。私の知る限り−それはまだ多いとはいえませんが−その機能は、血液凝固の乱れに対しては何もすることができないということです。ヘパリンはアナフィラキシ−ショックや他の炎症反応のような特別緊急時にのみマストセルから放出されます。放出されたヘパリンは、一つの可能性として、炎症状態においてスイッチが入り組織内の広範囲にフィブリン沈着を生じるような血管外凝固システムを制御しているのかもしれません。単球/マクロフファ−ジは適当な刺激を受けると必要なプロトロンビン分解活性を供給するということは、現在では広く認められております。
たぶん、我々は全く違った角度から見るべきかもしれません。私は海産動物カラスガイのある種のものにマストセル様の細胞があり、ヘパリン様多糖体が存在するという昔の発見について考えているところです。これらの生き物には通常の抗凝固と関連する意味での血液は持っていません。しかし、“マストセル”中の多糖には特異的なアンチトロンビン結合性五糖配列が含まれていることが判明しております。それもまた強い抗凝固活性を持っています。ハマグリはアンチトロンビン(セルピンファミリ−に属する)に関係したプロテア−ゼインヒビタ−をもっているが、血液凝固と全く関係ない機能をもっていると想像することは理に適っております。多分、寄生虫に対する防御メカニズムかもしれません。哺乳動物のマストセルも何か似たような作用があるのではないのでしょうか?いずれにしても、五糖/アンチトロンビン相互作用メカニズムはヘパリンと言うよりは、むしろ内皮細胞ヘパラン硫酸を通して哺乳動物における血液凝固の制御に適用されるようになったのだと思います。
Qヘパリン研究に続いて、先生はb-FGFと相互作用するヘパラン硫酸の微細構造モデルを提唱されています。ヘパラン硫酸が多くのタンパク質と相互作用し、それによりその活性を調節していることを述べられています。ヘパラン硫酸糖鎖のドメイン構造の多様性や厳密性がこれらのタンパク質との相互作用にどのように関係しているのでしょうか?
これは大変興味ある質問であり、現在間違いなくこの分野における“ホット”な論争の一つとなっています。我々や、他の研究者が得た最近の結果では、異なる組織や細胞は特異性の高いドメイン構造を持ついくつかのヘパラン硫酸を発現しており、これは恐らくそれぞれ選択されたタンパク質に対して結合するように仕立てられていることを示唆しております。勿論、これに関する証拠は未だ間接的なもので、我々は組織中の単一な細胞からヘパラン硫酸を単離することはできていませんし、また、培養細胞から生産された多糖が代表的なものではないかもしれません。それでも、いろいろな組織から調製されたヘパラン硫酸の組成分析では、僅かではあるがしかし個々の個体に特定の高度に再現性ある変化があります。このことは、ヘパラン硫酸糖鎖のきっちりと制御された生合成修飾があるという風に解釈できるのではないでしょうか。多様な糖鎖ドメインが発現していることは、異なったヘパラン硫酸エピト−プに対するモノクロナ−ル抗体(特異性は未だはっきりしていませんが)を用いた組織の免疫化学的検索を通しても見ることができます。私はこの糖鎖構造の多様性は、異なるタンパク質との選択的な相互作用をするヘパラン硫酸依存リガンドへの要求を反映したものであると確信しています。私はまたこの考えは、これらのタンパク質の大部分が見かけ上非特異的にヘパリンとも同様に結合するという現実のために、遅れてしまったと考えます。高度に硫酸化されたヘパリン糖鎖は、多くのヘパラン硫酸分子種に発現されている固有なタンパク質結合性に対して、あらゆる結合性を内包しているのでしょう。
Qヘパラン硫酸の広範な機能からその構造の重要性が推定できます。このような特定のヘパラン硫酸を合成するシステムはどのようなもので、細胞はこれらの分子デザインをいかにして記憶しているのでしょうか?
そのようなヘパラン硫酸、またはヘパリンはどのようにして合成されるのでしょうか。私の考えでは、ヘパリンは生合成に関しては異常にN硫酸ドメインが拡大した種類のヘパラン硫酸として見なすべきかもしれません。この質問は今までの中でかなり難問です。特にヘパラン硫酸構造に関する我々の最近の理解や、またその生合成の制御に対する明らかな解答の必要性という観点からも。私は長年この問題についてずっと興味を抱いてきました。そして私の共同研究者と少なくとも2つの、部分的には相反するモデルを作ってきました。これらのモデルは少し素朴ですが、複雑な物事について考えを進めるのに役立つと信じております。
これまで完全に解明されないで残されている問題は、生合成酵素の基質特異性の重要性です。いろいろな多糖修飾反応は明らかにきまった順序で進み、一つの反応生成物が次の反応の基質を供給することになります。ヘパラン硫酸の複雑な構造はこれらの反応の不完全性により発生します。特別な硫酸転移酵素の各反応ステップで、いわば、ある潜在的基質残基が修飾を免れているように見えます。基質選別のメカニズムはまだ不明です。つまるところ、どれだけの謎が、異なった基質特異性をもった遺伝的に支配された酵素異性体によって説明されるのか、それを知ることは大変興味あるところです。そのプロセスをコントロ−ルする鋳型や青写真はあるのでしょうか? ヘパリンは1分以内に生合成されると考えられていますが、その様にヘパラン糖鎖も瞬時に全てが作られるのでしょうか? 私はこの問題や関連した疑問は、今後数年以内に数カ所の研究所の努力によって解決すると確信しています。
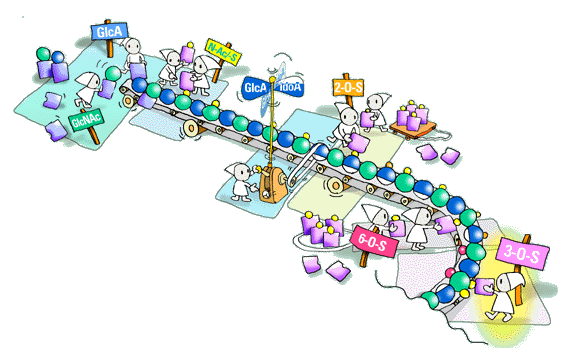
Qヘパラン硫酸糖鎖の微細構造を解析することは容易なことではないようです。どのような方法あるいは技術が将来ヘパラン硫酸研究を発展させるのでしょうか?
ヘパラン硫酸の研究は、概して主要な2つの方向に沿って続けられるでしょう。一つは、既に私たちが語ってきた生合成のメカニズムです。他の一つはヘパラン硫酸ドメインの正確な配列解析で、このなかに特定タンパク質との結合に関係する糖鎖領域が含まれます。配列決定は困難な問題で、タンパク質やポリヌクレオチド解析で遭遇した問題点とは多くの点で異なっております。一つには、もちろん、ヘパラン硫酸分子群の不均質性であり、もう一つは機能的役割に関連する規定された、最小修飾配列を単離し、これを配列決定に供しなければならないことです。その方法には、マススペクトロメトリ−(多数の2糖異性体が存在するため困難な可能性がありますが)、NMRおよび段階的酵素分解などいくつかの選択肢があります。繰り返しますが、我々はきっと数年以内にこの分野で全く劇的な発展を見ることでしょう。明確な目標は、正確なヘパラン硫酸の配列情報を生合成制御メカニズムの理解と結びつけることにあります。