氏名:柳澤 勝彦
国立長寿医療研究センター・痴呆疾患研究部
アルツハイマー病(AD)脳におけるアミロイドβ蛋白(Aβ)凝集は最も早期に出現する中核的病理所見である。Aβは、その前駆体蛋白の生理的代謝により産生される。AD脳において、Aβは凝集しアミロイド線維となって、神経細胞に対して傷害性に働く。本来可溶性のAβが凝集する分子機構の解明は、AD発症病態を理解する上で最も重要な研究課題の一つであるが依然不明のままである。
筆者らは、この問題を解明することを目指し研究を進めた結果、AD初期脳に選択的にGM1ガングリオシドを結合した特異なAβ分子(GM1/Aβ)が見出した1。GM1/ Aβは通常のAβよりもさらに高度な自己凝集性を示し、特異な免疫反応性を示すという実験事実を基に、筆者らは以下のような仮説を提唱した。即ち、AβはGM1と結合することで構造変化を獲得し、その結果としての高度の凝集性によって脳内においてAβアミロイド形成の "seed" として働いている可能性が考えられた。筆者らの提唱した仮説は、その後内外の研究者によってin vitroの実験により検討が加えられた。
Surewictzの研究グループはAβの構造変化をCDスペクトログラフィーを用いて詳細に検討し、GM1の存在下においてAβの二次構造はrandom coilからβ-sheetに移行すること、また合成Aβ溶液にGM1を加えることによりアミロイド線維化が著しく進むことを報告した2。さらに、Mclaurin & Chakrabartty, Matsuzaki & Horikiriによって、GM1/ Aβの形成によって脂質二重膜が傷害される実験事実が紹介され、Aβによる神経毒性の一つがGM1/ Aβ形成を介している可能性が示された3,4。GM1/ Aβの形成機構は不明であるが、この特異なAβ分子は正常対照脳においては認められないことから、GM1が発現している細胞表面において形成されるのではなく、細胞内において何等かのAβの産生ないしは輸送の異常により形成される可能性が考えられる。具体的にはGM1やコレステロールを高い濃度で含有する膜ドメイン(raft, caveolae-like domainなど)がGM1/ Aβ形成の場を提供している可能性を筆者は想定している。
最近、中枢神経系の変性疾患の幾つかに共通する発症基盤を脳を構成する蛋白の構造変化に求める議論が展開されている。プリオン病やCAGリピート病はADとともに、この所謂 "Conformational Disease" に含まれるが、興味深いことに、アミロイドを構成する蛋白が構造変化を獲得するにあたっては、この蛋白以外の分子がmolecular chaperoneとして働くと考えられ、幾つかの分子が確認されている。これまでAβの構造変化および "seed" 活性獲得をもたらす分子の報告はなく、GM1のmolecular chaperoneとしての可能性を今後検討する必要があると考えられる。
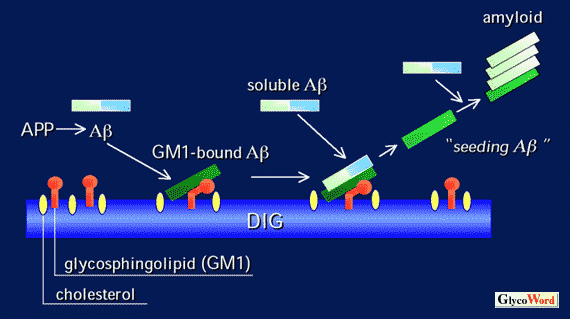
図 想定されるGM1/Aβならびにアミロイド線維の形成機構
DIG: detergent-insoluble glycosphingolipid-rich domain