氏名:神奈木 玲児
愛知がんセンター・分子病態学部
炎症の成立には多数の細胞接着分子が関与する。炎症局所では、白血球は血管外へ遊走するためにまず血管内皮に接着する。この接着の初期段階で、セレクチンファミリーの細胞接着分子が重要な役割を演じる。インテグリンや免疫グロブリンスーパーファミリーに属する細胞接着分子は、接着の後期の過程に関与する。セレクチンとその糖鎖リガンドとを介した細胞接着は白血球を血管内皮表面でローリングさせ、血管内皮に付着したIL-8やMIP-1βなどのケモカインの働きによってインテグリンを活性化し、二次的な細胞接着とシグナル伝達をひきおこす(図 1)。
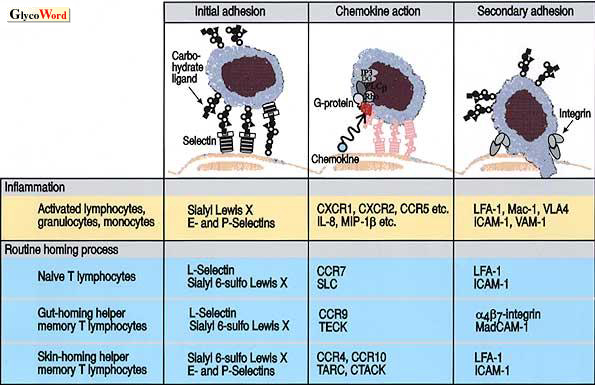
図 1 Molecules involved in adhesion of leukocytes to endothelial cells.
セレクチンファミリーは、E-、P-およびL-セレクチンの三つの構成員からなる。E-セレクチンに対する白血球上の糖鎖リガンドは、1990年代のはじめごろに、シアリルルイスXであることが明らかにされた。セレクチンの分子末端のC型レクチン領域はホモロジーが高いので、これに続いてシアリルルイスXがP−セレクチンのリガンドでもあると報告されたのは驚くに当たらない。しかし、以前からE−セレクチンとP−セレクチンのリガンド特異性には大きな違いがあることが知られていた。E−セレクチンに対するリガンドの結合能はプロテアーゼ処理に影響されないのに対して、P−セレクチンのリガンド活性はプロテアーゼにきわめて弱い。これがきっかけとなって、P−セレクチンリガンドの特異的なコア蛋白質であるPSGL-1 (P-selectin glycoprotein ligand-1) が発見されるに至った。PSGL-1は、シアリルルイスX糖鎖を結合し、かつN末端付近に硫酸化されたチロシン残基を有する。P−セレクチンへの結合には、シアリルルイスX糖鎖と硫酸化チロシン残基とが共にに必要である。これに対しE−セレクチンは、シアリルルイスX糖鎖さえ存在すれば結合する。
急性炎症における白血球の動員において、L−セレクチンがE−やP−セレクチンと同等の重要な役割を演じるかどうかは、まだはっきりしていない。L−セレクチンは元来、リンパ球の末梢リンパ節への生理的なホーミングに関与するとされている。リンパ球が末梢リンパ節へホーミングするに際しては、高血管内皮細静脈(HEV)が入り口の役割をしているが、免疫組織学的な検索によっては、ヒトリンパ節HEVは、奇妙な染色パターンを呈する。HEVは、通常の古典的な抗シアリルルイスX抗体では染色されず、一部の特定の抗シアリルルイスX抗体のみで染色される。のちになって、硫酸化されたシアリルルイスX、すなわちシアリル6-スルホルイスXがHEVに発現されており、L−セレクチンに対するリガンドになっている事が判明した。フコシルトランスフェラーゼと6-スルホトランスフェラーゼ両者のcDNAの遺伝子導入によってはじめてL−セレクチンに対するリガンド活性が細胞膜上に再構成できるが、フコシルトランスフェラーゼcDNA単独ではだめである。このことによって、シアリル6-スルホルイスXがL−セレクチンの特異的リガンドであることがさらに再確認された。
ヒトリンパ節HEVには、通常のシアリルルイスXは検出されず、シアリル6-スルホルイスXが強く発現され、これがL−セレクチン陽性のナイーブT細胞を接着する。これらのナイーブT細胞は、SLCケモカインのリセプターであるCCR7を発現しており、この接着が引き金となって、SLCがT細胞のインテグリンを活性化し、細胞をリンパ節の実質へとホーミングさせることになる(図 1)。
シアリル6-スルホルイスXは、パイエル板や虫垂のHEV様血管にも発現されており、ここでは、L−セレクチン、α4β7 - インテグリン、そしておそらくCCR9の三者ともに陽性の腸管ホーミング性ヘルパーメモリーT細胞を接着する。ここでは、シアリル6-スルホルイスXとL−セレクチンとの接着が引き金となって、ケモカインTECKがCCR9に結合し、α4β7 -インテグリンとMadCAM-1を介して消化管へのホーミングが起こると考えられる。
シアリル6-スルホルイスXは、一部のT細胞にも発現する。このT細胞サブセットは皮膚にホーミングするヘルパーメモリーT細胞であり、CCR7やα4β7 - インテグリンを発現せず、ケモカインTARCのリセプターCCR4を発現している。シアリル6-スルホルイスXは、皮膚血管に発現するE−およびP−セレクチンと結合し、CCR4-TARCケモカインシステムと協調してこれらの細胞の皮膚へのホーミングを媒介すると考えられる。
以上のように、この硫酸基を有するセレクチンリガンドは、これまでに知られた限りでは、主に日常の生理的なホーミング現象に関与している。これと協調してはたらくケモカインも、諸組織に構成的に発現されるいわゆるホメオスタチック(恒常性)ケモカインであり、古典的な炎症性ケモカインではない。一方、通常のシアリルルイスXは非刺激状態のリンパ球にはほとんど発現されず、TPAなどで活性化されると強く発現が誘導される。ヒト末梢血リンパ球を活性化シアリル6-スルホルイスXの発現が消退し、通常のシアリルルイスXが強く誘導される。炎症反応においては、通常のシアリルルイスXがおそらく主役を演じており、シアリル6-スルホルイスXはあまりきわだった働きをしないと考えられる。蛋白質分解酵素によるL−セレクチンの分解や、シアリル6-スルホルイスXのシアル酸部分の修飾などが細胞の活性化にともなって起こり、日常のホーミングについては細胞接着反応の行き過ぎを特に厳格に抑制する機構が備わっている点が注目される。