
氏名:谷口 直之
谷口教授は1967年に北海道大学医学部を卒業、医学博士号を取得し、1972年に同大学院医学研究科博士課程を修了し、医科学博士となった。1975年同大学医学部衛生学講師、1976年から1977年コーネル大学医学部生化学Alton Meister研究室の客員助教授、1977年北海道大学大学院環境科学研究科助教授、1980年同大学医学部癌研生化学牧田 章研究室の助教授を歴任し、1986年大阪大学医学部生化学科の教授として赴任し現在に至っている。1998年から2000年まで文部省特定領域研究(A)「糖鎖リモデリングと細胞コミュニケーション」の代表者を勤め、現在、the American Society for Biochemistry and Molecular Biologyの名誉会員である。2001年には国際複合糖質連合賞受賞、アンリポアンカレ大学名誉博士号授与の栄誉を受けた。2001年には日本生化学会会頭に就任。常任編集委員: J. Biol. Chem., Glycobiology, Glycoconjugate J., Biol. Biophy. Res. Commun.(2002年3月から)等
これまで、およそ110の糖転移酵素およびその関連遺伝子をコードするグライコジ ーンがクローニングされています。これらのクローニングされた遺伝子のいくつかはその機能があきらかになっていますが、これらの遺伝子の多くは実際の機能は不明なままであり、病態生理学的な意義についての情報も限られています。したがって、これらの遺伝子の機能的な意義をあきらかにするためには、生体内での標的分子と考えられるものを同定し、機能的な意義を明らかにすることに焦点をあてるのが重要な戦略でしょう。
グライコジーンのいくつかはすでにノックアウトマウスやトランスジェニックマウスがつくられていますし、あるものは致死であったり、興味深い表現形質がみられてい ます(1-2)。また、種々のCDG (Congenital Disorders of Glycosylation)の患者も報告されています(3-4)。これらの事実から、タンパク質、糖脂質、プロテオグリカンのグリコシレーションは発生、分化、がん化などで必須であることは、明らかです。しかし、問題点は、生体内での実際の標的分子の性状は何かということです。これらの研究で見いだされた表現形質の変化や、患者の症状では、ほとんどの場合、標的分子の説明はできないし、ノックアウトマウスやトランスジェニックマウス、CDGの病態生理をも説明することは不可能です。その理由は、たとえあるグライコジーンをノックアウトしたり、欠損したり、過剰発現してもそれはそのグライコジーンの直接的な結果ではなく、糖鎖が付加されなかったり、過剰発現で付加されたりした標的分子の機能変化による間接的な結果であるからです。
ポストゲノムはまさにFunctional Glycomicsの時代です。
いまやポストゲノム研究の時代が始まり、蛋白質の翻訳後修飾などのプロテオーム解析によるアプローチが重要になっています。しかし、多くのプロテオーム研究でのプロジェクトではタンパク質、脂質、プロテオグリカンなどのグリコシレーションの分析や機能的な解析については十分論議されていません。真の生物学を理解するためには、"Glycomics" 或は "Functional glycomics"とよぶ,より糖鎖生物学や糖鎖工学を統合した概念を導入す るのが相応しいと思います。この研究領域は、グリコシレーションの分析的な項目と同時に機能的な項目に焦点をあてるものです。最近のApweilerらによるSwiss-Protに基づいた報告(5)では、すべての真核生物の蛋白質のおよそ半分以上はグリコシレーションを受けるとされており、おそらく、原核細胞でも同様とされています。
すでにいくつかのグループではグライコーム研究あるいはそのようなアプローチ をとっており(参考文献6-14および、Proteomics,1、特集;翻訳後修飾、Nicolle Packer編集を参照)、事実、ポストゲノム研究の中心的な課題のひとつでしょう。Paulsonらは最近糖鎖結合タンパク質に焦点をしぼったコンソーシアムを組織しています(15)。
Functional glycomicsのための戦略のひとつは、プロテオミックスで行われるように、2次元電気泳動でタンパク質を同定し、ついで、糖鎖を遊離させるためにPNGase Faなどのグリコシダーゼを用いゲル内で処理し、トリプシンなどのタンパク分解酵素でゲル内処理します。タンパク質の分析には抽出したペプチドをMALDI-TOF-MSbにかけます。糖鎖の解析には、糖鎖を蛍光標識し、exoglycosidase等の処理をして、HPLCにかけます(9)。さらに機能を知るためには、目的の遺伝子を細胞に導入して、in vitroで機能を調べることも重要でしょう(6)。この方法は、細胞タンパク質の機能と細胞における "グライコーム" を理解できるからです。さらに重要なのは2次元電気泳動上でのレクチン染色や、レクチンカラム、あるいは糖鎖に対する特異抗体を用いることにより、目的の糖が付加されたタンパク質の同定ができることを強調したいと思います。これらの戦略は、N-グリカン、O-グリカン、GPI-アンカー、プロテオグリカンなどのFunctional glycomicsに応用できるでしょう。 (Fig. 1,Fig. 2)
Functional Glycomics がポストゲノム研究の時代における生命科学のあらたな道を開くことを願っています。
a peptide-N(4)-(N-acetyl-β-D-glucosaminyl) asparagine amidase F
b matrix assisted laser desorption/ionization-time of flight-mass spectrometer
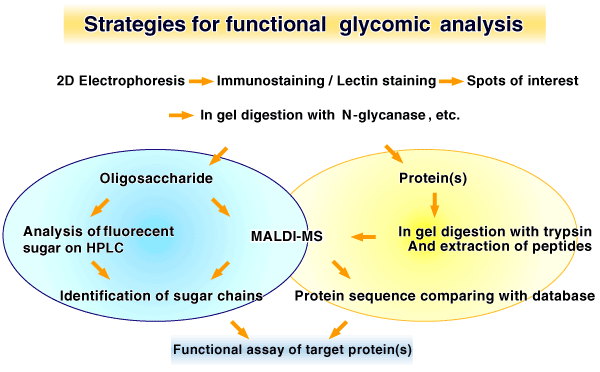
Figure 1
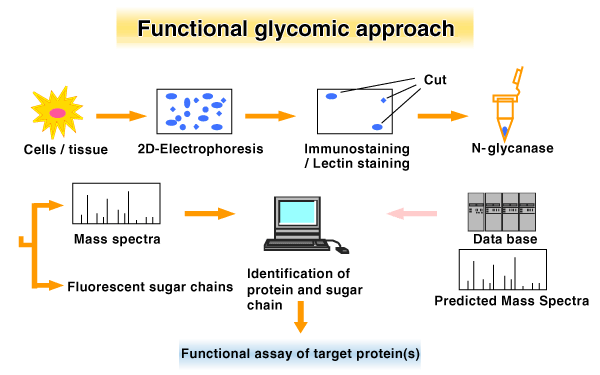
Figure 2