
氏名:細川 暢子
1984年京都府立医大を卒業後、4年間臨床医として勤務し、その後1992年にD. Med. Sci.を授与された。1993年visiting fellowとしてNIH,National Cancer InstituteのCarl Wu博士のもとで研究し、1994年京都大学胸部疾患研究所の永田和宏教授の元で助手に任命された。胸部疾患研究所は改組・転換に伴い再生医科学研究所となり、現在、細川先生はそこの助教授として活躍中である。小胞体のシャペロンタンパク質とその品質管理機構の研究を精力的に進めている。

氏名:永田 和宏
1947年滋賀県に生まれ、京都大学理学部物理学科を卒業した。1979年、Ph.D.を授与された。森永乳業(株)中央研究所に5年間勤務した後、1976年京都大学胸部疾患研究所の市川康夫教授のグループに移り、マウス白血病細胞分化に係わる研究に携わり、1979年講師に任命された。その後NIH、National Cancer InstituteのDr. Kenneth Yamadaのグループに参加し、後にコラーゲン特異的分子シャペロンと同定されたヒートショックタンパク質47 (HSP47)の研究を始めた。1986年胸部疾患研究所の教授となった。胸部疾患研は再生医科学研究所と改組・転換され、現在に至っている。
小胞体(ER: endoplasmic reticulum)では多くの分泌タンパク質や膜タンパク質が生合成されるが、この時、小胞体には品質管理機構(ER quality control mechanism)と呼ばれるシステムが備わっていて、正しくフォールドされたタンパク質のみが分泌され、ミスフォールドしたタンパク質は小胞体内に留められるような仕組みになっている1,2(図1)。細胞質でのタンパク質の生合成の場合と同様に、小胞体内で生合成された新生タンパク質は、小胞体内のシャペロンタンパク質の助けを借りて正しいフォールディングをし、場合によってはオリゴマーを形成したのち、Golgi へと輸送される。細胞質で生合成されるタンパク質との違いは、ひとつは小胞体内は酸化環境下にあるということで(ちなみに細胞質は還元環境にある)、もう一つは小胞体内で生合成されるタンパク質の多くはN-型糖鎖修飾を受けるということである。
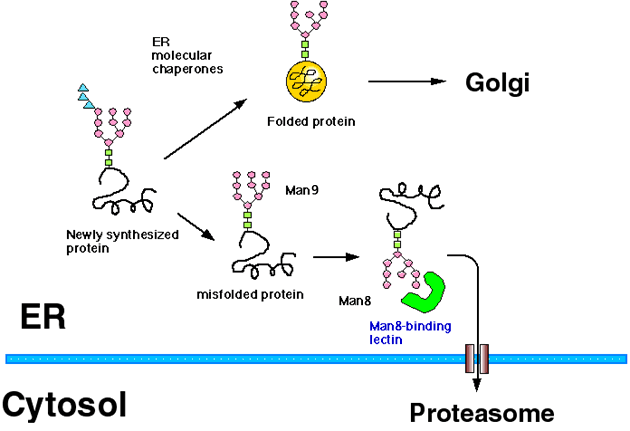
図 1 小胞体品質管理機構と小胞体関連分解の模式図(文献5を改変)
小胞体で生合成されてくるタンパク質の多くはN-型糖鎖修飾を受ける。小胞体内のシャペロンタンパク質のアシストを受けて正しくフォールドしたタンパク質は、小胞体を出てゴルジ装置へと輸送されていく。一方でどうしてもフォールドできないタンパク質は、マンノースが8個にトリミングされた後に、トランスロコンを通って細胞質に逆輸送され、細胞質に存在するプロテアソームによって分解される。この時小胞体内には、Man8B フォームのミスフォールドしたタンパク質を認識してERAD の系へ仕分けをする、レクチン様タンパク質が存在すると予定された。
さて、糖鎖修飾の阻害剤を加えるとか、細胞を還元環境下におくといった、いわゆる小胞体ストレスが細胞に加わった場合、小胞体で生合成されてくるタンパク質の多くはミスフォールドして、場合によっては凝集してしまう。また遺伝子疾患などで、タンパク質のアミノ酸配列に異常が生じた場合にも、生合成されてきたタンパク質は正しくフォールドできなくなることがある。さらに最近、通常のタンパク質の生合成の過程においても、何割かのタンパク質は正しくフォールドできずにミスフォールドしてしまうことが明らかにされている。このようなミスフォールドタンパク質は、とりあえずは小胞体内のGRP78/BiP (glucose-regulated protein78/Immunogloblin heavy chain binding protein) のようなシャペロンタンパク質と結合して、凝集しないように保たれると共に、フォールディング促進の方向にアシストされるが、どうしてもフォールドできないタンパク質は、細胞内で分解されることになる。このような現象は以前から良く知られていたが、近年になって、これらのミスフォールドしたタンパク質の多くは、驚くべきことに、実は小胞体から細胞質に逆輸送されて、細胞質のプロテアソームによって分解されるということが明らかになってきた。この機序は小胞体関連分解(ERAD: ER associated degradation)と呼ばれている3,4(図1)。さらにもう一つ付け加えると、このような異常タンパク質ばかりでなく、小胞体膜上に存在する脂質代謝に関わる酵素の場合などでは、必要に応じた酵素のdown regulation がおこっているが、この時の酵素分解もERAD の系を介して行われていることが知られている。
小胞体内で生合成されてくるタンパク質の多くは、特定のアミノ酸配列上のアスパラギン残基(N)にコア・グリコシレーションと呼ばれる糖鎖 (Glc3Man9GlcNAc2) が付加される。このN-型糖鎖を模式的に図2Aに示した。一番外側のグルコースのトリミングを介して、レクチン活性をもつシャペロンタンパク質カルネキシン、カルレティキュリンと結合し、タンパク質のフォールディングが進行する。ついで、小胞体マンノシダーゼによってMan9GlcNAc2の中央の枝からマンノシダーゼ I によってマンノースのトリミングがおこり、通常はMan8GlcNAc2アイソマーB (Man8B) のフォームになってゴルジ体へと輸送されていく(図2B)。
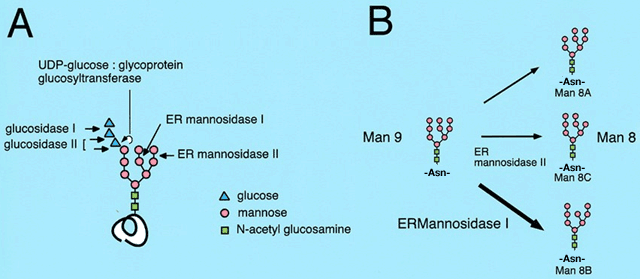
図 2 N-型糖鎖の構造と糖鎖トリミング
A. 小胞体で付加されるN-型糖鎖の構造と、糖鎖のトリミングに関わる酵素を模式的に示した。
B. N -型糖鎖のマンノース・トリミングを模式的に示した。小胞体でのマンノース・トリミングは主としてER mannosidase I によって担われており、その結果Man8B イソマーが形成される。
一方で、ミスフォールドした糖タンパク質がERAD の系によって分解される場合にも、N-型糖鎖のマンノースのトリミングが重要であることがわかっていた(図1)。酵母においても、ヒトにおいても、ミスフォールドしたタンパク質のN-型糖鎖がMan9 フォームだと分解されずに小胞体内に留まっているが、Man8B にプロセスされると、ERAD の系で分解されるようになる、というのである。このような実験事実から、小胞体の中には、ミスフォールドしたMan8B フォームの糖タンパク質を認識してERAD の系につなげる、レクチン様タンパク質(Man8-binding lectin)が存在するであろうと考えられていた5。
先に述べたように、細胞に小胞体ストレスが加わると、小胞体の中にはミスフォールドしたタンパク質が増加するので、小胞体ストレス応答と呼ばれる機構UPR (unfolded protein response) によって6、小胞体シャペロンタンパク質と共に、ERAD に関わるタンパク質の発現も誘導されてくる7,8。私たちは、サブトラクションPCR 法を用いて、小胞体ストレスによって発現が誘導される遺伝子のひとつとして、マウスの新規遺伝子をクローニングした9。この遺伝子は、小胞体に存在するII 型膜タンパク質をコードしており、小胞体マンノシダーゼ (glycosylhydrolase family 47) とホモロジーをもっていた。この遺伝子を細胞に発現させて機能を解析したところ、次に述べるように、ERAD を促進することが明らかとなったので、EDEM (ER degradation enhancing α-mannosidase-like protein) と名付けた9。私たちは、EDEM タンパク質は、まさにこのMan8-binding lectinとして機能しているのではないかと考えている。
EDEM タンパク質は、ヒト小胞体マンノシダーゼ(ER mannosidase I : ER Man I)とアミノ酸レベルで18 %の相同性をもっていたが、酵素活性に重要であることが知られているシステイン 残基は保存されていなかった。すなわちアミノ酸の一次構造から、EDEM タンパク質は、マンノシダーゼとしての酵素活性をもっていない可能性が示唆された。そこで、実際にEDEM をリコンビナントタンパク質としてCOS 細胞に発現させて調べたところ、予想どおり、EDEM にはマンノースをトリミングする活性が見られなかった9。
私たちは、EDEM がMan8-binding lectin として働いている可能性を考えて、機能解析を進めることにした。小胞体関連分解を受けるモデル基質として、α1-antitrypsin の遺伝的variant のひとつ、null Hong Kong (NHK と略)を用いた10。このタンパク質は、小胞体内で正しくフォ−ルドすることができず、ERAD によって細胞内分解を受けることがわかっていた。NHK をHEK 293 細胞にトランスフェクトし、 35Sメチオニン を用いて、パルス-チェイス実験を行うと、図3に示したように、約2時間の半減期で分解されて細胞内から消失する。この時EDEM タンパク質を共発現させると、NHK の細胞内分解が促進され、半減期は約50分に短縮した。さらに私たちは、1. この実験系においても、NHK がERAD の系によって細胞内分解を受けていること、2. 細胞内でEDEM がNHK と結合していること、3. EDEM は、基質タンパク質のN-型糖鎖のマンノース・トリミング状態を認識して結合し、分解を促進していることを示した。これらの結果から、EDEM はミスフォールドした糖タンパク質を認識して、ERAD による分解の系へ繋げる重要な分子であると考えられる。
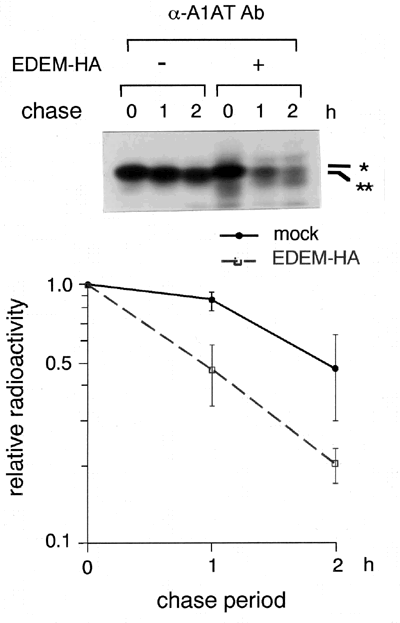
図 3 EDEM によるERAD の促進効果
HEK 293 細胞にα1-antitrypsin variant null Hong Kong (NHK) を発現させたのち、35Sメチオニン を用いてパルス・ラベルを行った。α1-antitrypsin の抗体を用いて、免疫沈降を行った結果を示している。各バンドの放射活性を定量化してグラフ化した結果、NHK の細胞内消失の半減期は約2時間であったが、EDEM を共発現させると約50分に短縮した。EDEM は、NHK のERAD による分解を促進することが明らかとなった。パルス-チェイスの間に、NHK の泳動度が早くなることが観察されるが、これは小胞体内でのマンノース・トリミングの状態を反映していると考えられている(*:Man9 フォーム、**:Man8 フォーム)。
私たちはマウスのEDEM タンパク質をクローニングし、その機能解析を行ったが、ヒトにもホモログタンパク質が存在するし、酵母(Saccharomyces Cerevisiae)にもホモログが存在している。そして、酵母のホモログタンパク質においても、マウスEDEM同様、ミスフォールドした糖タンパク質のERAD を促進することが証明された11,12。
図4に、私たちが考えているEDEM の細胞内機能を模式的に示した。カルネキシンは、初めに述べたように、小胞体で生合成されたタンパク質のフォールディングを促進するシャペロンだが、同時にERAD においても重要な働きをしていることが示されている。実際にEDEM がトランスロコンの近傍に存在するのか、カルネキシンと共同して機能しているのか、これらは今後の課題である。
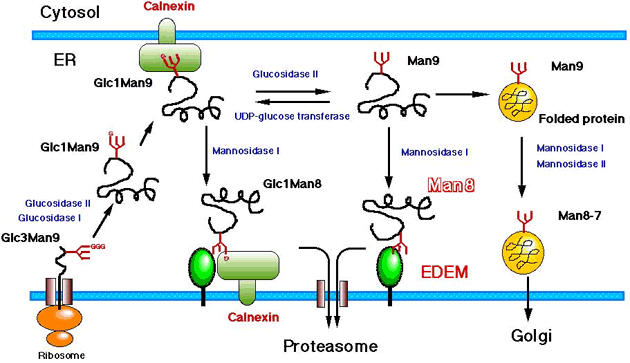
図 4 EDEM の機能を想定した模式図
小胞体で生合成された糖タンパク質がミスフォールドしてしまった場合、N-型糖鎖はMan8B フォームにトリミングされたのちにEDEM と結合する。おそらくEDEM はMan8B の糖鎖を認識して結合しているものと考えている。EDEM と結合することによって、ミスフォールドしたタンパク質はERAD の系で分解されることになる。
小胞体ストレス、UPRと小胞体関連分解に関して、私たちが最近クローニングした、マウスEDEM 遺伝子の機能解析を中心に概説した。
EDEM遺伝子は小胞体ストレスによって発現が誘導されてくる。これはEDEMに限ったことではなく、ERADに関与した多くの分子が小胞体ストレスによって誘導されることが報告されている7。
小胞体は高濃度のカルシウムを有する細胞内コンパートメントであり、その中でタンパク質は酸化されたり、N-型結合糖鎖の修飾を受けたりしている。小胞体ストレスとは、これらの小胞体内環境が障害されることによって、ミスフォールドしたタンパク質が蓄積する状態を言う。このような不都合な状況を切り抜けるため、細胞や組織は幾つかのメカニズムを惹起させて小胞体ストレスに対応する13。まず、小胞体シャペロンタンパク質の転写を誘導して、ミスフォールドしたタンパク質の凝集を防ぎ、これらのタンパク質のフォールディングを促進させる。小胞体から核へのシグナル応答経路はUPR6として知られている。次に、細胞は小胞体内に新たに合成されたタンパク質の負荷を減らすために、eIF-2αをリン酸化してタンパク質合成を抑制する。第三に、先に述べたようにERAD機構を誘導する。これは少なくとも部分的にはUPRによって制御されている。第四の最後の対応メカニズムは細胞のアポトーシスである。多細胞生物は重度に傷害された細胞を除去することで、小胞体ストレスに打ち勝ち、個体として生き延びる。
ERADシステムは今や種々の細胞メカニズムに関係していることが明らかになっている。様々なタンパク質フォールディング異常に基づく疾患と小胞体ストレスの関係について、さらなる研究が進められている。