Sep. 19, 2002
主要異種糖鎖抗原のリモデリング(2002 Vol.06, A9)
宮川 周士 / 白倉 良太 / 谷口 直之
氏名:宮川 周士
医学博士。大阪大学大学院医学系研究科・組織再生医学・臓器置換学分野・助教授。1981年北海道大学医学部卒業後、大阪大学第一外科に入局し、レジデント期間中に一般外科、心臓血管外科の訓練を受ける。医学訓練に加えて、discordantの異種移植の拒絶機構、特に補体alternative pathwayの活性化の研究に従事した。1989年に大阪大学から博士号を授与される。アメリカ、テキサス大学ヒユ−ストン校の臓器移植科でフェローとして働いた後、異種移植の研究に戻る。1994年からは酵素学的なリモデリングによる異種抗原の抑制をねらって、基礎糖鎖生物学、特に糖鎖抗原の研究を行っている。現在はトランスジェニックやノックアウトブタにも興味を注いでいる。
趣味---スキー、ハイキング
氏名:白倉 良太
医学博士。大阪大学大学院医学系研究科・組織再生医学・臓器置換分野・教授。1968年大阪大学医学部卒業後、同第一外科に入局し、一般外科、小児外科、胸部心臓血管外科のレジデントの訓練を受ける。数年にわたりいくつかの病院で研究および臨床のフェローとして過ごした後、大阪大学にもどり移植免疫、特に組織タイピングの研究に従事。1976年に博士号を授与される。1980年6月より1981年3月まで派遣交換研究員としてロンドン大学心臓血管外科に所属し、その後、臓器摘出・臓器保存の研究に従事。1990年現在の講座の助教授、1994年教授。現在異種移植の研究、特にトランスジェニックやノックアウトブタに興味を注いでいる。
趣味---ゴルフ、ハイキング、音楽
氏名:谷口 直之
谷口教授は1967年に北海道大学医学部を卒業、医学博士号を取得し、1972年に同大学院医学研究科博士課程を修了し、医科学博士となった。1975年同大学医学部衛生学講師、1976年から1977年コーネル大学医学部生化学Alton Meister研究室の客員助教授、1977年北海道大学大学院環境科学研究科助教授、1980年同大学医学部癌研生化学牧田 章研究室の助教授を歴任し、1986年大阪大学医学部生化学科の教授として赴任し現在に至っている。1998年から2000年まで文部省特定領域研究(A)「糖鎖リモデリングと細胞コミュニケーション」の代表者を勤め、現在、the American Society for Biochemistry and Molecular Biologyの名誉会員である。2001年には国際複合糖質連合賞受賞、アンリポアンカレ大学名誉博士号授与の栄誉を受けた。2001年には日本生化学会会頭に就任。常任編集委員: J. Biol. Chem., Glycobiology, Glycoconjugate J., Biol. Biophy. Res. Commun.(2002年3月から)等
1. はじめに
世界的なドナー不足のため異種移植に期待が寄せられている。異種移植は拒絶反応の様式によりconcordantとdiscordantに分類され、サルからヒトへの移植とブタからヒトへの移植がそれぞれにあたる。
ブタは解剖学的、生理学的、倫理的な理由などからdiscordantの異種移植にもっとも適している。しかし、ブタの細胞や組織、臓器をヒトの血と接触させると、いわゆる超急性拒絶反応が起こる。これは、ヒトのもつ自然抗体と補体による反応である。この拒絶反応に対応する主要異種抗原は、α-Gal エピトープ( Galα1-3Galβ1-4GlcNAc-R)と呼ばれる糖鎖構造を示し、ブタを含む多くのほ乳類に発現されている。このα-Gal エピトープは最初ウサギの赤血球の糖脂質から抽出され、タイプ1 の糖鎖と報告されたが、後にタイプ2 と訂正された。この抗原が、ガラクトース転位酵素であるα1,3 galactosyltransferase (α1,3GT)が作り出す、ブタからヒトへの異種移植での主要抗原である1-3。ヒトと旧世界のサルはこの構造の糖鎖は作り出す事ができない。それはα1,3GTの2 ケ所に変異が入りフレイムシフトが起こった偽遺伝子になっているからである。α-Gal エピトープに対応する抗α-Gal抗体は、腸内細菌群に常在するα-Gal エピトープ様のものに常にさらされる事で産生されていると考えられている。そのため、ヒトは循環するIgGの1 %およびかなりの量のIgMを、α-Gal エピトープに対する自然抗体として持っている4,5。
超急性拒絶反応に打ち勝つためにmembrane cofactor protein (MCP; CD46)、やdecay accelerating factor (DAF; CD55) 、および CD59 (MACIF, HRF20)などの補体制御因子をグラフトに発現させることは究めて効果的であるとわかった6。そして次の段階として、遺伝子工学的に糖転位酵素に手を加えることにより超急性拒絶反応や急性血管拒絶(acute vascular rejection)に打ち勝つ方法が考えられている。急性血管拒絶とは、異種抗体の反応とそれに続くグラフトの内膜の反応、小規模な補体の活性化、凝固系の種差による不一致などによって引き起こされる拒絶反応である。
2. α-Gal エピトープを抑制する作戦
2-1. ノックアウト (図 1 赤で表示)
これはES 細胞(胚性幹細胞)や体細胞からの核移植を行う方法を使ってα1,3GTをノックアウトする方法である。ブタではES 細胞が開発されておらず、ES 細胞を使って相同組み換えを起こす遺伝子ダーゲッテイングは現時点で望めない。しかし、体細胞からブタの卵への核移植の方法がいくつかの機関で確立され7、既に2つのグループから線維芽細胞の核を移植する方法でα1,3GTがヘテロでノックアウトされた8,9。
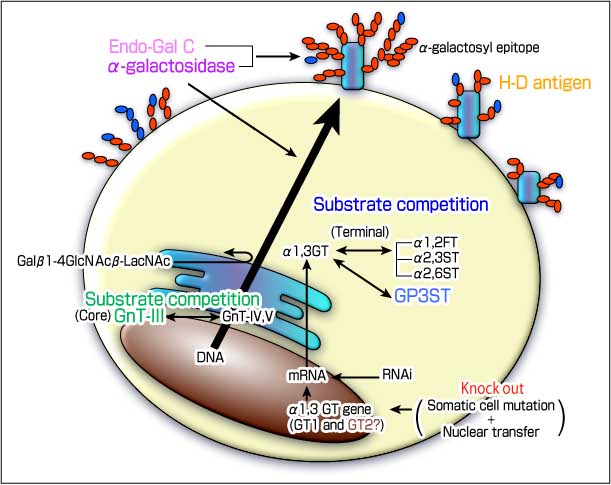
図 1 α-ガラクトシルエピトープを抑制するためのいろいろな作戦
α-1,3ガラクトース転位酵素により生合成.されたα-ガラクトシルエピトープはブタからヒトへの異種移植における超急性拒絶反応に強く関与している。このエピトープを抑制あるいは除去するためのいろいろな作戦がとられている。
この遺伝子のノックアウトに関しては、先にマウスで作られている。野生型に比べてこのノックアウトマウスの細胞や組織はヒト血清中の異種抗体との反応は減少しており、ヒトの補体に対する反応も少ない。しかし、4-6週令で白内障を引き起こすことになる10,11。
組織のα1,3GTの活性という点では、マウスは多くの臓器でブタに比して低く、肺を除くと我々の調べでは10倍くらいの差がある12。また、Galili らはブタの臓器でのα-Gal エピトープの発現量はマウスより500倍多いとしている3。従って、α1,3GTのノックアウトブタということになると、重大な奇形を伴ったり、致死であったりする可能性が残っている。
GT2(図 1 茶色で表示)
Sandrinらは第6回の国際異種移植学会で、ブタには、GT1とGT2という名で、α1,3GTが2ケ所に存在することを示した。GT2はGT1とはっきり異なるコードであるがα-Gal エピトープを作り出すことができる。またこれはα-Galエピトープに結合するGriffonia simplicifolia 1 isolectin (GSIB4 レクチン)を使った染色で証明された13。この遺伝子の存在に関してはさらに研究する必要があるようである。
2-2. 糖鎖合成における競合 (図 1 緑で表示)
α-Gal エピトープを下げる方法についてはいろいろ報告されている。その一つは、β-D-mannoside β-1,4-N-acetylglucosaminenyltransferase III (GnT-III) を使って糖鎖合成をコントロールすることである。これにより細胞表面全体の抗原性を変えることになる。我々は遺伝子導入したブタの血管内皮細胞を使ってこのα-Gal エピトープの減少を示した。GnT-IIIはN-型糖鎖の幹部(コアのマンノース)にN-acetylglucosamine (GlcNAc) を付ける働きがある。そして幹部にGlcNAcを付けると他の糖転位酵素の働きを妨げることになる。つまり、一旦このGlcNAcがGnT-IIIの働きによりN-型糖鎖のマンノースの間にそれらを分ける様に挿入されると、相反する働きを持つα-3-D-mannoside β-1,4- N-acetylglucosaminyltransferase IV (GnT-IV) やα-6-D-mannoside β-1,6- N-acetylglucosaminyltransferase V (GnT-V) はゴルジ装置のなかで3本側鎖の構造を取り得なくなり、結果的に、この挿入されたGlcNAcがコンプレックスタイプの形成を妨げ、α-Gal エピトープの数は減少することになる。
このGnT-IIIの効果の欠点は、N-型糖鎖が強い抗原性を持つと考えられているが、これにしか効かないことである。従って、O-型糖鎖や糖脂質には基本的に効果がない14,15。
2-3. 糖鎖末端での基質に対する競合 (図 1 青で表示)
α-Gal エピトープを抑制する他の方法は、ゴルジネットワークで、α1,3GTと他の糖転位酵素が共通する基質を奪い合うことを利用して、糖鎖末端をフコシル化、シアリル化することである。いろいろな糖転位酵素, α1,2 fucosyltransferase (α1,2FT)、 α2,3 sialyltransferase (α2,3ST)、およびα2,6 sialyltransferase (α2,6ST)にはこの可能性がある。中でもα1,2FTの遺伝子導入はすばらしくα-Galを抑制すると報告されている16。 Sandrinらはブタの腎臓の線維芽細胞を使った実験で約70 %のα-Galの低下を報告している17。また、Sharmaらもこのアプローチの有効性をα1,3GTとα1,2FTの両方をCHO細胞に導入することで証明している18。両者ともこのα-Galを減らす方法がトランスジェニックマウスでもきわめて有効であるとしている。加うるに、α1,2FTを発現するブタは既にいくつかのグループで報じられている。しかし、欠点としては、SeppらはLewisX の発現はバックグランドレベルに落ちるが、LewisYという新しいエピトープがα1,2FTのブタの細胞で誘導されることを示している19。
一方、我々は、α2,3STやα2,6STは、α1,2FTよりも有効にブタの細胞のヒト自然抗体に対する抗原性を下げる事を報告し、加えて、GnT-IIIとα2,3STの共発現で約80 %の異種抗原を下げる事も証明した20。
2-4. GP3ST (図 1 空色で表示)
新しい硫酸転位酵素であるglycoprotein-3-sulfotransferase (GP3ST)は非還元のβ-galactosideを持つ糖鎖にも効き、タイプ 1 (Galβ1-3GlcNAc-R) と タイプ 2 (Galβ1-4GlcNAc-R)の両方の糖鎖に同じ様に効果がある。GP3STの作用は糖鎖末端での競合阻害をおこすα1,2FTやα2,6STと同様にα-Gal エピトープを抑える。また、GP3STの基質特異性はα2,6STとほぼおなじである。
我々の研究では、GP3STによりα-Gal エピトープのような異種抗原を抑制する方法は、α2,6STに近いがα2,6STよりは少し弱く、α1,2FTとほぼ同等であった。また、GP3STは糖蛋白と糖脂質の両方のα-Gal エピトープを抑える効果がある21,22。
2-5. α-galactosidase 処理 (図 1 紫で表示)
α-ガラクトシダーゼにより細胞表面のα-Gal エピトープを取り除くのは、効果的なアプローチであり、これの遺伝子導入もまた効果的である。しかし、ブタの細胞ではこのα-ガラクトシダーゼは著しい効果を示すが、トランスジェニックマウスではわずかに15-20 %のα-Gal エピトープを下げる効果しか示さなかった。 別の方法としては、α-ガラクトシダーゼとα1,2FTの両方をトランスジェニックすることがα-Gal エピトープを下げるのに効果的だとしている報告がある23。
2-6. Endo-β-galactosidase C (Endo Gal C) (図 1 桃色で表示)
この酵素はClostridium perfringensの培養液から抽出、精製された。Galα1-3Galβ1-4GlcNAcからなる構造のβ1-4でつながる部位を切ることによりα-Gal エピトープを分解する。In vitro でもex vivoの潅流の際でも効果があり、加えて、このEndo-Gal Cはブタやサルに静注しても重大な副作用はおこさない。この薬はドナー組織の α-Gal エピトープを一時的に抹消するのに便利であるが、現時点ではこれのトランスジェニック動物は出来ていない24。
2-7. その他
糖転位酵素のコンビネーションのアプローチである、α2,3ST と GnT-IIIとか α-galactosidase とα1,2FTとかは既に α-Gal エピトープを抑える効果があることは証明されている。従って、現時点ではGnT-IIIとフコース転位酵素かシアル酸転位酵素、そしてα-galactosidaseなどの3者の混合が異種抗原を落すもっとも効果的な方法かもしれない。言うまでもなく、超急性拒絶反応に打ち勝つ最良の方法は、2、3の補体制御因子を、これら混合して用いる糖転位酵素と同時に発現させなければならないであろう20, 25。
3. H-D 抗原 (図 1 黄色で表示)
Hanganutziu-Deicher (H-D) 抗原はglycolylneuraminic acid (NeuGc)のことで、ヒトを除くほ乳類に広く分布している。このNeuGcはcytidine monophospho-N-acetylneuraminic acid (CMP-NeuAc) 水酸化酵素の活性に依存している。ヒトでこのNeuGcがないのは、CMP-NeuAc 水酸化酵素の遺伝子に部分的な欠損があるからである26,27。従って、α-Gal エピトープがノックアウトされた後、このエピトープはブターヒト間の異種移植で最大の抗原になる可能性を秘めている。
この抗原を抑制するために、CMP-NeuAc水酸化酵素遺伝子のノックアウトを含め、いろいろな方法が考えられている28。幸いGnT-IIIはなにもα-Gal エピトープに限った効果ではないので、このH-D抗原を下げる可能性はある。
一方、小林らは健康ボランテイアと、ブタの腎臓の潅流を受けた1-3週後の、あるいはブタのラ氏島細胞の移植を受けた1か月後の患者の間でNeuGc-GM3に対するIgG やIgMの平均値に差はなかったと報告している29。
4. 糖転位酵素のトランスジェニックブタ
糖転位酵素のトランスジェニックブタに関しては、4つのグループがα1,2FTのトランスジェニックブタを報告している。最初の報告は名古屋のグループからであった。彼らは実際的にα1,2FTのトランスジェニックブタを作り出したが、それをline化しきちんとした解析をするには至らなかった。次はNextran社からであったが、ブタのシッポのデータを示しただけにとどまった。次はAlexion社からであった。彼らはH2KbとCMVのプロモーターの両方を使いトランスジェニックブタを作り、多くの組織で高発現を得、主に線維芽細胞でその細胞表面の変化を追っている。ここで、α1,2FTのトランスジェニックブタの血管内皮では50 %の α-Gal エピトープが抑制されている事が示されたが、移植実験は行われなかった30。 この他に、CD55 (DAF)と α1,2FT 、また、CD55とCD59と α1,2FTという組み合わせのトランスジェニックブタの報告がCowanらによってなされた。これは補体制御因子と糖転位酵素のコンビネーションが重要であることの証明であったが、α1,2FTの発現は少なくα-Gal エピトープは有意には落ちていなかった。31
他の糖転位酵素に関しては、我々の経験ではα2,3ST およびα2,6STの活性のあるトランスジェニックブタを作るのは困難であることが分かっている。
一方、GnT-IIIの発現はトランスジェニックブタで比較的楽に得られる。トランスジェニックブタでのGnT-IIIの発現は多くの組織や細胞でその表面の糖鎖、特にα-Gal エピトープをハッキリと変化させ、ヒトの自然抗体に対する抵抗性を与えた。このアプローチは抗原性全体のリモデリングとなり、単にα-Gal エピトープだけでなくH-D抗原や他の未知の抗原を制御することにもなる12。(図2)

図 2 GnT-IIIトランスジェニックブタ
我々は数lineのGnT-IIIのトランスジェニックブタを作る事に成功した。このブタはGnT-IIIを過剰発現させることでヒトの自然抗体と反応する抗原、特にα-ガラクトシルエピトープを抑制していることがいろいろな解析により判明している。
5. 展望
異種移植の分野における免疫学的障壁はもっと良くわかるようになり、これに対する有効な方法が最近打ち出されている。現時点おいては、ノックアウトしか、α-Gal エピトープを完全になくすことはできない。ブタの血管内皮には約20 x 106のα-Gal エピトープが発現している事を考えると、Galili はこれを95 %下げたとしても異種移植の拒絶反応は防げないとしている。さらに、α1,3GTをノックアウトしても10-30 %の異種抗原はブタの細胞表面に残ることになる3。
異種移植の臨床を成功させるには、異種抗原を除去するさらなる試みが要求されている。
References
- Eto T, Ichikawa Y, Nishimura K, Ando S, Yamakawa T: Chemistry of lipid of the posthemyolytic residue or stroma of erythrocytes. XVI. Occurrence of ceramide pentasaccharide in the membrane of erythrocytes and reticulocytes of rabbit. J. Biochem. (Tokyo), 64, 205-213, 1968
- Stellner K, Saito H, Hakomori, S: Determination of aminosugar linkages in glycolipids by methylation. Aminosugar linkages of ceramide pentasaccharides of rabbit erythrocytes and of Forssman antigen. Arch. Biochem. Biophys., 155, 464-472, 1973
- Galili U: The alpha-gal epitope (Gal alpha 1-3Gal beta 1-4GlcNAc-R) in xenotransplantation. Biochimie, 83, 557-563, 2001
- Galili U, Rachmilewitz EA, Peleg A, Flechner I: A unique natural human IgG antibody with anti-alpha-galactosyl specificity. J. Exp. Med., 160,1519-1531, 1984
- Miyagawa S, Shirakura R, Iwata K, Nakata, S, Matsumiya G, Izutani H, Matsuda H, Terado A, Matsumoto M, Nagasawa S, Seya T: Effects of transfected complement regulatory proteins, MCP, DAF, and MCP/DAE hybrid, on complement-mediated swine endothelial cell lysis. Transplantation, 58, 834-840, 1994
- Rosengard AM, Cary NRB, Langford GA, Tucker AW, Wallwork J, White DJG: Tissue expression of human complement inhibitor, decay-accelerating factor, in transgenic pigs. A potential approach for preventing xenograft rejection. Transplantation, 59, 1325-1333, 1995
- Onishi A, Iwamoto M, Akita T, Mikawa S, Takeda K, Awata T, Hanada H, Perry ACF: Pig cloning by microinjection of fetal fibroblast nuclei. Science, 289, 1188-1190, 2000
- Dai Y, Vaught TD, Boone J, Chen SH, Phelps CJ, Ball S, Monahan JA, Jobst PM, McCreath KJ, Lamborn AE, Cowell-Lucero JL, Wells KD, Colman A, Polejaeva IA, Ayares DL: Targeted disruption of the alpha1,3-galactosyltransferase gene in cloned pigs. Nature Biotechnol., 20, 251-255, 2002
- Lai L, Kolber-Simonds D, Park KW, Cheong HT, Greenstein JL, Im GS, Samuel M, Bonk A, Rieke A, Day BN, Murphy CN, Carter DB, Hawley RJ, Prather RS: Production of alpha-1,3-galactosyltransferase knockout pigs by nuclear transfer cloning. Science, 295, 1089-1192, 2002
- Thall AD, Maly P, Lowe JB: Oocyte Gal alpha 1,3Gal epitopes implicated in sperm adhesion to the zona pellucida glycoprotein ZP3 are not required for fertilization in the mouse. J. Biol. Chem., 270, 21437-21440, 1995
- Tearle RG, Tange MJ, Zannettino ZL, Katerelos M, Shinkel TA, Van Denderen BJW, Lonie AJ, Lyons I, Nottle MB, Cox T, Becker C, Peura AM, Wigley PL, Crawford RJ, Robins AJ, Pearse MJ, dユApice AJF: The alpha-1,3-galactosyltransferase knockout mouse. Implications for xenotransplantation. Transplantation, 61, 13-19, 1996
- Miyagawa S, Murakami H, Takahagi Y, Nakai R, Yamada M, Murase A, Koyota S, Koma M, Matsunami K, Fukuta D, Fujimura T, Shigehisa T, Okabe M., Nagashima H, Shirakura R, Taniguchi N: Remodeling of the major pig xenoantigen by N-acetylglucosaminyltransferase III in transgenic pig. J. Biol. Chem., 276, 39310-39319, 2001
- Sandrin MS, Milland JA, Taylor S, Lazarus B, Dodson H, Xing P-X, McKenzie FC: A second galactosyltransferase which synthesises the major xenoepitope Gal alpha (1,3)Gal. Xenotransplantation, 8, 27, 2001
- Tanemura M, Miyagawa S, Ihara Y, Matsuda H, Shirakura R, Taniguchi N: Significant downregulation of the major swine xenoantigen by N-acetylglucosaminyltransferase III gene transfection. Biochem. Biophys. Res. Commun., 235, 359-364, 1997
- Taniguchi N, Yoshimura M, Miyoshi E, Ihara Y, Nishikawa A, Fujii S: Remodeling of cell surface glycoproteins by N-acetylglucosaminyltransferase III gene transfection: modulation of metastatic potentials and down regulation of hepatitis B virus replication. Glycobiology, 6, 691-694, 1996
- Koma M, Miyagawa S, Honke K, Ikeda Y, Koyota S, Miyoshi S, Matsuda H, Tsuji S, Shirakura R, Taniguchi N: Reduction of the major xenoantigen on glycosphingolipids of swine endothelial cells by various glycosyltransferases. Glycobiology, 10, 745-751, 2000
- Sandrin MS, Fodor WL, Mouhtouris E, Osman N, Cohney S, Rollins SA, Guilmette ER, Setter E, Squinto SP, McKenzie IF: Enzymatic remodelling of the carbohydrate surface of a xenogenic cell substantially reduces human antibody binding and complement-mediated cytolysis. Nature Med., 1, 1261-1267, 1995
- Sharma A, Okabe J, Birch P, McClellan SB, Martin MJ, Platt JL, Logan JS: Reduction in the level of Gal(alpha1,3)Gal in transgenic mice and pigs by the expression of an alpha(1,2)fucosyltransferase. Proc. Natl. Acad. Sci., USA. 93, 7190-7195, 1996
- Sepp A, Skacel P, Lindstedt R, Lechler RI: Expression of alpha-1,3-galactose and other type 2 oligosaccharide structures in a porcine endothelial cell line transfected with human alpha-1,2-fucosyltransferase cDNA. J. Biol. Chem., 272, 23104-23110, 1997
- Miyagawa S, Tanemura M, Koyota S, Koma M, Ikeda Y, Shirakura R, Taniguchi N: Masking and reduction of the Galactose-alpha1,3-Galactose (alpha-Gal) epitope, the major xenoantigen in swine, by the glycosyltransferase gene transfection. Biochem. Biophys. Res. Commun., 264, 611-614, 1999
- Koma M, Miyagawa S, Honke K, Nakai R, Miyoshi S, Ohta M, Matsuda H, Shirakura R, Taniguchi, N: The Possibility of Reducing Xenoantigen Levels with a Novel Gal 3'-Sulfotransferase (GP3ST). J. Biochem. (Tokyo), 131, 517-522, 2002
- Honke K, Tsuda M, Koyota S, Wada Y, Iida-Tanaka N, Ishizuka I, Nakayama J, Taniguchi N: Molecular cloning and characterization of a human beta-Gal-3'-sulfotransferase that acts on both type 1 and type 2 (Gal beta 1-3/1-4GlcNAc-R) oligosaccharides. J. Biol. Chem., 276, 267-274, 2001
- Osman N, McKenzie IFC, Ostenried K, Ioannou YA, Desnick RJ, Sandrin MS: Combined transgenic expression of alpha-galactosidase and alpha1,2-fucosyltransferase leads to optimal reduction in the major xenoepitope Galalpha(1,3)Gal. Proc. Natl. Acad. Sci. USA, 94, 14677-14682, 1997
- Ogawa H, Muramatsu H, Kobayashi T, Morozumi K, Yokoyama I, Kurosawa N, Nakao A, Muramatsu T: Molecular cloning of endo-beta -galactosidase C and its application in removing alpha -galactosyl xenoantigen from blood vessels in the pig kidney. J. Biol. Chem., 275, 19368-19374, 2000
- Tanemura M, Miyagaywa S, Koyota S, Koma M, Matsuda H, Tsuji S, Shirakura R, Taniguchi N: Reduction of the major swine xenoantigen, the alpha-galactosyl epitope by transfection of the alpha2,3-sialyltransferase gene. J. Biol. Chem., 273, 16421-16425, 1998
- Chou HH, Takematsu yH, Diaz S, Iber J, Nickerson E, Wright KL, Muchmore EA, Nelson DL, Warren ST, Varki A: A mutation in human CMP-sialic acid hydroxylase occurred after the Homo-Pan divergence. Proc. Natl. Acad. Sci., USA. 95, 11751-11756, 1998
- Irie A, Koyama S, Kozutsumi Y, Kawasaki T, Suzuki A: The molecular basis for the absence of N-glycolylneuraminic acid in humans. J. Biol. Chem., 273, 15866-15871, 1998
- Koike C, Fung JJ, Starzl, Trucco M: Isolation and characterization of CMP-NeuAc hydroxylase gene for expression of Hanganutziu-Deicher antigen. Xenotransplantation, 8, 12, 2001
- Kobayashi T, Yokoyama I, Suzuki A, Abe M, Hayashi S, Matsuda H, Morozumi K, Breimer, ME, Rydberg L, Groth CG, Tibell A, Korsgren O, Takagi H, Nakao A: Lack of antibody production against Hanganutziu-Deicher (H-D) antigens with N-glycolylneuraminic acid in patients with porcine exposure history. Xenotransplantation, 3,177-180, 2000
- Costa C, Zhao L, Burton WV, Bondioli KR, Williams BL, Hoagland TA, Ditullio PA, Ebert KM, Fodor WL: Expression of the human alpha1,2-fucosyltransferase in transgenic pigs modifies the cell surface carbohydrate phenotype and confers resistance to human serum-mediated cytolysis. FASEB J., 13, 1762-1773, 1999
- Cowan PJ, Aminian A, Barlow H, Brown AA, Chen CG, Fisicaro N, Francis DMA, Goodman DJ, Han W, Kurek M, Nottle MB, Pearse MJ, Salvaris E, Shinkel TA, Stainsby GV, Stewart AB, dユApice AJF: Renal xenografts from triple-transgenic pigs are not hyperacutely rejected but cause coagulopathy in non-immunosuppressed baboons. Transplantation, 69, 2504-2515, 2000




