
氏名:本家 孝一
1983年に、北海道大学医学部を卒業して医師免許を取得。1984年から北海道大学医学部附属癌研究施設の牧田章教授の研究室で研究を開始して以来、ずっと糖脂質の代謝と機能に関する研究を続けている。1994年医学博士を取得。1995年から1999年まで大阪府立母子保健総合医療センター研究所の主任研究員を務めた。1999年から大阪大学大学院医学系研究科生化学・分子生物学講座の助教授を務めている。主要な業績は、硫酸化糖脂質を生合成する硫酸転移酵素の分離精製、遺伝子クローニング、ジーンターゲッティングとβGal 3-硫酸転移酵素遺伝子ファミリーの発見である。
生命体は、多種類の構成要素がいたるところで絶え間ないクロストークを行ないながら、全体として調和を保ちつつ、円滑な生命活動を維持している。このクロストークは分子間、細胞間、組織間、臓器間、個体間とさまざまな階層レベルで営まれ、各階層レベルの構成要素は複雑なネットワークを形成している。複雑系の理論によると、多数の構成要素が他の要素と絶えず相互作用を行うと、全体としては、部分の働きの総和以上の何らかの独自のふるまいを示すようになる。これは非線形現象を意味しており、自己組織化ともよばれる。これにより上位階層が形成されると考えられる。
生命の設計図は遺伝子であるが、遺伝子から個体ができるまでには多段階の階層が存在する。例えば、糖鎖の合成に関与する糖鎖遺伝子を例にとってみると、糖鎖遺伝子、糖鎖合成酵素、糖鎖(複合糖質)、分子複合体(細胞形成)、細胞間ネットワーク(組織形成)、組織間ネットワーク(臓器形成)、臓器間ネットワーク(個体形成)と7つの階層が存在する(図1)。これらの階層間を一足飛びに越えてメカニズムを解明することは不可能である。このため、ある遺伝子のノックアウトによって第5〜7層の組織形成〜個体形成レベルの異常が観察され、その遺伝子が必須であることが証明されても、そのメカニズムは簡単にはわからない。時間と労力はかかるが、各階層で起こっている事象を一つずつ積み上げて、次の階層の変化に関連付けるという地道な研究によってのみ真実が明らかになる。
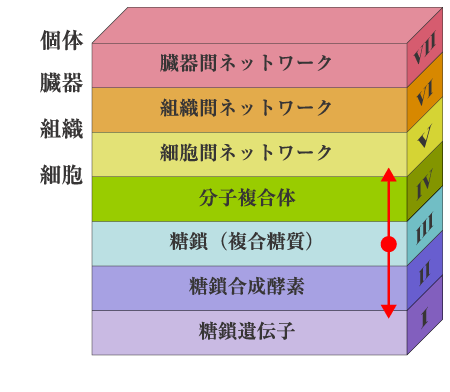
図 1 生命活動の階層
糖鎖は、図1の階層の中で第3層にあたる。これはちょうど階層構造の中央に位置し、ここを研究のベースキャンプにすると上層にも下層にも行くことができるので、自己組織化を研究するにはもってこいの研究対象といえる。本シリーズのテーマ“Beyond Glycogenes”(糖鎖遺伝子をこえて)は、まさにこのスタンスに立って、糖鎖の生物学的機能の理解を目指すことと著者は信じる。
著者は、硫酸化糖脂質の生物学的機能を研究している。哺乳動物には二つの主要な硫酸化糖脂質が存在する1, 2(図2)。一つはスルファチドで、これはスフィンゴ脂質である。もう一つはセミノリピドで、グリセロ脂質である。スルファチドはミエリン鞘の主要な脂質成分で、ミエリン産生細胞で合成される1。セミノリピドは精母細胞で合成され、それ以降の胚細胞系譜に発現している2。このように硫酸化糖脂質は組織特異的に分布しているので、これら発現場所において何らかの生物学的役割をはたしていることを想像させる1, 2。
スルファチドとセミノリピドの糖鎖部分は同じ構造をしており、共通の酵素、すなわちセラミドガラクトシルトランスフェラーゼ3(CGT, EC 2.4.1.45)とセレブロシドスルフォトランスフェラーゼ4, 5(CST, EC 2.8.2.11)によって触媒される一連の反応で合成される(図2)。CGTは小胞体に局在し、CSTはゴルジ膜に局在している。両者の遺伝子欠損マウスの作製6-8により、これらの酵素にはアイソザイムが存在しないことが証明されている。また、硫酸化糖脂質の組織分布は、主として組織特異的なCGT遺伝子の発現によって制御されている。CST遺伝子の発現も組織特異的であるが、CGT遺伝子ほど厳密ではない9。オリゴデンドロサイトや精母細胞における硫酸化糖脂質発現のメカニズム、ひいてはCGT遺伝子とCST遺伝子の発現機構を追究することは、生命活動の階層(図1)を下に進むことを意味する。これらの組織におけるCGT遺伝子とCST遺伝子の発現制御の関連性は、硫酸化糖脂質の分子進化を考える上で、興味深い問題である。
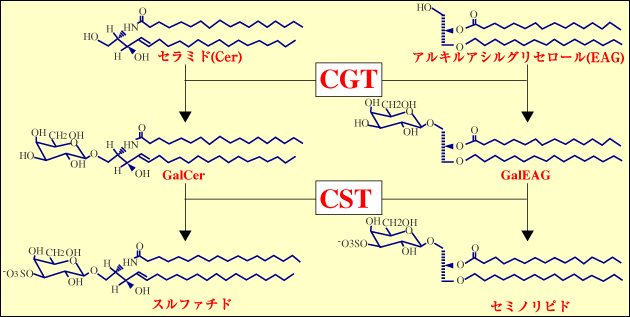
図 2 スルファチドとセミノリピドの構造と生合成経路
神経線維におけるインパルスの伝導速度を高めるために、脊椎動物が進化の過程で獲得した形質がミエリンである。ミエリンは脂質に富み、限られた数の特異的なタンパク質成分をもつユニークな生体膜である。中枢神経系では、オリゴデンドロサイトが莫大な量のミエリンを産生する。オリゴデンドロサイトの形質膜が伸展してできた膜がニューロン軸索の周りを幾重にも取り巻いて多層構造を形成する。隣り合うミエリン鞘の間隙はランビエの絞輪と呼ばれ、ミエリン膜はここで折れ曲がって側方ループを形成する10(図3)。このミエリンループはパラノード部位で軸索膜に接着して、隔壁様の接着結合の形成に与る。この特別なアクソン-グリアジャンクションは、軸索膜のノード部位とノード間部の電気的および生化学的仕切りとして働く。軸索膜のノード部位には電位依存性ナトリウムチャンネルが集積している。一方、傍パラノード部位にはシェーカー型カリウムチャンネルのKv1.1とKv1.2が局在しており、これらの構造が活動電位の跳躍伝導を可能にしている。ミエリン膜の軸索膜への接着は、これらのイオンチャンネルの集積に積極的に関わっている。このように、ミエリンは従来考えられていたような単なる絶縁体ではなく、グリア細胞とニューロン間の相互作用の場としても神経高次機能に貢献している。末梢神経系では、ミエリンはシュワン細胞で産生される。
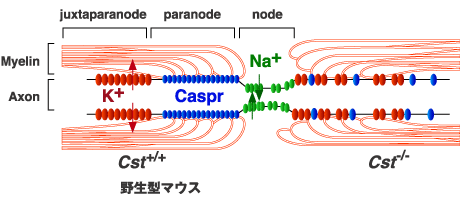
図 3 ランビエ絞輪の構造とCST欠損マウスにおける変化
正常マウスでは、パラノード部においてミエリンとアクソンが接合し、これが隔壁となってナトリウムチャンネルとカリウムチャンネルの集合体が、それぞれノード部と傍パラノード部に形成される(図の左半分)。CST欠損マウスでは、ミエリンとアクソンの接合形成が障害され、ナトリウムチャンネルとカリウムチャンネルの集積化も乱される(右半分)。
ガラクトシルセラミドとスルファチドは、それぞれミエリン鞘の総脂質の23%と4%を占める1。これらの糖脂質は、オリゴデンドロサイトやシュワン細胞の中で、前駆体のセラミドに、小胞体でCGTが、つづいてゴルジ体でCSTが作用することにより合成される(図2)。ガラクトシルセラミドとスルファチドは、オリゴデンドロサイトの分化の過程で、前駆細胞が増殖をやめて分化しはじめる時期に初めて発現するようになる。このことから、これらの糖脂質がオリゴデンドロサイトの分化の制御やミエリンの機能に重要な役割をはたしていると考えられた。
硫酸化糖脂質の生理機能を明らかにするために、ジーンターゲッティングの手法でCST欠損マウスが作製された8。CST欠損マウスの脳は完全にスルファチドを欠いていたが、ガラクトシルセラミドを含む他の糖脂質には変化が見られなかった。CST欠損マウスは、一見正常に出産したが、生後6週頃から対麻痺様の症状が出現し、進行性にふるえや運動失調を来した。病理組織学的検査により、軸索は一見よくミエリン構造を保っていたが、CGT欠損マウスでもみられたように6、ところどころミエリンの空胞化や局所的な軸索の膨化(軸索球形成)がみられた。後者はミエリン形成の異常による二次的な神経細胞の変性によると思われる。有髄神経線維の電子顕微鏡による観察では、CGT欠損マウスと同様に11、ランビエ絞輪パラノード部位におけるミエリン膜側方ループの軸索膜への接着に異常がみられた(図3)。さらに、CGT欠損マウスでみられたように13、ノードへのナトリウムチャンネルとカリウムチャンネルの集積も障害されていた12(図3)。これらの知見はスルファチドがパラノード部位におけるミエリンループと軸索膜との接着結合に不可欠な分子であることを強く示唆する。これまで、3つのタンパク質、すなわち軸索膜上に発現しているCaspr/パラノーディン、コンタクチンとミエリン膜上に発現しているニューロファシンの155 kDaスプライスフォーム(NF155)が、パラノード部位におけるアクソン-グリア接着装置を形成していることが報告されている10。ミエリンの膜成分であるスルファチドが、これらのタンパク質複合体とどのように相互作用して接着結合を維持しているかが今後の重要な課題である。
重篤な神経学的異常をきたすにもかかわらず、CST欠損マウスは1年以上生存することが可能である8。CST欠損マウスの表現型は、発症時期、寿命、症状の重さの点で、CGT欠損マウスより軽度であった。また、CST欠損マウスでは、CGT欠損マウスでみられた神経伝導速度の低下や脱髄はみられなかった8, 11。この違いを考えると、おそらくガラクトシルセラミドとスルファチドのミエリン膜上での局在が異なり、ガラクトシルセラミドはスルファチドの前駆体としてのみならず、別の機能分子としても働いているのであろう。
スルファチドはオリゴデンドロサイト前駆細胞が増殖をやめて分化をはじめる頃に発現されはじめるので、オリゴデンドロサイトの分化の制御に関わることが予想された。実際、CGT欠損マウスでオリゴデンドロサイトの分化は早まった14。また、正常マウスにおけるオリゴデンドロサイトの分化は抗スルファチド抗体で抑制されたが、抗ガラクトシルセラミド抗体では抑制されなかった12。これらの知見から、スルファチドがオリゴデンドロサイトの分化のキー抑制制御因子であることが強く示唆された。この仮説は、CST欠損マウスでオリゴデンドロサイトの分化が早まることによって確認された(平原ら、未発表)。このように、スルファチドは、成熟したミエリンの構造維持に働くばかりでなく、オリゴデンドロサイトの分化調節にも関与している。
精子形成は、精巣にある精細管の中で営まれる15(図4)。幹細胞である精原細胞は、精細管周囲の基底膜の特定の場所(ニッチェ)に居座っている。この細胞が分裂を停止して、分化をはじめると精母細胞となる。ひきつづいて、精母細胞は、支持細胞であるセルトリ細胞に接着して相互作用をしながら、精細管周囲から内腔側へと移動しつつ、減数分裂を2回行って、半数体の精子細胞となる。この後、形態変化を経て精子となって精細管から輸精管を通って精巣上体へと運ばれる。
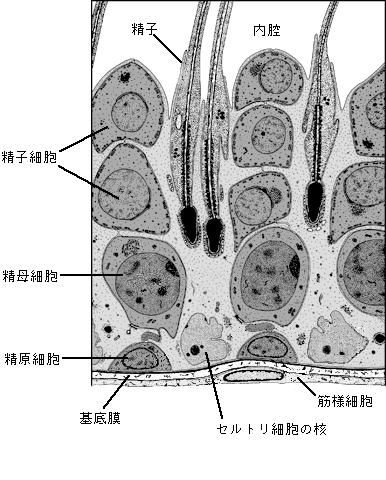
図 4 精細管における精子形成
(Science vol296,p2175(2002)の図を改変)
精巣の糖脂質の90%以上は、セミノリピドと呼ばれるユニークなグリセロ糖脂質が占める2。糖鎖の部分はスルファチドと全く同じで、生合成酵素も共通であることが判明している6-8(図2)。セミノリピドは、精母細胞の初期に盛んに生合成される。
CGT欠損マウスは、精巣においてGalEAGとセミノリピドが合成されず、精子形成が減数分裂の前で停止した16。一方、CST欠損マウスでは、一次精母細胞は正常にみられたが、第一減数分裂の中期で停止した8。CST欠損マウスの生殖細胞分化における障害時期がCGT欠損マウスよりも少し遅れていたことから、GalEAGとセミノリピドの両者が、生合成経路と同じ順番で、精子形成のプログラムに関与することが示唆された。あるいは硫酸基を持たないGalEAGが、ある点まではセミノリピドの代用をはたしている可能性も残されている。これらの糖脂質は、レプトテン期の終わりからザイゴテン期あるいはそれ以降にかけて、一次精母細胞の細胞表面に発現されているので、お互いの分化に重要と思われるセルトリ細胞と精母細胞との相互作用が両者のノックアウトマウスで障害されているのかもしれない。
これまでの著者らの研究で、硫酸化糖脂質が個体機能にとって必須な分子であることが明白となった。今こそ、硫酸化糖脂質を取り巻く自己組織化の研究を始める時期が到来したといえる。まず取り組むべき階層は、硫酸化糖脂質そのものが要素の一つとなっている階層であり、硫酸化糖脂質と相互作用する分子の探索が最初のアプローチであろう。局所において特定糖鎖構造と相互作用する分子を同定することは、頭で考えるほど容易ではない。何故なら、真実の糖鎖受容体は、限られた領域にごく僅かの量しか存在しないからである。硫酸化糖脂質の場合、試験管内ではラミニンやセレクチンや血液凝固因子等さまざまな分子と結合することが知られているが1、実際に硫酸化糖脂質が機能していることが証明された現場、即ち、アクソン—グリアジャンクションや精母細胞—セルトリ細胞コミュニケーションで硫酸化糖脂質と相互作用している分子を明らかにしないと意味がない。このためには、臓器丸ごとホモジェナイズして、そこから活性のあるものを精製してくるという従来の生化学的手法は使えない。何故なら、硫酸化糖脂質と結合するが、機能とは無関係の分子が多数存在するからである。限られた材料を用いてそこに存在する本物を同定するための新しい方法の開発が必要である。首尾よく相互作用分子が同定されたら、次のステップは硫酸化糖脂質を含む分子複合体を再構成することであろう。そして、相互作用分子の欠損変異体が硫酸化糖脂質の欠損変異体と同様な表現型を示すかを検証する。ここまで来てはじめて上位階層が視界に入ってくる。