Oct. 12, 2007
糖鎖ウイルス学(2007 Vol.11, A4)
鈴木 康夫
氏名:鈴木 康夫
中部大学生命健康科学部、CREST, JST
鈴木康夫教授は、静岡薬科大学大学院薬学研究科を修了し、1974年に薬学博士号を取得した。 1996年から2002年まで静岡県立大学の薬学部長および大学院薬学部長を務めた。また、日本糖質学会の副会長も務め、2004年には日本薬学会賞と中日文化賞を受賞した。現在は、中部大学生命健康科生命医科学科の教授である。専門分野は、生化学、ウイルス学と糖鎖生物学で、ウイルス感染における糖鎖機能の解明と創薬への応用に特に重点的に取り組んでいる。グリフィス大学(オーストラリア)および浙江省医学科学院(中国)の客員教授でもあり、2006年8月にはThe 5th International Sialoglycosceince 2006のオガナイザーを務めた。
1. はじめに
21世紀における主要な病気の一つに新興、再興感染症が挙げられる。感染症の原因である病原微生物は、表面に糖鎖を持っている。また、ウイルスのいくつかも糖鎖を持つ。そして、彼らの持つ糖鎖は宿主の免疫監視機構から逃れたり、積極的に宿主への感染に役立っている。微生物およびそれらの宿主動物の進化には、糖鎖を介した感染という相互認識が深く関わっている。すなわち、感染症の克服には糖鎖研究は欠かせない。ここでは、ウイルス学における糖鎖研究の必要性、重要性を紹介すると同時に、著者らの研究と絡めて糖鎖ウイルス学(Glycovirology)と呼ぶべき研究分野の進展、育成の必要性について述べる。
2. ゲノムからタンパク質そして糖鎖へ
2003年、4月、日英米など6カ国でヒトゲノム解読計画の完了が宣言された。これにより生命科学は確かに新たな段階に入ったと言える。ゲノムに含まれる遺伝子はタンパク質を作り、生命活動を担う。しかし、良く見れば、動物細胞に含まれるタンパク質の50%以上に糖鎖が付加されている。タンパク質は翻訳後に様々な修飾を受ける。例えば、糖鎖付加、リン酸化、メチル化、硫酸化、グリケーションなどである。この中で近年、最も多くの研究が始められている領域は糖鎖付加に関するものである。タンパク質や脂質に糖鎖が付加されることにより、様々な新しい機能や物性が発現される。言い換えれば、タンパク質や脂質の物性や機能は糖鎖付加により大きく変換される。これにより、タンパク質は三次元的に安定な構造を付与されたり、プロテアーゼなどから保護される。また、ウイルスなどの場合は、自分のスパイクタンパク質に糖鎖を付加させることにより、宿主の免疫監視機構から逃れたり、宿主細胞が持つ糖鎖を認識するレクチンに捕捉させ宿主細胞への侵入を容易にしている場合もある。また、糖鎖自身に血液型活性や細胞接着機能があることも分かって来た。タンパク質や脂質への糖鎖付加は、糖転移酵素により行われる。
3. ウイルス感染における糖鎖の役割
Encyclopedia Virology (ed. R.G. Webster, A. Granoff, Academic Press, 1994) によれば, 動物から分離されるウイルスはおよそ570種であり、それらのおよそ2/3は宿主細胞膜と同様の膜(エンベロープ)を持つ。この膜には、宿主由来のリン脂質や糖脂質、コレステロールなどの複合脂質の他、そこに埋め込まれているウイルス特異的糖タンパク質スパイクが存在する。このスパイクは、ウイルスが宿主に吸着したり、ウイルスが宿主から発芽により遊離したりする上で必須の役割を果たすし、そこに付加される糖鎖は、ウイルスのスパイクの3次元構造の維持、機能発現にやはり必須である。
一方、宿主細胞膜上の糖鎖は、極めて多様であると同時に、極めて高い種特異性を持っている。また、全てのウイルスは、宿主細胞中でのみ増殖するため、必ず宿主(細胞)域、宿主特異性を持っている。ウイルスが宿主特異性を発揮する機構を調べていくと、それが、宿主細胞膜糖鎖の特異性、多様性を反映している場合が極めて多いことに気付く。我々は、その表現系として、多くのエンベロープウイルスが宿主細胞膜の糖鎖を特異的受容体として認識・結合する事実を明らかにしてきた1-6。さらに、極めて抗原決定領域の変異が起こりやすい、例えば、インフルエンザウイルスの場合でも、受容体糖鎖への結合に関わるスパイクタンパク質上の受容体結合ポケット内の変異は起こりにくいことも見いだしてきた7。これらの事実は、受容体糖鎖の疑似化合物による受容体結合ポケットのブロックは、変異を克服出来る画期的抗ウイルス薬のシーズとなり得ることを意味している。従って、様々なウイルス感染において、糖鎖の役割は極めて大きく、且つ多様であり、糖鎖を標的とした抗ウイルス薬の開発は非常に有効であると位置づけられる。
さらに、糖タンパク質スパイクを持つウイルスが宿主細胞に感染、遊離する過程に置いても、受容体への吸着 → 侵入 → 脱殻 → ウイルスタンパク質合成 → 糖鎖付加 → 細胞内交通による送達 → パッケージング → 発芽(出芽) → 子ウイルスの遊離 など様々なステップがあり、ほとんど全ての段階でウイルスタンパク質糖鎖が構造的、機能的に関わることになる。しかし、この分子機構の多くは未解明である。各ステップにおける糖鎖の役割(図1)が明らかにされれば、これらのステップを特異的にブロックする糖鎖関連化合物、糖転移酵素阻害剤などが開発され、より幅広い視野で画期的抗ウイルス薬の開発が可能となる。
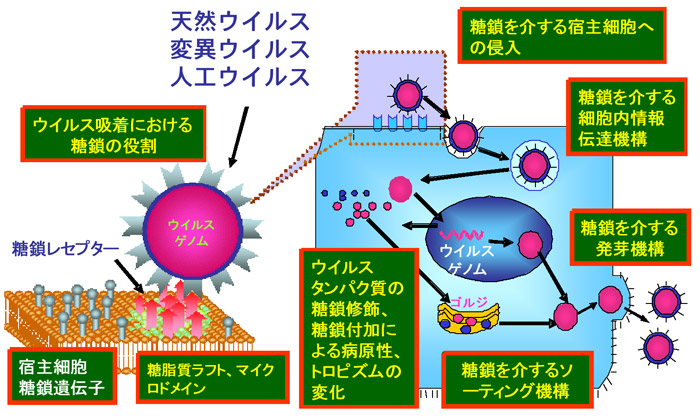
Fig. 1 様々な糖鎖を介するウイルス感染過程
4. 重要なウイルス疾患の治療に期待される糖鎖化合物
宿主細胞側の糖鎖は極めて多様性に富むと同時に、個体の種、さらに組織、個々の細胞における糖鎖の発現には、高い特異性が見られる。言い換えれば、自然界の糖鎖には極めて多種類の構造があると同時に、その発現は非常に限局的、特異的であるという特性が見られる。一方、ウイルスはそれぞれある幅を持った宿主域を持つと同時に、標的となる宿主細胞に対する認識や宿主細胞表面に存在する受容体分子に対する認識に対しては極めて高い特異性を持っている。この事実を考えると、ウイルスは進化の過程で、感染の場を拡大する上で、宿主側の糖鎖の多様性を利用して来た可能性が考えられ、一方で、ウイルスが持つ高い標的宿主細胞受容体認識特異性は、宿主細胞糖鎖発現の高い特異性を反映しているのではないかと考えられるのである。従って、糖鎖を受容体とするウイルスは予想外に多いと考えられ、今後の研究により、糖鎖を受容体とするウイルスの種類は拡大していくものと考えられる。受容体糖鎖およびその化学合成した誘導体は、多くの場合、ウイルスの宿主への感染を強力に阻止するため、特異性の高い抗ウイルス薬として開発され得る可能性がある8-12。ウイルススパイクタンパク質の糖鎖修飾が、ウイルスの感染性のみならず、ウイルス疾患の病態の発現にまで深く関わることも報告されている13-15。さらに、宿主細胞中に発現する糖転移酵素がウイルス感染細胞中のウイルス抗原の増殖に関わっており、この発現を制御することで、ウイルス感染症治療の可能性を示す例と言える16。
5. 糖鎖ウイルス学 (Glycovirology)のすすめ
ヒトゲノム解読完了宣言後の医薬開発では、ポストゲノム創薬が最も期待される領域となることは確実である。言うまでもなく、ポストゲノム産物の中で、タンパク質は核酸に次ぐ第二の生命鎖としてまた、糖鎖は第3の生命鎖として重要な位置を占める。この中で、糖質・糖鎖は、上記のように、様々なウイルスの受容体として、ウイルスにとって必須な構成分子として、ウイルス感染細胞内情報伝達分子として重要かつ多彩な機能が明らかにされ始めている。糖鎖生物学とウイルス学をカバーする領域を糖鎖ウイルス学 (Glycovirology)と呼ぶことが出来る。この6月には第1回Glycovirologyの国際会議がスエーデンで行われた。著者も日本側組織委員としてこの会議の発進に関わった。今後、糖鎖は、ウイルス感染症と深く関わる分子として21世紀における極めて重要な研究標的、創薬標的となることが確実で、糖鎖ウイルス学(Glycovirology)領域の進展、専門家の育成、増加が望まれる。
References
- Suzuki Y, Sialobiology of influenza -Molecular Mechanism of Host Range Variation of Influenza Viruses- (Review) Biological Pharmaceutical Bulletin 28, 399-408, 2005
- Suzuki Y, The highly pathogenic avian flu viruses and the molecular mechanism of the transmission of the viruses into humans F. Diseases associated with carbohydrates/glycoconjugates. Comprehensive Glycoscience from Chemistry to Systems Biology Glycoconjugates and viral infections. Elsevier Publishing book
- Guo CT, Takahashi N, Yagi H, Kato K, Takahashi T, Yi SQ, Chen Y, Ito T, Otsuki K, Kida H, Kawaoka Y, Hidari KI, Miyamoto D, Suzuki T, Suzuki Y, () The quail and chicken have sialyl-Gal sugar chains responsible for the binding of influenza A viruses to human type receptors. Glycobiology, 17, 713-724, 2007
- Yamada S, Suzuki Y, Suzuki T, Le MQ, Nidom CA, Sakai-Tagawa Y, Muramoto Y, Ito M, Kiso M, Horimoto T, Shinya K, Sawada T, Kiso M, Usui T, Murata T, Lin Y, Hay A, Haire LF, Stevens DJ, Russell RJ, Gamblin SJ, Skehel JJ, Kawaoka Y, Haemagglutinin mutations responsible for the binding of H5N1 influenza A viruses to human-type receptors. Nature, 444, 378-382, 2006
- Q.M. Le, M. Kiso, K. Someya,Y. T. Sakai, T. H. Nguyen, K. H. L.Nguyen, N. D. Pham, H. H.Ngyen, S. Yamada, Y. Muramoto, T. Horimoto, A. Takada, H. Goto, T. Suzuki, Y. Suzuki, & Y. Kawaoka, Avian flu: isolation of drug-resistant H5N1 virus. Nature, 437, 1108, 2005
- Kobasa D, Takada A, Shinya K, Hatta M, Halfmann P, Theriault S, Suzuki H, Nishimura H, Mitamura K, Sugaya N, Usui T, Murata T, Maeda Y, Watanabe S, Suresh M, Suzuki T, Suzuki Y, Feldmann H, Kawaoka Y, Enhanced virulence of influenza A viruses with the haemagglutinin of the 1918 pandemic virus. Nature, 431, 703-707, 2004
- Suzuki, Y., Kato, H., Naeve, C.W., Webster, R.G., Single-amino-acid substitution in an antigenic site of influenza virus hemagglutinin can alter the specificity of binding to cell membrane-associated gangliosides. J. Virol., 63, 4298-4302, 1989
- Ogata, M., Murata, T., Murakami, K., Suzuki, T., Hidari, KI, Suzuki, Y., Usui, T. Chemoenzymatic synthesis of artificial glycopolypeptides containing multivalent sialylologosaccharides with a gamma-polyglutamic avcid backbone and their effect on inhibition of infection by influenza viruses. Bioorg. Med. Chem., 15, 1383-1393, 2006
- Ohta, T., Miura, N., Fujitani, N., Nakajima, F., Niikura, K., Chao-Tan Guo, Suzuki, T., Suzuki, Y., Monde, K., Nishimura, S., Glycotentacles: synthesis of cyclic glycopeptides, toward a tailored blocker of influenza virus hemagglutinin. Angew Chem. Int. Ed., 42, 586-5189, 2003
- Guo CT, Sun XL, Kanie O, Shortridge KF, Suzuki T, Miyamoto D, Hidari KI, Wong CH, Suzuki Y, An O-glycoside of sialic acid derivatives that inhibits both hemagglutinin and sialidase of influenza viruses. Glycobiology, 12, 183-190, 2002
- Tindal, D.J., Dyason, J.C., Thomson R.J., Suzuki, T., Ueyama, H., Kuwahara, Y., Maki, N., Suzuki, Y., Itzstein M.V. Synthesis and evaluation of 4-O-alkylated 2-deoxy-2,3-didehydro-N-acetylneuraminic acid derivatives as inhibitors of human parainfluenza virus type-3 sialidase activity. Bioorg. Med. Chem Lett. 17, 1655-1658, 2007
- Aoki C, Hidari KI, Itonori S, Yamada A, Takahashi N, Kasama T, Hasebe F, Islam MA, Hatano K, Matsuoka K, Taki T, Guo CT, Takahashi T, Sakano Y, Suzuki T, Miyamoto D, Sugita M, Terunuma D, Morita K, Suzuki Y, Structural characterization of carbohydrate molecules recognized by domain III of dengue envelope glycoprotein. J. Biochem. 139, 607-614, 2006
- Mori Y, Yang X, Akkapaiboon P, Okuno T, Yamanishi K, Human Herpesvirus 6 variant A glycoptotein H-glycoprotein L-glycoprotein Q complex associate with human CD46. J. Virol. 77, 4992-4999, 2003
- Hu H, Shioda T, Moriya C, Xin X, Hasan MK, Miyake K, Shimada T, Nagai Y, Infectivities of human and other primate lentiviruses are activated by desialylation of the virion surface. J. Virol. 70, 7462-7470, 1996
- Ohgimoto S, Shioda T, Mori K, Nakayama EE, Hu H, Nagai Y, Location-specific unequal contribution of the N-glycans in SIV gp 120 to viral infectivity and removal of multiple glycans without disturbing infectivity. J. Virol. 72, 8365-8370, 1998
- Miyoshi E, Nishikawa A, Ihara Y, Hayashi N, Fusamoto H, Kamada T, Taniguchi N, Selective suppression of N-acetylglucosaminyltransferase III activity in a human hepatoblastoma cell line transfected with hepatitis B virus. Cancer Res. 54, 1854-1858, 1994

