
氏名:白土(堀越)東子
国立感染症研究所
1997年北海道大学獣医学部獣医学科卒業。2001年大阪大学大学院医学系研究科博士課程修了。2001年4 月より財団法人ヒューマンサイエンス振興財団非常勤職員(国立感染症研究所ウイルス第二部勤務)。2001年10月より国立感染症研究所ウイルス第二部研究員。2007年4月より主任研究官。
ウイルスは、特定の宿主の、特定の組織、さらに特定の細胞を標的として感染を成立させる。その特異性(トロピズム)を左右するのがウイルスレセプターである。細胞表面上の糖鎖は、ウイルスレセプターとして一般的な分子であり、シアル酸やヘパラン硫酸といったマイナス電荷を帯びた糖鎖はその役割を担うことが多い。前者を認識するウイルスとしてオルソミクソウイルス、ポリオーマウイルス、レオウイルス、コロナウイルス、パラミクソウイルス、パルボウイルス、後者を認識するウイルスとしてアデノ随伴ウイルス、ヘルペスウイルス、フラビウイルスが知られている1。糖鎖に結合するウイルスとして、最近、新たにノロウイルス(Norovirus:NoV)がリストに加えられた。NoVは、電荷を帯びない血液型抗原(Histo-blood group antigen)を認識する。本稿では、NoVと血液型抗原との結合について解説を行う。
NoVの疫学、感染様式、ウイルス学的特徴に関して、項目3(血液型抗原とノロウイルス)以降必要となる知識を中心に以下に簡潔にまとめた。血液型抗原との結合においてポイントなる箇所は*で示した。
NoVによる下痢症は、わが国を含め世界各地で発生している疾患であり、ウイルスに起因する集団食中毒発生事例の95%以上を占める(図1、2)。また、冬季に流行する感染性胃腸炎の主要な原因ウイルスでもある。一般には軽症で経過するが、高齢者、乳幼児においては下痢、嘔吐による脱水あるいは誤嚥性肺炎で重症化し、死に至ることもある。
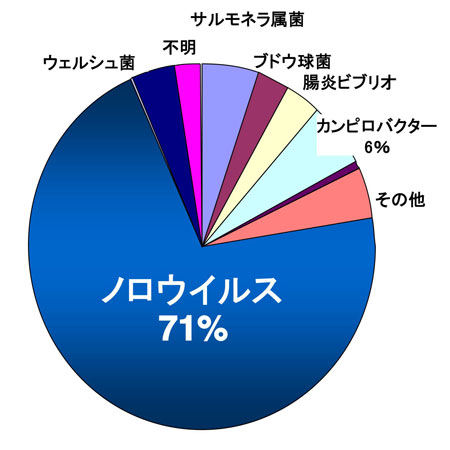
図 1 2006年に発生した食中毒事例における病因物質別患者数の割合
患者数でみた割合を示す。厚生労働省食中毒統計、2007年5月現在の報告数をもとに作成した。2006年の食中毒総患者数は39,222人、そのうちノロウイルスによる下痢症を発症したのが27,642人(71%)を占めた。細菌(ウェルシュ菌、サルモネラ属菌、ブドウ球菌、腸炎ビブリオ、カンピロバクター)に起因する食中毒事例を除く、ウイルス性食中毒事例においては、ノロウイルスが95%以上を占め、毎年ほぼ同様の傾向を示す。
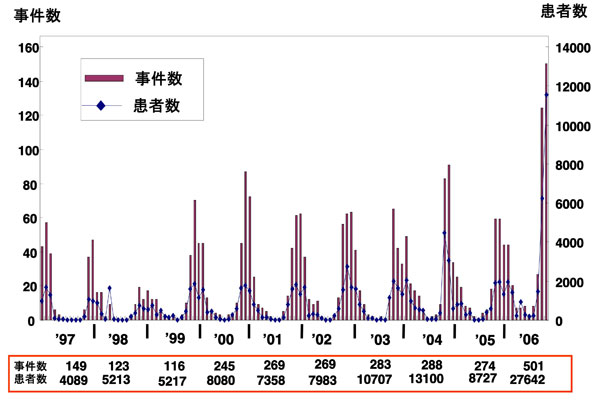
図 2 過去10年間におけるノロウイルスに起因する食中毒発生事件数と患者数(月別)
厚生労働省食中毒統計、2007年5月現在の報告数をもとに作成した。1997年から1999年までの3年間はノロウイルスの検出技術の確立期であり、事例数、患者数のが少なさはこれに起因すると考えられる。 2000年から2005年までの6年間は事例数、患者数に大きな変動はなく、毎年約270事例、患者数約9,000人で推移している。 2006年は大流行がおこり、事例数、患者数ともに平年の2〜3倍となった。
ヒトが唯一の感受性動物である。感染様式や複製のメカニズム等の分子レベルでの解析は進んでいない。それ故、ウイルスの感染機序、増殖機序はいまだ不明なままである。しかし、ボランティア感染実験により病理像があきらかになっており、米国における解析によると、NoV感染者の空腸の絨毛は極端に萎縮し、扁平化している2。
NoVはカリシウイルス科(Caliciviridae)・ノロウイルス属(Genus Norovirus)・ノーウォークウイルス種(Type Species Norwalk virus)に分類される(表1)。*NoVと血液型抗原との結合解析は、同じくカリシウイルス科に属するLagovirus属ウサギ出血病ウイルス(Rabbit hemorrhagic disease virus)がH型物質に結合するとの報告3を受け、スタートしたという経緯がある。
表 1 カリシウイルス科(Family Caliciviridae)のウイルス

ノロウイルスおよびサポウイルスの大部分はヒトから分離されたものである。近年ウシ、ブタ、![]() 歯類から近縁のウイルスが分離されてきているが、これらのウイルスがヒトに感染したとする報告はない。科、属、種はイタリック体で記述する。
歯類から近縁のウイルスが分離されてきているが、これらのウイルスがヒトに感染したとする報告はない。科、属、種はイタリック体で記述する。
NoVはプラス1本鎖RNAウイルスの一つで、約7.6 kbのRNAゲノムを有する。ゲノムRNAには3つのORFが存在し、ORF1は非構造タンパク質を、ORF2とORF3は構造タンパク質をコードしている(図3)4。ORF2産物はカプシド蛋白質であり、VP1と呼ばれるのに対し、塩基性アミノ酸に富むORF3産物はVP2と呼ばれる。一つのウイルス粒子は180分子のVP1が会合し形成され、その内部に1分子のゲノムRNAと数分子のVP2が含まれると言われている5,6。形態学的にはエンベロープ持たない直径38 nmの小型で球形をしたウイルスとして観察される(図4)。*後述するように、エンベロープを持たないと言うことは、カプシド蛋白質そのものがレクチンとして血液型抗原を認識していると推測できる。
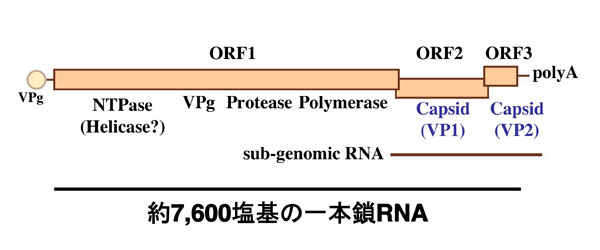
図 3 ノロウイルスの遺伝子構造
RNAゲノムは3つのORFを有し、ORF1は非構造タンパク質、ORF2は主要な構造タンパク質(VP1)、ORF3は微量な構造タンパク質(VP2)をコードしている。
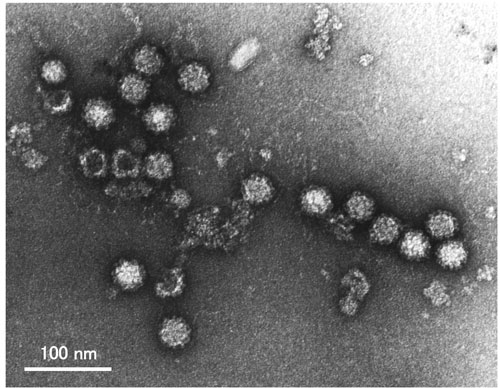
図 4 ノロウイルス(GI/4遺伝子型、Chiba407株)の電子顕微鏡像
直径は約38nmである。
NoVの分子生物学的手法を用いた性状解析で最も進展しているのは、ウイルス様中空粒子(Virus-like particles: VLP)の作製とその応用であろう。ORF2の5’末端からORF3を含むゲノム末端までを組換えバキュロウイルスで発現させたところ、大量に産生されたVP1は自己集合し、外観は形態、抗原性、免疫原性の全てにおいてネイティブなウイルス粒子に類似したVLPを形成することが明らかになった4.7。VLPの作製は、ウイルス増殖系の確立されていないNoVの研究にとって、センセーショナルな出来事であった。*様々な種類のVLPが作出され抗原性や粒子の解析が進められ、後述するレセプター候補分子、血液型抗原、の同定にまで至ったのである。
現在、NoV に属するウイルスはGenogroup I(GI)とGenogroup II (GII)の2つのGenogroup(遺伝子群)に大別され、さらにそれぞれは15と18のgenotype(遺伝子型)、GI/1-GI/15とGII/1-GII/18、に分類される8(図5)。各遺伝子型はそれぞれ異なった抗原型に対応しており、極めて多様性を持った集団として存在する9。*この多様性が、後述するように、血液型抗原との結合解析の難しさにも結びついている。
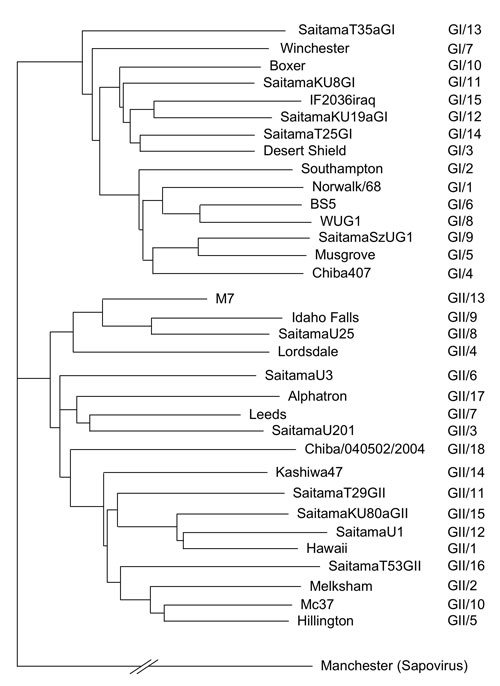
図 5 ノロウイルス遺伝子型系統樹
Ref 8の情報に準じ作成した。系統樹解析はORF2の塩基配列に基づいている。上段にGenogroup I (GI/1-GI/15)、下段にGenogroup II (GII/1-GII/18)の代表的な株が示されている。サポウイルスのManchester株は系統樹解析における群外対照として用いた。
血液型抗原には、ABO式血液型抗原、Lewis式血液型抗原などが含まれ、これら抗原はヒトの赤血球表面だけでなく、NoVが標的とするであろう腸管上皮細胞にも発現されている。血液型抗原の合成に関与するフコース転位酵素の1つFUT2(Se)酵素をコードするFUT2遺伝子活性をもつヒトでは血液型抗原が唾液中にも分泌され、腸管上皮細胞に発現されている(分泌型個体:Secretor)。これに対しSe遺伝子が変異により不活化すると、血液型抗原は上皮細胞に発現されなくなり、唾液中にも分泌されなくなる(非分泌型個体:Non-secretor)(ABO式血液型抗原、Lewis式血液型抗原、分泌型個体/非分泌型個体の詳細については、他項(Glycoprotein-B02、A04)を参照されたい)。
VLPを用いた結合実験により、NoVのプロトタイプであるNorwalk/68(NV/68)株が血液型抗原であるO、A、Leb型抗原(O型抗原は以下H抗原とする)に吸着することが明らかになった(表2、3)10-15。初めの報告が組織切片上でのVLPの結合解析、その後の報告は ほとんどがELISA-basedの結合実験解析によるものである。血液型抗原をプレートにコートし、VLPを加え、その結合量を抗VLP抗体で検出する方法であり、血液型抗原として唾液をコートする場合と、合成糖鎖をコートする方法がとられている。
ボランティア感染実験においてもNV/68と血液型抗原との結合を示唆する結果が得られている。分泌型個体/非分泌型個体間、血液型間での感染率を比較検討し、分泌型個体で感染が成立し非分泌型個体では成立しないこと、さらに血液型間の比較においてはO型のヒトでの感染率が高くB型では感染率が低いことが報告されている14,16。とくにNature Medicineに発表された解析結果14は、77個体の大規模な感染実験を行っている点、感染が成立した34人すべてが分泌型個体であり非分泌型個体で感染が成立したヒトはいなかったという非常に明快な結果を提示した点からインパクトのある報告であった。
上記3-2、3-3はプロトタイプNV/68株に限った解析結果であり、NoVに属するすべてのウイルス株がNV/68と同じ血液型抗原を認識するわけではないことが判ってきた。In vitro binding-assay結果10-12,17、疫学研究結果18の両面から証明されており、NoVの遺伝子型により認識する血液型抗原の種類、数は様々であることが明らかになっている。H抗原は認識せず、A、B型の2抗原のみに結合するウイルス株もあれば、Le-aの1抗原のみ、またはLe-b、Le-yの2抗原のみを認識するウイルス株もある(表2、3)。
表 2 血液型抗原の糖鎖構造
 ノロウイルスとの結合が証明されている血液型抗原の構造をまとめた(Ref10、12、19)。1株が全ての構造を認識するわけではない(表3参照)。また、ノロウイルスがタイプ1、2、3の違いを認識するかどうかについては、H抗原を用いた検討しかなされていない点、報告によって結果が異なる点から、明確な答えが出ているとはいえない。
ノロウイルスとの結合が証明されている血液型抗原の構造をまとめた(Ref10、12、19)。1株が全ての構造を認識するわけではない(表3参照)。また、ノロウイルスがタイプ1、2、3の違いを認識するかどうかについては、H抗原を用いた検討しかなされていない点、報告によって結果が異なる点から、明確な答えが出ているとはいえない。
Glc, glucose; Fuc, fucose; Gal, galactose; GlcNAc, N-acetylglucosamine; GalNAc, N-acetylgalactosamine.
表 3 ノロウイルスが認識する糖鎖およびウィルス粒子上で糖鎖と結合するアミノ酸残基
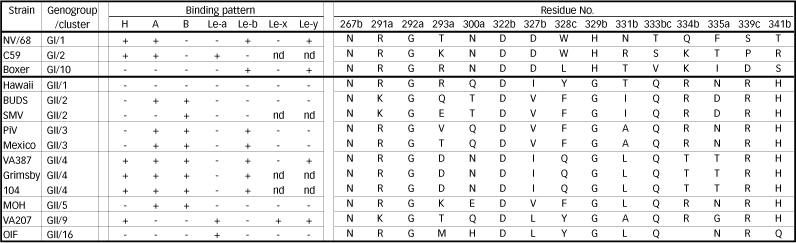
各ウイルス株の結合パターンはRef10、12、19の結果をまとめた。In vitro binding assay(Saliva-VLPs binding assayまたはCarohydrate-VLPs binding assay)より予測される認識糖鎖である。
クラスタリングはRef24に従い行った。残基は血液型抗原との結合に関与すると考えられている残基であり、aがRef21、bがRef22、cがRef23で報告されている。残基ナンバーはNV/68株のナンバリングに従った。
NoVの33遺伝子型の中でもGII/4遺伝子型に属する株に関しては比較的血液型抗原との結合解析報告が多く、いずれの報告においてもこの遺伝子型が他の遺伝子型に比べ結合できる血液型抗原の種類が多く、またそれぞれの血液型抗原への結合力も他のウイルス株に比べ強いことが証明されている11,12,19。認識する糖鎖はH、A、B、Le-b、Le-yであり、Le-a、Le-xには結合しない。2004年年末から2005年、年明けにかけて高齢者施設におけるNoV集団感染事例が国内で次々と報告され、そのうち7施設で12の死亡例が出たことは、社会に大きなインパクトを与えた。この死亡例のうち3事例において詳細な解析が行われており、3事例とも原因ウイルスがGII/4遺伝子型株であることが明らかになっている20。しかし、重症化に至った原因については答えが出ていない。またGII/4遺伝子型株は、日本も含め世界中で流行している株であるが、その伝播力についても答えが出ていない。直接的な証明はまだなされていないものの、GII/4遺伝子型株の血液型抗原への結合力の強さが重症化に至る原因となり、また伝播力に結びついている可能性が大きい。
カプシド蛋白上の糖鎖結合部位が推測されている。1) Mutagenesis analysesとComputer modelingによる結合部位の推定21、2) Evolution trace analysisによる推定22、3) カプシド蛋白質二量体と合成糖鎖を用いたX線結晶構造解析23により明らかにされた結合に関与する残基を表3にまとめた。これらの残基は同じ遺伝子型に属するウイルス株間で保存されていることが多い。一方で同じ遺伝子型に属するウイルス株は大体同じ結合パターンを示すことが知られており、この2つの事実は互いに矛盾のない結果となっている。X線結晶構造解析はカプシド蛋白質の二量体と3糖の合成糖鎖との結合体を解析したものであり、今後、カプシド蛋白質が180分子集合した完全なウイルス粒子体とさらに複雑な糖鎖構造、すなわちVivoで発現されている糖鎖により近い糖鎖構造との結合解析が望まれる。
プロトタイプのNV/68株、GII/4遺伝子型のVA387株について詳細な解析が行われている。H、A、Le-b抗原を認識するNV/68株は、1)H抗原前駆体(フコースを欠く)に結合しないこと10,15、2)血液型抗原のFucosidase処理によってその結合が失われること15から、血液型抗原上のフコースを結合に必要としていると考えられる。H、A、B、Le-b、Le-yを認識するVA387株は、1)α-N-acetylgalactosaminidaseまたはα-galactosidaseで処理するとA、B型物質への結合が阻害されること11、2)X線結晶構造解析においてフコース、ガラクトース、N-アセチルガラクトサミンへの結合が示唆されていること23から、血液型抗原上のフコース、ガラクトース、N-アセチルガラクトサミンを結合に必要としていると考えられる。NoVが血液型抗原のタイプ1、2、3の構造の違いを認識するかどうかについては、明確な答えは得られていない。
ウイルスカプシド蛋白上の糖鎖結合部位の推定、血液型抗原上のウイルス認識部位の推定、どちらの解析も数あるNoVの中のほんの数株を用いた結果である。前述のように(段落2-6、3-4)、NoVは遺伝学的に多様であり、その遺伝子型によって異なる血液型抗原を認識する。エンベロープを持たないNoV(段落2-4)は、カプシド蛋白質そのものがレクチンとして糖鎖を認識していると推測できる。一見複雑な糖鎖認識機構に法則性が存在するのかさらなる解析が望まれる。
段落2-1で述べたようにカリシウイルス科Lagovirus属のウサギ出血病ウイルスが血液型抗原を認識することから、NoVと糖鎖との結合の解析がスタートし、NoV全33遺伝子型中10遺伝子型以上が血液型抗原と結合することが明らかになっている。さらに、段落3-5で解説したように、GII/4遺伝子型の感染力の強さは、この株が宿主腸管上皮上の血液型抗原に強く結合していることに起因する可能性も示されている。しかし、その一方で、NoV33遺伝子型中少なくとも2遺伝子型が血液型抗原を認識しないことも明らかになっている(表3)10,12,17 and Shirato-Horikoshi unpublished data。またカリシウイル科に属し、NoV同様ヒトに胃腸炎を引き起こすSapprovirus属(表1)も血液型抗原に結合しないことが明らかになっている19。血液型抗原がNoVの細胞への吸着だけに関与する分子なのか、侵入にも関わるレセプターなのか明らかになっていない。血液型抗原への吸着をスタートとしたNoVの感染が、その後、どの様なメカニズムによって下痢症発症にまで結びつくのか、解明が待たれる。