
氏名:末永 忠広
大阪大学微生物病研究所免疫化学分野、
大阪大学免疫学フロンティア研究センター免疫化学
千葉大学医学部卒業、千葉大学大学院神経病態学修了。この間、同遺伝子制御学、理化学研究所免疫・アレルギー科学総合研究センター免疫シグナル研究グループにも所属。医学博士。2006年より大阪大学微生物病研究所免疫化学分野に所属、2007年より大阪大学免疫学フロンティア研究センター免疫化学研究室兼任。

氏名:荒瀬 尚
大阪大学微生物病研究所免疫化学分野教授、
大阪大学免疫学フロンティア研究センター免疫化学研究室教授
1990年北海道大学医学部卒業後。その後、北海道大学大学院医学博士課程に進学し、1994年より千葉大学医学部高次機能制御研究センター助手。2000年から2年間カリフォルニア大学サンフランシスコ校へ留学後、2002年千葉大学大学院医学研究院遺伝子制御学助教授、2004年大阪大学微生物病研究所免疫化学分野助教授を経て、2006年より大阪大学微生物病研究所免疫化学分野教授、2007年大阪大学免疫学フロンティア研究センター免疫化学研究室教授。主として、病原体と免疫システムとがどのように相互作用するかを研究している。
ウイルスが、宿主に感染する際、様々な局面において、糖鎖を利用することが知られている。すなわち、ウイルスが宿主細胞に吸着し、細胞表面でウイルス粒子を濃縮させ、細胞内に侵入(エントリー)できる可能性を高める際に、細胞表面上の糖鎖が関与したり、中には糖鎖そのものをエントリーレセプターとして利用したりするウイルスも存在する。特に後者に関しては、インフルエンザウイルスが、ウイルス粒子表面のヘマグルチニン(HA)を介してエントリーする際、細胞表面のシアル酸(N-アセチルノイラミン酸: NANA、Neu5Ac)がそのレセプターとして機能していることが知られている。また、アデノウイルス37型が角結膜に侵入する際のレセプターとして、シアル酸を含む特定のガングリオシド(糖鎖上に1つ以上のシアル酸を結合しているスフィンゴ糖脂質の一種)のひとつであるGD1aを利用していることも報告されている1。このように、糖鎖はウイルス感染において、様々な形で関わっているが、ここでは、ヘルペスウイルスがエントリーする際の、糖鎖の機能について触れたい。
ヒトヘルペスウイルスは1型〜8型からなり、単純ヘルペスウイルス1型、2型 (HSV-1, -2)、水痘帯状疱疹ウイルス(VZV)はアルファヘルペスウイルス亜科に属する(表)。ヘルペスウイルス科のウイルスは線状二本鎖DNAを内包する正20面体のカプシドと、その周囲のテグメント、最外層のエンベロープからなる(図1A)。ヘルペスウイルス科のウイルスの宿主細胞へのエントリーは、ウイルス粒子の細胞表面への吸着、続いて、エンベロープ上のグリコプロテイン分子と宿主側受容体との会合によって、エンベロープと細胞膜の膜融合(fusion)、もしくは、エンドサイトーシスの後、エンベロープとエンドソーム膜が膜融合することによって、エンベロープ内部のカプシドが細胞内に侵入することで成立する(図1B)2。カプシドは、微小管などに結合し、宿主細胞核へと輸送され、核膜を通過するときに、カプシドから“脱殻”し、ウイルスDNAが核内に取り込まれる。従って、エンベロープとの膜融合を引き起すことができ、ウイルスの細胞内への侵入を可能にする宿主側分子をエントリーレセプターと呼ぶことができる。
表 ヒトヘルペスウイルス科の分類

ヒトヘルペスウイルス(human herpesvirus, HHV)はα、β、γは、それぞれのヘルペスウイルスの亜科に分類される。
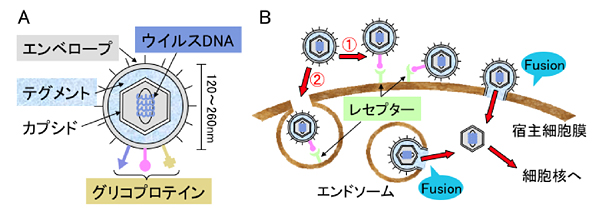
図 1 ヒトヘルペスウイルスの構成とエントリー経路
(A)ヒトヘルペスウイルス科のウイルスの構造を示す。(B)エンベロープをもつウイルスが宿主細胞内にエントリーするための2つの経路(㈰宿主細胞膜との直接の膜融合、㈪エンドサイトーシス経路)を示す。いずれの経路でも、ウイルスエンベロープ上のグリコプロテインと細胞側の膜上のレセプターとの会合による膜融合が必須である。
HSV-1は全てのヘルペスウイルスのプロトタイプと言われており、HSV-2とは、ゲノム上の相同性は約50%と高いものの、他のヘルペスウイルス科のウイルスとはゲノム上も、表現型も異なる性格を有する。HSV-1は広い組織への感染性をもち、実際、角膜ヘルペス、口唇ヘルペス、ヘルペス脳炎、性器ヘルペス(陰部ヘルペス)など様々な疾患を引き起こし、我が国ではおよそ800万人が罹患していると推定されている。HSV-2は主に性器ヘルペスの原因ウイルスとして有名であり、我が国では受診者数だけで年間約72,000人にものぼる。性器ヘルペスはHSV-1によって引き起こされる場合もある。また、HSVは初感染後、知覚神経節の神経節細胞に潜伏感染し、宿主のHSVに対する免疫低下時などに、再活性化し、繰り返し水疱状の皮膚炎を終生引き起す。
HSV-1, -2のエントリーに先立つ宿主細胞表面への吸着には、いくつかのエンベロープグリコプロテインが関わっており、その中でも、HSV上のグリコプロテイン C (gC)の宿主細胞上のヘパラン硫酸プロテオグリカン(HSPGs)等との会合が吸着に関与するといわれている3。ウイルスがフィロポディアなど細胞移動に必要な細胞突起に吸着した際、ウイルス粒子がエントリーしやすい細胞体の方に細胞表面を移動した後にエントリーする”viral surfing”という考え方が提唱されている4, 5。この現象は、レトロウイルス、ヒトパピーローマウイルスなどのほかに、HSV-1、ヒトサイトメガロウイルス、カポジ肉腫関連ヘルペスウイルスでも報告されているが、viral surfingにおけるウイルス粒子接着にも、HSV-1のgCとHSPGの会合が中心的役割を果たしている。このようにgCは、HSVの吸着という局面に非常に重要なはたらきを担っているが、膜融合, エントリーを含めた、ウイルスの生存において必須な分子ではない。
HSVのエントリーには、gB、gD、gH、gLが必須であり、gDはNectin-1、HVEM (herpes virus entry mediator)、3-O-HS (3-O-硫酸化ヘパラン硫酸)と会合する6-8。Nectin-1は主に細胞接着に関与する分子である。HVEMはT細胞、B細胞、単球、樹状細胞などに発現しているTNFレセプターファミリーに属するI型膜貫通タンパクであり、LIGHT、lymphotoxin-α (LTα)の分子のレセプターとなり、発現細胞に活性化の副シグナルを伝達する。一方、HVEMはBTLA (B and T lymphocyte attenuator)、CD160のリガンドとなり、T細胞、B細胞に抑制化のシグナルを伝達する9, 10 。我々は、gBと会合し、膜融合を起こす分子としてpaired immunoglobulin-like type 2 receptor α(PILRα)を同定した。PILR発現細胞である単球等へのHSV-1感染は、gBとPILRα、gDとHVEMの会合のどちらか一方を、抗PILRαモノクローナル抗体もしくは抗HVEMモノクローナル抗体で阻害すると感染が抑制されることから、PILRαは単球等のPILR発現細胞において、gDレセプターと共役する、HSV gBのエントリーレセプターであると考えられた(図2A)11, 12 。
PILRは単球、顆粒球などに発現している細胞表面分子であり、ITIM (immunoreceptor tyrosine-based inhibitory motif)を有する抑制化レセプターのPILRαとITAM (immunoreceptor tyrosine-based activation motif )を有するDAP12と会合する活性化レセプターのPILRβから成っている13。マウスではPILRαとPILRβがCD99を認識し、免疫反応を制御すると考えられる14, 15 。一方、ヒトPILRβでは、PILRαと比べて、139番アミノ酸が、トリプトファンからロイシンに変異していることによって、HSV-1, -2のいずれのgBとも会合せず、従って、ヒトPILRβに対するリガンドは明らかでない16。
PILRによるCD99の認識には、CD99上の45番と50番スレオニンのO型糖鎖修飾が必須である。PILRαは糖鎖単独には結合性を示さず、糖鎖構造とタンパク構造の双方を認識していると考えられる15。また、PILRαのリガンドとして、我々が最近報告した、PILR-associating neural protein (PANP)がPILRに認識される際にも、PANP上の83番スレオニンのO型糖鎖修飾が必要である17。一方、gB発現細胞をシアリダーゼ (ノイラミニダーゼ)で処理してgB上のシアル酸を取り除くと、gBはPILRαに認識されなくなったことから、両者の結合にはシアル酸が必須であることが判明した。さらに、gB強制発現細胞をTunicamycin処理によりN型糖鎖修飾のみを阻害してもPILRαとの会合が保たれたのに対して、benzyl-GalNac処理によりO型糖鎖修飾を阻害すると、gBとPILRαとの会合が見られなくなった。また変異gBを用いたPILRαとの結合を調べると、O型糖鎖修飾が予測されるアミノ酸のうち、gB上の53番のスレオニンと480番のスレオニンのO型糖鎖修飾が重要であり、特に前者の関与が大きいことがわかった18。これらのgB上のスレオニンをアラニンに変異させたHSV-1はPILRαを介した感染性が著しくて低下することから、HSV-1のPILRαを介した感染において、PILRαとgB上のO型糖鎖上のシアル酸を介したgBとの会合が必須であると考えられる。実際、マウスの感染実験においてPILRαと会合しないgBを発現するHSV-1の病原性は野生型と比べて顕著に低下していた19。
VZVは、扁桃などで、T細胞、樹状細胞、単球などに感染した後、感染細胞にのって全身に運ばれ、初感染時、主に小児で水痘(水疱瘡)を起こす。感染後、VZVはHSVと同様に知覚神経節に潜伏感染し、成人では免疫低下時に再活性化し、帯状疱疹を発症する。一方で、VZVは初感染時や再活性化時に脳炎、脊髄炎、Ramsay-Hunt症候群のような脳神経炎やVZV関連脳血管炎なども引き起す。VZVの感染にはgB、gE、gH、gLが必須であると考えられてきた20。VZVの侵入に関与する分子としてはcation-independent mannose-6-phospahe receptor(MPRci)がVZVの感染を促進することが報告されているがVZV上のどの分子と会合するかは明らかでない21。また、gEはinsulin degrading enzyme (IDE)と会合し、VZV感染を促進することが報告された22。しかし、我々の検討では、IDE、MPRciは、膜融合を引き起すことができないことから、IDEやMPRciは、VZV感染におけるエントリーレセプターと呼ぶには十分ではないと考えられた。
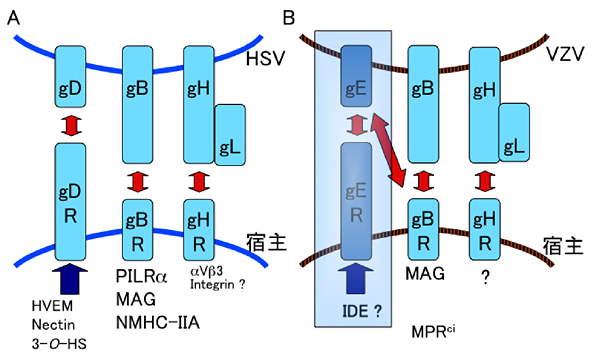
図 2 HSV, VZVのグリコプロテインとエントリーレセプター
(A)HSV、(B)VZVのエントリー及び膜融合に必要なグリコプロテインと各々のグリコプロテインに対応する宿主側エントリーレセプターを示す。VZVのgEは、エントリー及び膜融合に必須といわれていたが、我々の研究から、VZVの生存に必須であるが、エントリーには必須ではないと考えられる。HVEM: Herpesvirus entry mediator、3-O-HS: 3-O-硫酸化ヘパラン硫酸、PILRα: Paired immunoglobulin-like type 2 receptor α、MAG: Myelin-associated glycoprotein、NMHC-IIA: Non-muscle myosin heavy chain IIA、MPRci: cation-independent mannose-6-phospahe receptor、IDE: Insulin Degrading Enzyme。
VZVは、HSV-1と同様にαヘルペスウイルス亜科に属すことから、我々は、VZVのgBレセプターの候補として、PILRαと相同性を持つ分子を探索した。その結果、アミノ酸レベルで、12%の相同性があるmyelin-associated glycoprotein(MAG)を同定した。MAGは、魚類からほ乳類までの神経組織に発現している100kDaのI型膜タンパクである。MAGは神経軸索上の分子NgR1(Nogo Receptor 1)、NgR2、paired Ig-like receptor B(PIR-B)あるいはGD1a、GT1b等のガングリオシドと結合することにより、神経軸索が伸長するのを抑制し、神経組織の構築に関与している23, 24 。MAGの生理的リガンドに関しては、伸長抑制実験に用いられる神経軸索の由来によって、NgR1、NgR2、PIR-Bなどのタンパク質リガンドとガングリオシド上の糖鎖の両者なのか、それともどちらか片方なのかについては、報告によって結果が異なり定かでない25。
興味深いことに、MAGとヒト免疫グロブリン定常領域との融合タンパク(MAG-Ig)はVZV gBだけでなくgE発現細胞とも会合し、逆に、VZV gB-Ig、gE-IgもMAG発現細胞と会合した。MAGはVZV gB、gEと会合するにも関わらず、MAG発現細胞はVZV gB、gE、gH、gLを発現細胞とだけでなく、gB、gH、gL発現細胞とも同程度の膜融合効率を示し、gE, gH, gL発現細胞とは膜融合を起こさなかった。以上のことから、VZVの膜融合においては、これまでgB、gE、gH、gLが必須であるとされてきた説とは異なり、gB、gH、gLだけで十分な膜融合が引き起せることが明らかとなった。一方、MAG発現細胞はVZV感受性となり、MAG発現細胞へのVZVの感染は、抗MAGモノクローナル抗体で特異的に阻害された。以上のことから、MAGはVZV gBと会合し、膜融合を引き起こせるVZVのエントリーレセプターであることが判明した(図2B)26。gE自体はVZVの生存に必須な分子であるので、IDEやMPRciは、膜融合以外の感染過程での関与が想定される。
ウイルスの感染組織指向性を決定するにあたって、標的組織へのエントリーが可能かどうかも重要な要因のひとつである。例えばHIVのT細胞、マクロファージへの指向性は、エントリーレセプターであるCD4, CXCR4, CCR5に依存している。これまで、HSVあるいはVZVの感染に関与する宿主側分子として挙げられてきた、HVEM, Nectin-1, 3-O-HS, IDE, MPRciなどは、多臓器に分布しており、HSV, VZVの神経組織指向性を説明するには不十分であった。ところが興味深いことに、HSV-1のgBもMAGと会合し、MAGを介して膜融合を引き起こしMAG発現細胞に感染することが判明した。MAGは、神経組織にのみ局在するので、MAGが、VZVとHSV-1両方の神経組織指向性に関わるエントリーレセプターであると考えられた。逆に、神経組織以外へのHSVの感染において、既知のgDレセプターであるHVEM, Nectin-1, 3-O-HSとともに、PILRαやユビキタスに分布するgBレセプターである、non-muscle myosin heavy chain IIA (NMHC-IIA)が作用しているものと考えられる27。一方、VZVにおいては、IDE, MPRci以外に、皮膚や血球系細胞など、神経組織以外の組織に分布するエントリーレセプター分子は報告されていないが、未知のgBレセプターが存在していると考えられる。
糖鎖を認識する分子のうち、酵素や抗体を含まないタンパクをレクチンと総称する(GlycoWord、Lectinの章参照)。ウイルスとレクチンの関わりでは、例えば、HIVウイルス, SARS コロナウイルス, 麻疹ウイルスなどと会合するDC-SIGN等が知られており、C型レクチンと呼ばれる28。また、HIV, HTLV-1の感染効率を高めたりすると報告されているGalectin-1はS型レクチンである29。さらに、前に述べた、VZVの感染効率を高めるMPRciはP型レクチンである。このように、レクチンはウイルスとの相互作用にも重要であることが分ってきている。最近、これらレクチンの中のI型レクチンであるSiglec-1が、HIV, porcine reproductive and respiratory syndrome virus (PRRSV)などのウイルスと吸着することが報告されたが、他のsiglec(sialic acid-binding immunoglobulin-like lectin、シグレック)とウイルスとの関わりについては、まだよく分っていなかった30。
MAGはSiglec-4とも呼ばれているI型膜貫通タンパクであり、siglecは1か2個のV-セット免疫グロブリン様ドメインとそれに続く1から16個のC2-セットを持つ31, 32 (GlycoWord、シグレックの項参照)。V-セットIg様ドメインによって、シアル酸を含む様々なタイプの糖鎖を認識する。ヒトsiglecは、Siglec-1〜Siglec-16までが同定されているが、Siglec-13は欠番であり、Siglec-XIIはV-セットドメインにあるアルギニンに変異があるため、シアル酸を認識できない。siglecがシアル酸を介して標的分子を認識するという特徴をもつことから、MAGによるgBの認識にもシアル酸が関与していると思われる(Suenagaらunpublished data)。
上記のようにMAGによるHSV、VZVの感染にも、シアル酸が関与している可能性がある。一方PILRαも、免疫グロブリン様ドメインをもち、そのリガンドであるHSV gB、CD99、PANPと会合する際には、これらの分子上のシアル酸を必要とする。この意味でも、PILRαはsiglecに類似の分子といえる。実際、前述のように、MAGはPILRαとの相同性検索から浮かび上がった分子でもある。従って、HSV, VZV、HIV, PRRSV以外のウイルスでも様々なsiglecと会合し、siglecをエントリーに利用する可能性があり、siglec分子群とウイルスの相互作用を明らかにすることにより、ウイルスの感染成立のメカニズムの一端に迫れることが期待される。また、ウイルス感染における糖鎖の利用という観点から、ウイルスのエントリーレセプターなどとしての、宿主細胞側の糖鎖だけでなく、HSV gBやインフルエンザウイルスHA、HIV gp120、C型肝炎ウイルスE1、E2、ウエストナイルウイルスE、SARSコロナウイルスS、M、エボラウイルスGPなどのように、ウイルス側の表面(糖)タンパクの糖鎖修飾も、感染組織指向性の変化や、宿主免疫からの逃避を可能にする免疫原性変化をもたらすなど、ウイルス感染機構を解析する上で重要であると考えられる(図3)33。
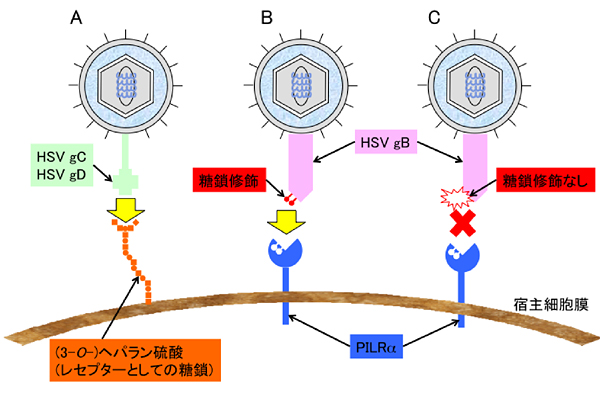
図 3 HSV感染における糖鎖の関与
(A) HSVはgCを介して、宿主細胞膜のヘパラン硫酸プロテオグリカンを利用して細胞膜表面へ吸着する。また、gDと3-O-硫酸化へパラン硫酸の会合を介して、細胞内へエントリーする。 (B) O型糖鎖修飾を受けたHSV gBはPILRαと結合し、HSVの宿主細胞へのエントリーを可能にする。(C) しかし、gBの特定のアミノ酸のO型糖鎖修飾を欠くと、PILRαと結合できず、宿主細胞へエントリーできない。(gBとgBレセプター、gDとgDレセプターの会合がエントリーには必須だが、本図では、どちらか一方のみ記載)。