
氏名:山本 憲二
石川県立大学生物資源工学研究所 教授
京都大学大学院農学研究科博士課程修了(1976)。農学博士。京都大学農学部食品工学科助手(1976-1991)、助教授(1991-1999)を経て、1999年より京都大学大学院生命科学研究科教授。2010年に定年退職の後、石川県立大学客員教授を経て2011年より現職。複合糖質の糖鎖やオリゴ糖の生合成および分解に関わる微生物酵素について研究を行ってきた。2011年に農芸化学功績賞を受賞。
遺伝子やタンパク質を任意に付加したり改変したりする技術は急速な進歩を遂げて来ており、遺伝子工学やタンパク質工学の分野の発展は医薬品の開発や病気の治療などに大きな役割を果たして来ている。一方、遺伝子が翻訳されてタンパク質が合成された後にタンパク質が修飾される過程として重要な「糖鎖の付加」については任意な構造の糖鎖を付加したり改変したりする有効な技術や手段が未だ充分であるとは言えない。糖鎖の生合成は細胞内のゴルジ体や小胞体に存在する数十の酵素が関わって行われるが、それを巧みにコントロールして目的の機能を持つ糖鎖をタンパク質に付加したり改変したりすることは極めて困難である。このような技術を持つことは不可能だと考えざるを得ない。
我々は遺伝子工学において遺伝子を切ったり貼ったりするツールである制限酵素のエンドヌクレアーゼと同じような働きをする手段として、微生物のエンドグリコシダーゼに着目した。この酵素を糖鎖工学分野における応用技術に活用して、糖鎖を切ったり貼ったり、あるいは改変したりすることにより、バイオ医薬品を含むさまざまな医薬品の化学-酵素合成を企てた。ここでは我々が土壌より単離した糸状菌Mucor hiemalisが生産するエンドグリコシダーゼであるエンド-β-N-アセチルグルコサミニダーゼを用いた糖鎖医薬品の合成について、本酵素の特異性を利用した効率的な合成法の開発実績をも交えて、これまでの成果を示したい1, 2。
微生物が多くのグリコシダーゼ(糖質分解酵素)を産生することは良く知られている。グリコシダーゼには糖を含む化合物から加水分解活性によって単糖を遊離するエキソ型のグリコシダーゼとオリゴ糖を遊離するエンド型のグリコシダーゼがあり、エキソグリコシダーゼはオリゴ糖や複合糖質の糖鎖の非還元末端から単糖のみを遊離し、エンドグリコシダーゼは糖鎖の内部構造を認識して作用することによりオリゴ糖を遊離する。
複合糖質に作用するエンドグリコシダーゼとして最も良く知られている酵素のエンド-β-N-アセチルグルコサミニダーゼはタンパク質のアスパラギン残基に結合するN-グリコシド結合糖鎖(アスパラギン結合糖鎖)の糖鎖とタンパク質との結合部に存在するジアセチルキトビオース部分(N-アセチルグルコサミンの2残基がβ1, 4結合した部分)を切断して、タンパク質側にN-アセチルグルコサミン(GlcNAc)1残基を残して糖鎖を遊離するという特徴的な作用を行う酵素である3。本酵素は微生物に限らず動植物に広く見出されるが、微生物起源の酵素が最も詳細に研究されて、その基質特異性や作用機作が明らかにされている。最近では小胞体におけるタンパク質の品質管理に関わるERAD(endoplasmic
reticulum associated degradation 小胞体関連分解)に関係する重要な酵素であることが明らかになっている4。
我々は京都市郊外の土壌より単離しMucor hiemalisと同定したケカビ糸状菌の培養液中に特異な基質特異性を持ったエンド-β-N-アセチルグルコサミニダーゼを見出し、Endo-Mと名付けた5。Endo-Mは多くのエキソグリコシダーゼと同様に加水分解活性とともに糖転移活性をも有することを見出した6。グリコシダーゼによる糖転移反応は糖の加水分解反応の特別な反応と考えられる。すなわち、加水分解反応はグリコシダーゼの作用によって基質から遊離した糖が水に転移する反応と見なすことができ、一方、糖転移反応は基質から遊離した糖が水の代わりに水酸基を有する化合物へ転移する反応である。エキソグリコシダーゼの糖転移活性はさまざまなオリゴ糖の酵素合成に利用されている一方、エンドグリコシダーゼの糖転移活性については詳細な検討が行われている酵素は多くない。その活性は複合糖質から遊離した糖鎖を水酸基を持つ化合物に転移付加することができる活性であり、すなわち、「糖鎖を化合物に付加することができる」グリコシレーションの手段として用いることが可能である。そこで、Endo-Mの糖転移活性を糖鎖工学における糖鎖の付加や改変の技術として活用して、生理活性を持つさまざまな医薬品の創成を企てた。
Endo-Mは加水分解活性によって糖タンパク質のN-グリコシド結合糖鎖とタンパク質の結合部分に作用し、アスパラギン残基にGlcNAcが結合したタンパク質と糖鎖を分離する一方、糖転移活性によって単糖のGlcNAcやアスパラギン残基に結合したGlcNAcなどに糖鎖を付加することができる。すなわち、ペプチドやタンパク質のアスパラギン残基にGlcNAcを付加すれば、Endo-Mの糖転移活性によって、その部分に糖鎖を供与体から転移付加することが可能であり、糖ペプチドや糖タンパク質を合成することができる。ペプチドやタンパク質に糖鎖を付加するとペプチダーゼやプロテアーゼなどの分解酵素からの防御や安定化、生理活性の付与などが可能である。そこで、生理活性を有する糖ペプチドの化学-酵素合成(Chemo-enzymatic synthesis)を試みた(Fig. 1)7。
この糖ペプチド合成法はペプチドのアスパラギン残基にGlcNAcを結合したN-アセチルグルコサミニルペプチドの合成の材料であるグリコシルアスパラギンの化学合成から始まる。先ず、GlcNAcのアジドとFmoc(9-fluorenylmethyloxycarbonyl)-アスパラギン酸のブチルエステルを材料としてFmoc-Asn-GlcNAcを合成する。これをFmoc-Asnに代わる材料として用いて、Fmoc-アミノ酸を材料とした固相合成法によるペプチド合成を展開し、N-アセチルグルコサミニルペプチド合成を行う。次に、Endo-Mの糖転移活性により、糖鎖供与体(ニワトリ卵黄由来の複合型糖鎖を有する糖ペプチドや卵白由来の高マンノース型糖鎖を有する糖ペプチドなど)から糖鎖を転移付加して糖ペプチドを合成する。すなわち、細胞内での生合成では数十の酵素反応により行われる糖鎖の付加をEndo-Mの糖転移活性を用いた一段階の反応で行うことができる。
このような化学-酵素合成法によって生理活性ペプチドに糖鎖を付加した糖ペプチドを合成した。すなわち、骨粗鬆症の治療薬であるカルシトニン8やHIVの宿主細胞への結合を阻害するエイズ治療薬のペプチド-T7などの生理活性ペプチドに糖鎖を付加した糖ペプチドを合成した。これらの生理活性糖ペプチドはアスパラギン残基にN-グリコシド結合糖鎖が結合したものであるが、アスパラギン残基のみならずグルタミン残基にも同様の方法によってGlcNAcを付加することができるので、アスパラギン残基を構成アミノ酸として持たないが、グルタミン残基を有する生理活性ペプチドのサブスタンスP9(知覚ニューロン伝達物質で血圧降下作用などが報告されている)のグルタミン結合糖鎖を有する糖ペプチドをも合成することができた。すなわち、この化学-酵素合成法により非天然型のグルタミン結合型糖鎖を持つ糖ペプチドを合成することが可能である。このような糖ペプチドは一様にペプチダーゼなどの分解酵素に対して抵抗性を示したが、生理活性についてはもとのペプチドよりもやや低下する。これはカサ高い糖鎖が付けられたために受容体への結合親和性が立体障害によって低下するためと考えられる。しかし、その低下は顕著なものではないので添加濃度を少し高めることによって生理活性は充分に発揮される。
細胞内ではN-グリコシド結合糖鎖は小胞体において、リボソームで作られたタンパク質のAsn-X-Thr/Ser(Xはプロリン以外のアミノ酸)というアミノ酸配列のアスパラギン残基に付加されるが、Endo-Mの糖転移活性を利用した化学-酵素合成においてはアスパラギン残基またはグルタミン残基さえ存在すれば、どのようなアミノ酸配列を有したペプチドにも糖鎖を付加することが可能であり、この点が化学-酵素合成法による糖ペプチド合成の最大の利点である。
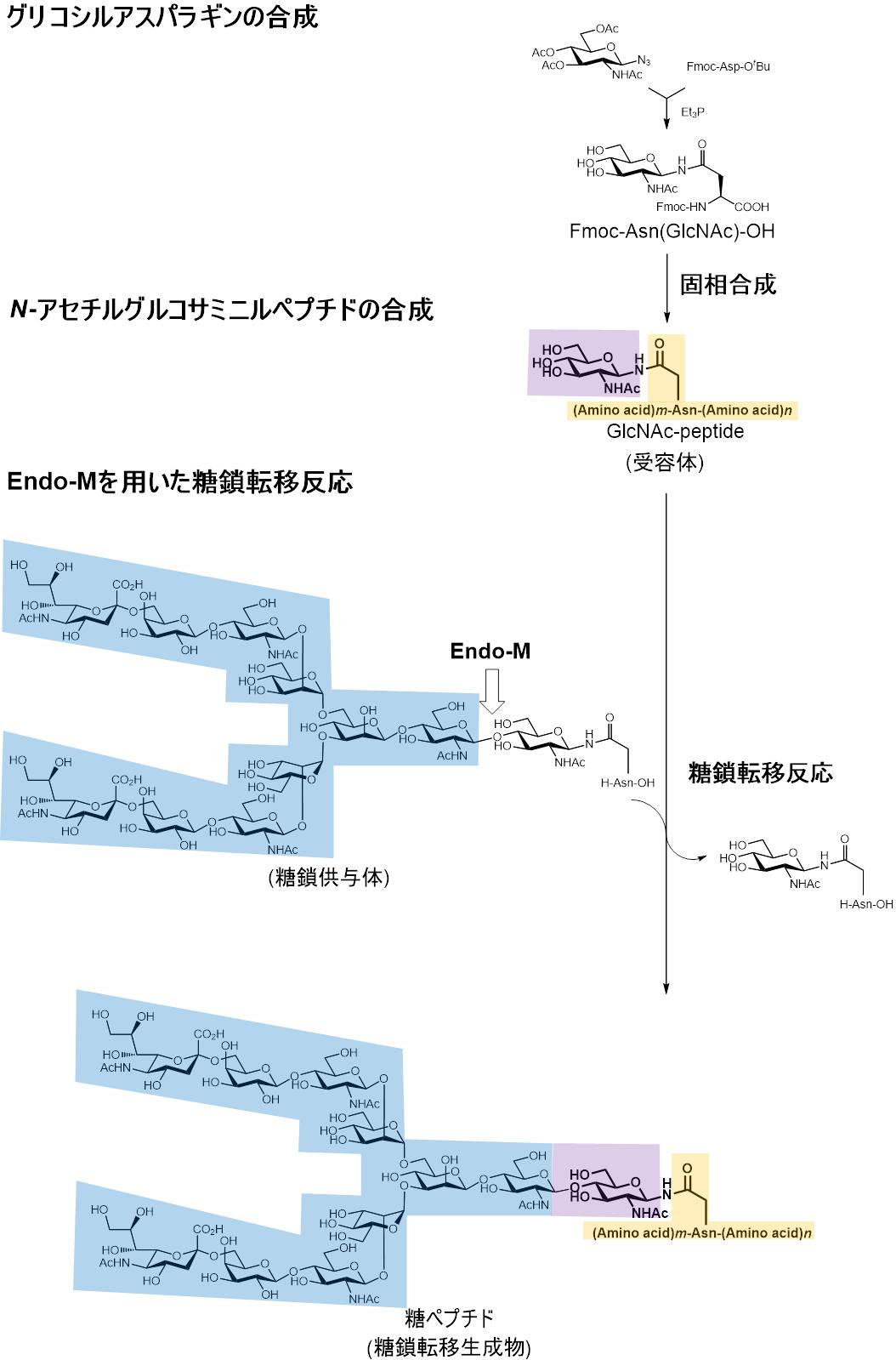
Fig. 1 Endo-Mを用いた糖ペプチドの化学-酵素合成
糖鎖工学における重要な課題の一つである「糖鎖を改変して目的の機能を持つ糖鎖にリモデリング(再構成)する」手段としてEndo-Mを活用することが可能である。すなわち、Endo-Mがヒトや動物由来の多くの糖タンパク質に存在する複合型のN-グリコシド結合糖鎖(数種類の糖から構成される複雑な構造の糖鎖)に作用して、さまざまな物質にその糖鎖を転移付加することができる特徴を利用することによって、高マンノース型糖鎖(マンノースのオリゴマーからなる単純な構造の糖鎖)などを持つ糖タンパク質をヒト型糖鎖と呼ばれる複合型糖鎖を持つ糖タンパク質にリモデリングすることが可能である10。この事実はヒト由来の糖タンパク質を遺伝子操作によって酵母を宿主として生産させた場合に発現する酵母特有のマンノースオリゴマー糖鎖を持つ組換え糖タンパク質を、Endo-Mを用いることによってヒト型糖鎖を持つ糖タンパク質にリモデリングすることが可能であることを示唆している。我々はメタノール資化性酵母Ogataea minutaを宿主として生産された抗体医薬である免疫グロブリンG(IgG)の糖鎖をヒト型糖鎖にリモデリングすることに成功した。すなわち、高マンノース型糖鎖に対して高い特異性を有するエンドグリコシダーゼであるEndo-Hを酵母により発現したヒトIgGに作用して糖鎖を除去し、GlcNAcを有するIgGを得た後、Endo-Mの糖転移活性によって糖ペプチド糖鎖供与体からヒト型の複合型糖鎖を転移付加して、ヒトに適応した糖鎖を持つIgGを得た。この結果は、これまでにCHO細胞などの動物細胞によって生産されているエリスロポエチンなどのさまざまなバイオ医薬品を組換え酵母によって大量生産した後にヒト型糖鎖にリモデリングすることにより、ヒトに適応したバイオ医薬品を大量生産できる方法を示唆している。
Endo-Mは本来、加水分解酵素であるため、糖転移活性を利用して糖転移生成物を得ようとする際に問題となるのは、いったん生成した糖転移生成物がEndo-Mの加水分解活性によって分解されるためにその収率が低下することである。そこで、加水分解活性が抑制され、糖転移活性が促進されるようなEndo-Mの変異酵素を作成することができれば糖転移生成物の生成収率を上げることが可能である。
Endo-MはSubstrate-assisted catalytic mechanismと呼ばれるユニークな反応機構によって酵素反応が進行することを我々は見出している11。一般にグリコシダーゼの触媒反応は酸塩基触媒残基と求核残基としてそれぞれ機能する2つの酸性アミノ酸残基を介して行われる。一方、Substrate-assisted catalytic mechanismにより反応が進行する酵素は酸塩基触媒残基のみを有し、基質に含まれるGlcNAc基の2-アセトアミド基が求核基として働く。このような反応機構によって酵素反応が進行する酵素にはキチナーゼやβ-ヘキソサミニダーゼなどがあり、それらの基質にはGlcNAc基が含まれている。このような酵素は通常のグリコシダーゼが反応中に糖-酵素反応中間体を形成するのに対してオキサゾリン反応中間体が形成され(Fig. 2)、オキサゾリン反応中間体は触媒残基の塩基性触媒によって活性化された水または受容体と結合することにより、それぞれ加水分解生成物または糖転移生成物が生成する。上記のβ-ヘキソサミニダーゼとタンパク質の立体構造が類似しているホモログ酵素が属するGlycoside hydrolase family 20(GH20)の酵素群は触媒残基であるグルタミン酸のN-末端側に1残基隣り合ったアスパラギン酸残基がいずれの酵素タンパク質にも高度に保存されており、オキサゾリン反応中間体の形成とその安定化を担うことが報告されている12。一方、Endo-Mが属するGlycoside hydrolase family 85(GH85)のホモログ酵素については触媒残基であるグルタミン酸残基の2残基N-末端側にアスパラギン酸残基ではなくアスパラギン残基が高度に保存されている13。そこで、N-末端より175番目のこのアスパラギン残基がオキサゾリン反応中間体の形成に何らかの役割を果たしているのではないかと考えられ、他のアミノ酸残基に置換した変異酵素を作成して、化学合成したオキサゾリン型の糖鎖を基質とした糖転移反応を行った(Fig. 2)。その結果、アスパラギン残基をグルタミン残基に置換した変異酵素N175Qは糖転移生成物が生成される一方、加水分解活性が著しく抑制されているために糖転移生成物が蓄積され、生成収率が著しく向上した14。この変異酵素N175Qは高マンノース型糖鎖およびシアロ複合型糖鎖のいずれのオキサゾリン型の糖鎖を供与体として用いても極めて効率的な糖鎖の転移付加が行われた。すなわち、オキサゾリン型の糖鎖を供与体として変異酵素N175Qの糖転移活性を利用することによって、糖転移生成物が加水分解を受けることなく著しく蓄積することより、N175Qは「グライコシンターゼ様」の働きをする酵素である15。また、この酵素はオキサゾリン型糖鎖のみならず、nativeな糖鎖についても供与体となり、糖転移生成物を効率的に得ることができる。我々は、変異酵素N175Qと糖鎖供与体としてシアロ複合型のオキサゾリン型糖鎖を用いることにより、酵母で発現したIgGの糖鎖の効率的なリモデリングに成功し、ヒトに適合した抗体医薬を大量生産できる可能性を示した。
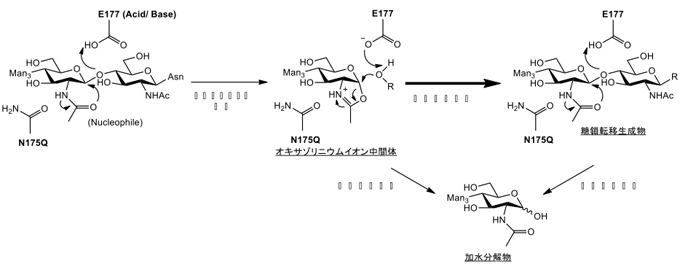
Fig. 2 Endo-Mの酵素反応機構
ヒトインフルエンザウイルスは宿主の細胞膜に存在する糖タンパク質や糖脂質の糖鎖のシアル酸に自身が持つヘマグルチニンという受容体の糖タンパク質を介して結合し、細胞に感染する16。感染したウイルスは宿主細胞内で複製した後、やはり自身が有するシアリダーゼによって細胞膜上のシアル酸を切断して細胞外へ遊離する。現在、インフルエンザウイルスの治療薬として広く利用されているタミフルはこのシアリダーゼの活性を阻害する薬剤であり、細胞に感染した後に細胞内にウイルスを閉じ込めることにより他の細胞への感染を阻止する働きをするもので、宿主への感染を阻害する薬剤ではない。
そこで、ウイルスの膜表面に存在するヘマグルチニンと宿主細胞の表面に存在するシアル酸の結合を直接に阻害するインフルエンザウイルス感染阻害剤の創成が期待される。我々はグルコサミンのポリマーであるキトサンにシアロ複合型糖鎖をクラスター状に結合させたグリコポリマーをインフルエンザウイルスの捕捉型感染阻害剤として合成した17。先ず、p-フォルミルフェニールGlcNAcを受容体としてEndo-Mの糖転移活性を利用してシアロ複合型糖鎖をニワトリ卵黄由来の糖ペプチドより転移付加した後、還元アミノ化反応によってキトサンのアミノ基に多価に結合させた。得られたグリコポリマーはおよそ16%の割合でシアロ糖鎖がキトサンに結合され、90%以上の阻害効果でA型インフルエンザウイルスによるMDCK細胞(イヌ腎臓細胞)への感染を阻害した。
バイオ医薬品のほとんどは糖タンパク質であり、その糖鎖は薬効や安定性の面で極めて重要である。それ故にバイオテクノロジーの技術を用いた糖鎖の付加や改変は重要な課題になる。とりわけ、今後、バイオシミラーと呼ばれる後続医薬品の品質や生産性において注目されることは糖鎖の不均一性であり、同じ品質や薬効が求められるバイオシミラーの生産には重要な問題となる。そのような状況において、Endo-Mの糖転移活性を活用してバイオ医薬品を合成する方法の開発は非常に重要な課題になる。今後益々、Endo-Mの必要性がこれまで以上に増して来るであろうと考えられ、同時により効率的な糖転移反応を行う酵素的な開発が求められる。