浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年より帯広畜産大学教授。現在、日本酪農科学会会長、日本糖質学会評議員、日本糖鎖コンシーシアム幹事。
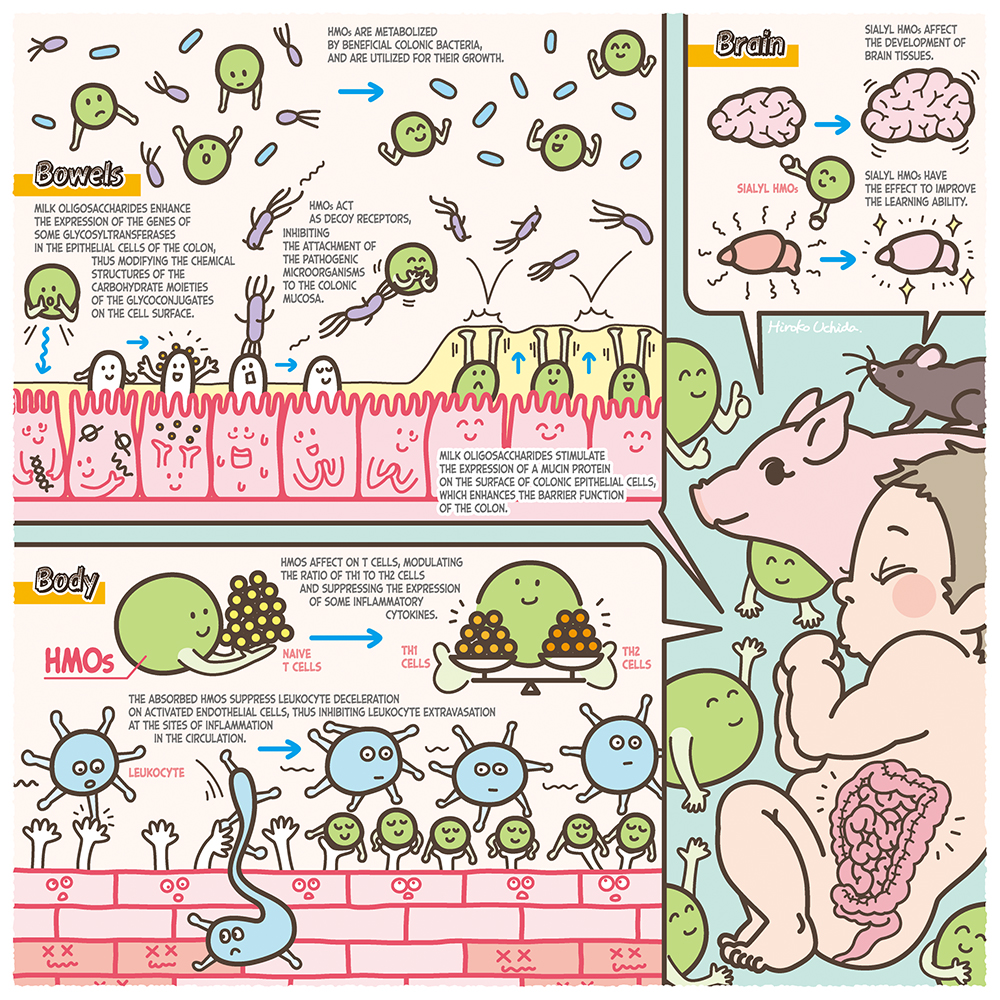
人乳は7%の糖質のうちの80%をラクトース(Galβ1-4Glc)、20%をミルクオリゴ糖が占めている。ミルクオリゴ糖の濃度は常乳で12〜13 g/L、初乳で22〜24 g/Lであり、ラクトース、脂質に次ぐ3番目の固形成分であるが1、実はおどろくほどに高い。ヒトミルクオリゴ糖(HMOs)はごく少数の例外以外は還元末端側にラクトース単位を有し、N-アセチルグルコサミン(GlcNAc)、ガラクトース(Gal)、フコース(Fuc)、N-アセチルノイラミン酸(Neu5Ac)が結合している。現在までに約250種類が分離され、そのうちの約170種類が構造決定されている1。乳児による母乳摂取後、ラクトースは小腸上皮でラクターゼによって加水分解を受け、吸収されるのに対し、大部分のHMOsは消化吸収されないで大腸に到達し、そこで栄養因子以外の重要な生理的役割を担っている2,3。実験的証拠に基づいて提案される機能は、有用性腸内細菌ビフィドバクテリウムの増殖定着促進、病原性細菌・ウィルスへの感染防御、抗炎症性などの免疫調整作用、壊死性腸炎予防と腸管バリア機能、脳神経系の活性化、などである3。本シリーズは、その中でもビフィドバクテリウムによるHMOsの代謝と宿主・腸内細菌クロストークへの役割、その産業的実用化への取り組みなどを中心に、近年ダイナミックに展開されるようになった物語の展開と、今後への展望を中心に、第一線の研究者による熱い思いを連載する予定である。まずは第1回目として、このシリーズ著者以外の研究者による国際的な研究状況を概論として紹介する。
病原性ウィルス・細菌に対するHMOsによる抗感染効果は、従来、宿主細胞への接着阻止メカニズムを想定して、上皮細胞とウィルスまた細菌株の共培養系にHMOsを添加して培養したin vitro実験において研究されてきた。つまりHMOs無添加のコントロール実験と比べて、培養後に細胞に吸着した病原体の数が減少する割合を指標として評価された。例えば、Hesterらは尿細管上皮由来のMA-104細胞に対してブタまたヒト由来のロタウィルス株とともに、HMOs混合物を1〜10 mg/mLの濃度で添加して培養した後、細胞に吸着したウィルス量を測定したところ、ブタ由来のウィルス株に対してはHMOs添加においてコントロールよりも吸着量は低下したが、ヒト由来の株に対しては吸着量の低下は観察されなかった4。一方、他のヒト由来ロタウィルス株とMA-104細胞、および2’-FL, 3’-SLまた6’-SLを使用した実験では、5.0 mg/mLの投与によって吸着するウィルス数は減少していた5。ヒトロタウィルス株を使用した他の実験では、反対に吸着するウィルス数が増加する観察もあって6、接着阻止による感染防御メカニズムの実証は一筋縄ではない。接着阻止ではなく、HMOs摂取によるワクチン効果の増強による感染阻害を示唆する実験もある。Xiaoらは6週令の雌マウスに0.25〜5%の2’-FL(最大濃度で含まれるHMO)を添加した食餌を与え、2週間後に右耳に不活性化インフルエンザワクチンを、対照として左耳に生理食塩水を皮下注射し、さらに9日後にワクチンを追加接種してから、追加ワクチン接種前と接種24日後の炎症反応を耳厚測定から評価した7。その結果、2’-FL摂取マウスで炎症反応の上昇と、血清中の同ウィルス特異的IgG1とIgG2抗体濃度がコントロールよりも上昇していた。一方、仔ブタに4 g/LのHMOsを含む調合乳を摂取させ、ついでロタウィルス株を経口させてから数日後に免疫担当細胞数を測定し、HMOsを摂取しなかったコントロールと比較すると、末梢血のインターフェロン-γ生産細胞数はコントロールよりも2倍高かった8。これは、HMOs摂取による自然免疫能の向上によるウィルス感染防御の可能性を示している。
接着阻止による感染防御は病原性細菌に対しても観察されている。10 mg/mLのHMOsと予め培養した腸管病原性大腸菌株を、HeLa細胞、Hep-2細胞またT84細胞に感染させた後細胞に吸着した細菌数を測定すると、HMOsを添加しないで培養した場合よりもその数は有意に低下していた9。
HMOsが病原性細菌の増殖を直接抑制する観察結果も報告されている。髄膜炎起因菌であるグループBストレプトコッカス(GBS)を、0.25〜2 mg/mLの中性HMOsとともに培養しその増殖速度を測ると、HMOs添加によって増殖は有意に抑制されていた10。
このようにin vitroまたin vivoの実験結果から、HMOsによる病原性ウィルスや細菌に対する感染防御は期待されるが、今後は感染したヒトに対する臨床試験も求められる。2’-FL, 3’-SL, LNnTなどの少数のHMOsの工業的な生産が開始されているので、臨床試験も可能になるであろう。
乳児による母乳の授乳後、大部分のHMOsは小腸での消化吸収を受けないが、一部は腸上皮を通過し血液循環系に入ってから、免疫細胞に作用して抗炎症性などの免疫調整に関わることを示す証拠がある。例えば次のようなin vivoでの実験結果が報告されている。Castillo-Coutadeらは食品アレルギーをもつオボアルブミン感作マウスに、一定期間5 mg/mLの2’-FLまた6’-SLの水溶液を経口摂取させ、下痢や栄養障害スコアを観察するとともに、脾臓細胞の炎症性サイトカイン生産量やマスト細胞数を、HMOsを摂取させなかったコントロールマウスと比較した11。その結果、それらの摂取は下痢や栄養障害スコアを緩和し、マスト細胞数や腫瘍壊死因子(TNF)など炎症性サイトカイン発現量を低減することが示された。
こうしたHMOsによる食品アレルギー緩和能は、in vitro試験からも示されている。ZehraらはT84細胞またHT29細胞を抗原―抗体複合体とともに10 mg/mLの2’-FLまた6’-SLを添加して培養し、炎症性サイトカインIL-8やCCL20の分泌量を調査したところ、2’-FL添加によって2つの細胞でIL-8の濃度が低下し、IL-8およびCCL20両者の濃度低下はT84細胞に対して観察された12。
吸収されたHMOsが、体内循環中に白血球と相互作用して免疫調整能を発揮することを示唆する研究例もある。Zhangらは0.1〜1 mg/mLのHMOsをマウス腹水由来マクロファージRAW264.7細胞とともに培養し、炎症性メディエーターやサイトカインの増減量を測定したところ、IL-1β, IL-2, IL-6, IL-10およびTNF-αのmRNA発現量とともに、核内NfkBタンパク質、p38キナーゼ、細胞外シグナル関連キナーゼおよびC-Jun末端キナーゼの発現量の増加が観察された13。このことから、HMOs摂取によるNfkBシグナル経路とMAPKsシグナル経路の活性化が示された。
母乳栄養児は人工栄養児と比べて壊死性腸炎(NEC)の発症割合の低いことが知られているが、in vivo実験からHMOs摂取によってNECへの予防と症状緩和への効果のあることが示された。Jantsher-Krennらは、妊娠期の母ラットに炎症誘発剤を注入することで出生後の乳仔ラットにNECを誘導し、ついで母親と一緒に飼育する群(DAM群)、全HMOs(10 mg/mL)を含む調合乳の摂取群(HMOs群)、ならびにHMOsを含まない調合乳を摂取させたコントロール群に分けて飼育し、96時間後に結腸を回収した14。それぞれの群ごとの炎症をスコア化したところ、HMOs群のスコアはコントロール群よりも有意に改善し、DAM群に近かった。HMOsの中でNEC低減効果のあるオリゴ糖を探索し、シアル酸2単位を含むDSLNTに効果のあることが示された。
HMOsによるNEC防御メカニズムは、次のような観察に基づいて、腸管バリア機能の回復であることも予想される。Wuらは、HMOs(20 mg/mL)を添加した調合乳を摂取させた乳仔マウスに対し、低酸素曝露とリポ多糖(LPS)投与によってNECを誘導し、ついで結腸を回収して炎症スコアを測定したところ、HMOs投与群にコントロール群よりも有意な改善を観察した15。摘出した組織の染色と顕微鏡観察から、コントロール群でNEC発症による腸上皮Muc2産生細胞の損傷が観察され、HMOs摂取群では同細胞数が高く維持されていた。Muc2は、主に小腸や大腸上皮において杯状細胞によって産生される分泌性ムチンであり、バリア機能の維持に重要な役割を有する。
シアル酸を含むHMOsの経口摂取によって吸収されたシアル酸が、脳内でのシアリル複合糖質の合成材料として利用されることも示唆されている。Jacobiらは仔ブタに2〜4 g/Lの3’-SLを含む調合乳を21日間摂取させ、ついで脳を回収して大脳皮質、小脳、脳梁ならびに海馬のシアル酸濃度やガングリオシド濃度を測定した16。そしてSLを含まない調合乳を摂取した群と比較したところ、小脳のシアル酸濃度とガングリオシド濃度は3’-SL摂取によって濃度依存的に上昇し、脳梁におけるシアル酸濃度は、2 g/Lの3’-SLまたは6’-SL添加調合乳摂取によって増加していた。
シアル酸を含むHMOsの経口摂取によって、脳組織が拡大するかどうか調査した例もある。Muddらは、0〜760 mg/Lのシアリルラクトース(SL)を含む調合乳を投与した仔ブタの脳組織中のシアル酸濃度の定量と、磁気共鳴イメージング(MRI)観察を行い、SL摂取と脳組織発達(海馬拡大平均、軸方向拡大、放射線拡大)との相関を調査した17。その結果、濃度依存性はないが、それらの測定項目は中程度の濃度のSL投与群でコントロール群よりも拡大しており、海馬中の結合型シアル酸濃度に対する遊離シアル酸濃度の割合は、コントロール群よりも投与群で高い値を示した。
HMOsの摂取が、実験動物の行動様式に影響をもつことを示唆する観察もある。Tarrらは、3匹のオスマウスをケージ内で、5%の3’-SLまた6’-SLを添加した食餌またコントロール食を摂取させながら1週間飼育した18。ついで1日に2時間、1週間に渡って攻撃的なマウスをケージにいれて飼育し、対象マウスの不安行動をSL摂取群とコントロール食摂取群とで比較観察したところ、SL摂取群の方が不安行動の改善が示された。これらの観察のように、シアル酸を含むHMOsの摂取によって吸収されたシアル酸が、脳内でのガングリオシド合成に利用され、脳組織の発達とともに行動様式にまで影響を与えるかどうか、さらなる研究実施が求められる。
腸管上皮細胞へのHMOsの曝露によって、グライコジーンの発現に影響し、腸管上皮の糖鎖構造が修飾を受けることも示唆されている。3’-SLに曝露したCaco-2細胞において、α2,3シアリルトランスフェラーゼST3Gal1, 2, 4の発現レベルの低下が起こり、細胞表層のグリカン構造の変化したことが示唆されている19。そのことで、α2,3および2.6結合シアル酸の発現量が低下し、腸管上皮細胞への腸管病原性大腸菌の付着量が低下することも予想された。
一方、ウシ初乳から分離されたシアリルミルクオリゴ糖(BCO)をHT-29細胞へ曝露した後、細胞表層糖鎖の変化と腸内常在細菌の付着促進作用の上昇が観察されている。Morrinらは、0.5〜6mg/mLのBCOまた3’-SLを添加した培地でHT-29細胞を培養した後に、Bifidobacterium longum subsp. infantis, B. longum subsp. longum, B. breve, B. adolesentis, またLactobacillus rhamnosusを添加して培養し、細胞を洗浄した後に付着した細菌を回収た20。ついで寒天培地で培養してコロニー数を計測したところ、BCO曝露により細胞に吸着した細菌数はB. longum subsp infantis株で22倍、B. longum株で52倍、B. breve株で24倍上昇していた。また、B. adolescentis株とL. rhamnosus株では6倍上昇していた。一方、BCOに曝露した細胞において、5種のグリコリルトランスフェラーゼ(STSGAL5, CHST4, GNE, B4GALNT3, B5GNT5)のmRNA発現量が上昇し、上の腸内細菌の付着量の上昇との関係が示唆された。
このように最近報告されたHMOsやBCOの潜在的な生理機能を紹介したが、これらは研究例の一部にしかすぎない。一方、報告された生理機能の多くは、ガレクチンなどのレクチンとの相互作用など、分子レベルでのメカニズムの解明には至っていない。HMOs機能を現象論的に記載するだけでなくて、分子レベルでのメカニズムに基づいた解析を試みるのは今後の課題である。
本報では最近海外で行われたHMOs機能研究の例を紹介した。このシリーズの後続編では第一線の国内研究者自身によって、プレバイオティクスや宿主―腸内細菌クロストークへの効果などを中心に、明らかになったHMOs機能の研究成果やHMOsの産業面での実用化への取り組みを紹介する。