
佐藤 祥子
ラヴァル大学医学部・医学部付属研究所、薬学博士
千葉大学薬学部卒業。1987年より東京大学医科学研究所大学院で木幡教授の指導を受ける。その間ロンドンの国立医学研究所にてR. Colin Hughes博士の下でガレクチン-3の研究を行う。1994年東京大学博士号取得。ついでスタンフォード大学のDr. Ron Kopito研究室でポスドク研究員として、遺伝性嚢胞性線維症への化学療法に関する研究を行った。1999年よりカナダ・ラヴァル大学医学部感染症研究センター糖質生物学研究室主任研究員、ラヴァル大学医学部准教授。2010年同大学同部教授。2003年以降同部門Bioimaging platformの長兼任。
ガレクチン-3は他のガレクチン家系メンバーと構造的に全く異なる。C末端のβ-ガラクトシドに親和性のあるレクチンドメイン(Carbohydrate-binding domain: CBD)に加えN末端にCBDとほぼ同じ長さの非レクチン部分がガレクチン-3には存在するからだ。非レクチン部分の大部分はプロリン、グリシン、チロシンに富んだ9〜13個のアミノ酸からなるペプチドが9〜12回繰り返した構造で、特定の二次および三次構造を形成しない「天然変性領域」である1.。過去数年の研究で、糖鎖に結合したガレチン-3がこのN末の変性領域を介して液–液相分離(Liquid-liquid phase separation、以下LLPS)に関与している可能性が示されてきた 注1) 2–6.。
注1)LLPS は物理化学分野では確立した分野であるが、生命現象への関連を示唆したのはHymanの研究グループである55。ごく最近まで、このLLPS現象は細胞内の現象を紐解くために研究されていたため、細胞膜上で同じようにLLPS現象が起きるとは全く考えられていなかったようである。2015年にDennisが初めて細胞膜上でのガレクチンの機能がLLPSと関連していると提唱し2、2017年に台湾のHuangのグループが初めてそれを示唆する実験的データを示した3。
LLPS現象が起きている空間は、膜のない細胞オルガネラと言われる。LLPS現象が起きると、溶液に溶けている複数の物質が混じりあわずに安定的に2相に分離する状態になり、脂肪膜非存在下、特定の生体物質が高濃度に集まる空間が生まれる。さらに、温度、塩濃度、pH、低分子の存在他さまざまな環境の微妙な変化により、この状態は急速に形成または解消される。従って、LLPSにより特定の時間・場所に生まれた流動性のある凝縮空間においては、様々な生命現象が効率よく起きたり制御されたりするとされている。LLPS現象に必要なものは、不確定な構造と弱い親和性を介した結合の蓄積だが、このことはガレクチン-3特有の以下の生化学的特徴と共通点がある:i)ガレクチン-3の天然変性領域、リガンドの糖鎖ともに柔軟で特定の構造を持たない、ii)ガレクチン-3と糖鎖の結合が「おおまかで曖昧」7,8、そしてiii)糖鎖結合後にレクチンの多量体化が起こる。加えて指摘したいのは、ガレクチン-3のCBDは、同士の相互作用ばかりでなく、異なるガレクチンのCBDも相互作用するので9、ガレクチン-3が足場となり他のガレクチンもLLPS現象に関与する可能性がある点である。従って、細胞質レクチンであるガレクチン-3の細胞内、および細胞外での機能の理解を深めるために、LLPS現象は興味深く、今までと異なる視点を与えてくれる。さらに、かつて、ガレクチン・グライコフォーラムで指摘された「強くて厳格な結合だけが大事なのではない」点7,8に通じる。このフォーラムではこれらの点を生化学的、そして生物学的に考察し、ときに妄想を交え議論してみたい。
さて、ガレクチン-3によるLLPSの誘導の可能性を論ずる時に避けて通れないのが、いまだに謎の多いガレクチン-3特有の多量体化(Oligomerization)である。今日まで、この点について網羅した総論はない。そこで、本稿(前編)では、ガレクチン-3の多量体化について、歴史的にどのような研究がされてきたかを著者が理解できる範囲で紐解く。さらに、まだ残る謎(unsolved question)である多量体化に関する問題をLLPSの観点から考える。すなわち、今さまざまなバイオの分野で話題になっている膜なきオルガネラ–LLPSとは何か、そして何が現在のLLPS研究の限界であるかについて論じたい。後編では、ガレクチン-3がどのようにLLPS現象と関わっているのか、細胞内そして細胞外で報告されているガレクチン-3の機能とLLPSの関連を議論し、さらに、他のガレクチンの機能にガレクチン-3がLLPSを通して影響する可能性について言及したい。本稿を執筆するにあたり、LLPSを中心に論文をたぐっている。とはいえ、30年以上の歴史があるガレクチン-3の天然変性領域や多量体化について全ての論文を網羅できていないことをあらかじめ申し上げておく。
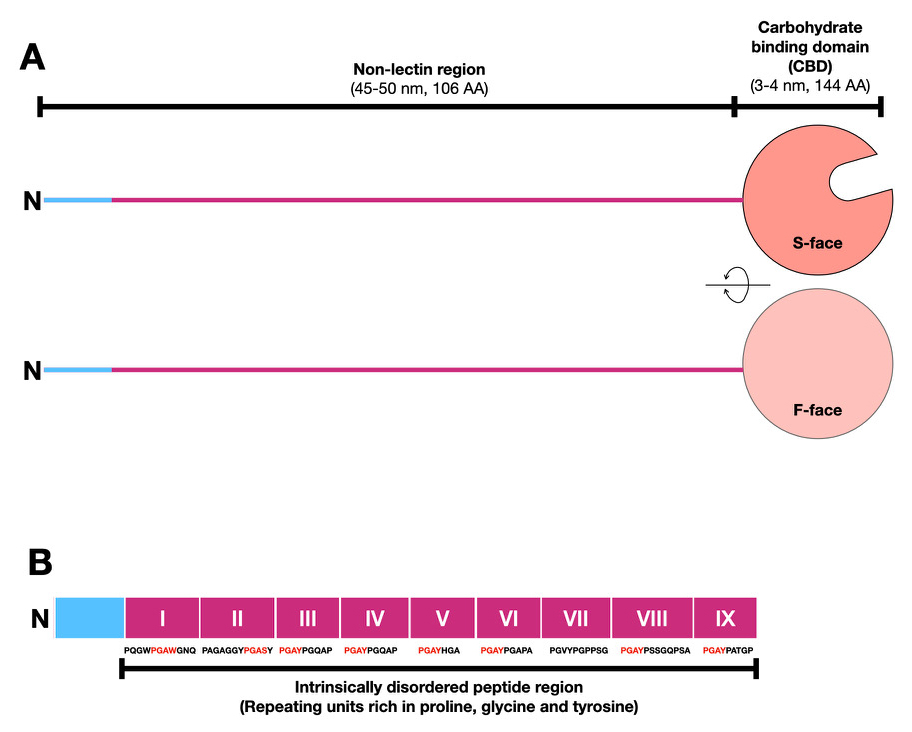
β-ガラクトシドに親和性のあるガレクチン家系のメンバーは構造的に3つのタイプに分かれる10。ロールケーキのような三次構造をとる糖結合ドメイン(CBD)のみからなるプロトタイプ、2つのCBDが比較的短いペプチドを介して繰り返されているタンデムリピートタイプ、そしてC末端側のCBDにN末端のCBDとほぼ同じ分子量の非レクチン部分(通常はN末ドメインと呼ばれる)が接続しているキメラタイプである(図1 A)。脊椎動物の場合、プロトタイプやタンデムリピートタイプは数種類存在するのに対し、キメラタイプはガレクチン-3ただ一つである1。当時(1999年)、ガレクチン-3以外にも様々なN末端非レクチン領域を持つキメラタイプのガレクチンの存在を想定しこの分類名は提案されたのだが10、事実は大きく異なっていたことになる(平林、私信)。なぜ、ガレクチン-3のみなのか。
ガレクチン-3のCBDには2つの面がある。6つのβストランドからなる糖鎖に結合するポケットがあるβシート面をS面と呼び、その反対側にある5つのβストランドからなる面をF面と呼ぶ(図1 A)。
他のガレクチンに見られない非レクチン領域について少し詳しくみてみよう(図1 B)。N末端のアミノ酸残基18個からなるペプチド配列に続いて、おもにプロリン(P)、グリシン(G)、チロシン(Y)からなる7〜12アミノ酸残基の配列が7〜14回繰り返した構造である。この繰り返し部分は二次ないし三次構造を形成しない。このように安定した構造を取らないポリペプチド領域を天然変性領域(Intrinsically disordered peptide region)と呼ぶ。ガレクチン-3特異的なN末端領域は通常N末端非レクチンドメインと呼ぶが、元来、ドメインという名称は二次ないし三次構造を形成したポリペプチドについて用いるべきであるので、本稿では、この部分をあえてドメインでなく、非レクチン領域(Non-lectin region)と呼ぶ。また、その領域内の特に繰り返し配列部分を天然変性領域(N-terminal intrinsically disordered peptide region)と呼ぶ(図1 B)。
ガレクチン-3はこの家系の中でガレクチン-1とともに最も研究されているメンバーである11。細胞レベルでは、例えば、細胞内ではオートファジーの司令塔的な役割をし12, 13、線毛(cilium)の機能に関与し14, 15、RNAに結合し、さらにスプライシング活性もあり16, 17、Ras活性の調節を行うことなどが知られている18。細胞外では、低濃度ではクラスリン非依存的なエンドサイトーシスを誘導し19-21、高濃度ではガレクチンラティスを形成し細胞表面の糖タンパク質の動態の制御を担い22–26、また筋繊維の再生を効率化する27。in vivoレベルでは、例えば、先天性免疫の初期誘導の調節に関与し11, 28、獲得免疫の反応の閾値を調節することで適度な抑制をするが29–31、一方では癌の転移や組織の繊維化を促進する32, 33。このような活性の多くは(全てではないが)、CBD を介したガレクチン-3のリガンドへの結合とそれに伴う多量体化が必要であることが判明している。以下に詳しく述べるように、通常このレクチンは単量体で存在する。ではどのようにして多量体になるのであろうか。
二量体を形成するプロトタイプのガレクチン-1やタンデムリピートタイプのガレクチン-9のように1分子に2つのCBDがあるものと異なり、ガレクチン-3は分子中にCBDが一つしかない。リガンドが存在しない状態ではガレクチン-3は単量体として存在し、二量体を含む多量体にはならない (Note 2)。しかしながら、赤血球凝集活性があるため、ガレクチン-3が糖鎖に結合したのちに何らかの形で二量体もしくは多量体になるものとガレクチン発見当初から考えられていた。多量体化の分子機構の研究は30年に渡り断続的ではあるが精力的に行われている。しかし、いまだに、分子機構は解明されていない。まず2000年以前の知見から始め、その後新しい手法を用いて、近年判明してきたことを筆者の分かる範囲で紹介する。
注2)高濃度(20µM)においてもガレクチン-3は単量体であることが確認されている35。
1992年にLiuのグループは非レクチン領域がコラゲナーゼにより切断されることを利用して、CBDを調製し、これをガレクチン-3と比較した。彼らは、固定化された糖鎖との結合において、ガレクチン-3は低濃度(0.3 µM以下)では、濃度に依存した通常の結合をするのに対して、約1µM以上の濃度で協調的に結合(Positive cooperative binding (Note 3))することを見出し、さらにその現象には非レクチン領域の存在が必要なことを初めて報告した34。この結果から、固定化された糖鎖に結合後、ガレクチン-3が多量体化する可能性が示唆された。
注3)Cooperative binding:協同的結合は、個々の要素が独立して作用する通常の相互作用と異なり、要素(ここではガレクチン-3)が互いに依存して作用する(ここでは糖鎖への結合)現象。
1993年にBarondesのグループもこの現象が0.3 µM以上ガレクチン-3で起きることを再確認し、さらに、この現象にリガンドである糖タンパク質のタンパク質部分は必要ないこと、そして可溶性の小さな糖鎖リガンド(Thiodigalactoside)存在下では起きないことを見出した35。ガレクチン-3は、通常の結合が起こる低濃度でも、協調的結合が起こる高濃度であっても、結合阻害剤ラクトースに対する感受性が同じであった。従って、ガレクチン-3の構造が、固定化された(足場のある状態の)糖鎖に結合後、何らかの変化が起き、多量体化を誘導し、その結果協調的結合を起こすのではないかとの仮説を打ち出した。ちなみに、天然変性領域を持たない他のガレクチン家系のメンバーではこのような協調的結合は全く観察されない。
HughesのグループはSurface plasmon resonance (SPR)解析により、上記の協調的結合現象が起きる濃度条件では、非レクチン領域が糖鎖から解離する速度を遅くすることにより、糖鎖とガレクチン-3の結合が安定化することを示した36。2001年には彼らは、シャドウイングしたガレクチン-3のイメージを電子顕微鏡で撮影した。ガレクチン-3の場合は多くが単量体であったが、ガレクチン-3の非レクチン領域のみの場合は、アミロイドのように、多量体化している像が得られた。このことから、通常はCBDが非レクチン領域の自己会合を抑えているとのではないかと推察した37。
非レクチン領域の自己会合と同様に、1998年頃からガレクチン-3のCBDも多量体化することを示唆する報告が出始めた37–39。さらに、糖結合していないガレクチン-3において、非レクチン領域がCBDと緩い相互作用をしていることを示唆する結果も報告されている40。
これら初期の研究から推察されたのは、非レクチン領域同士の結合に加えCBD同士の結合がガレクチン-3の多量体化に関与し、さらに、非レクチン領域とCBDの相互作用も何らかの形でこの多量体化の調節に関わっていることである。
さて、後のLLPSの章でも説明するが、一般的には、LLPSに関与する、非常に柔軟な構造を持つタンパク質や核酸(RNA)が、それぞれの“飽和濃度”、または“溶解限界濃度”に局所的に到達した時にLLPS現象が起こるとされている。すなわち、もし、ガレクチン-3がLLPSを起こす場合は、局所的に、その天然変性領域、CBDそして、そのリガンドであり柔軟な構造を持つ糖鎖の濃度が“飽和濃度”に達する必要がある。
上記の生化学的研究で、ガレクチン-3特有の協調的結合が検出されるためには、糖鎖が表面に固定され、一定濃度のガレクチンが必要であることが明らかになっている。これが、LLPSに必要な“飽和”濃度と何らかの関係があるのかもしれない。しかしながら、SPRによる結果では、表面に固定した糖タンパク質の量に関わらず、ガレクチン-3は協調的結合が起きると解釈できる結果も報告されている36。この協調的結合が、局所的にどのような状態になったときに起きるのかについては、更なる解明が必要である。
1990年代頃から、リガント非存在下では単量体であるガレクチン-3が赤血球以外に対しても細胞凝集や細胞間結合を起こし、さらに、膜タンパク質の架橋を起こしてその動態の制御をしていることを示唆する知見が蓄積されてきた。このため、試験管内で生化学的に確認されている多量体形成がこの機能と関連していることは容易に想像できた。しかし、37℃の細胞表面上で実際に起こるのかについては、当時誰も挑んでいなかった。2007年に我々はFluoresccene resonance energy transfer (FRET)という手法を用いてこの課題解決に臨んだ。FRETシグナルは、物質間の距離が非常に近い場合に発せられる蛍光である。すなわち、タンパク質AとBの距離が10 nm以下である場合、Aタンパク質についている蛍光物質(donor:例えばAlexa488 )から発せられた波長でBタンパク質についている蛍光物質(acceptor:例えばAlexa 555)が励起される。この場合、Alexa555から発せられる蛍光をFRETシグナルとして検出することになる。この技術を用いれば、細胞表面に結合するガレクチン-3の分子同士がどれくらい近傍にあるかを調べることができる。すなわち、細胞凝集や細胞表面にラティスを形成するときに、実際にガレクチン-3が多量体化しているかを解明できると考えた41。
Alexaをガレクチン-3のC末端に特異的に結合させた2種類のガレクチン-3標識物、(Galectin-3-C-Alexa488とGalectin-3-Alex555)を用いた場合に、好中球上、そして、血管内皮細胞上に結合している好中球上の細胞接着面において、この2種の蛍光標識ガレクチンが共存しており、さらにFRETシグナルが検出できた。これに対して、非レクチン領域のないCBD(CBD-C-Alexa488とCBD-Alex555)を用いた場合、それぞれのCBDが顕微鏡下で同位置に存在していても、FRETシグナルを全く検出できなかった。この結果は、ガレクチン-3を介した細胞結合(この場合は好中球の血管内皮細胞への結合、または好中球同士)において、細胞表面でガレクチン-3CBD分子の会合が起き、さらにこの会合には非レクチン領域の存在が必要なことを示している。従って、試験管内で報告されたガレクチン-3の多量体化は細胞膜上でも実際に起きていることが示唆された。
2004年にBrewerのグループは非常に高濃度(150 µM)のガレクチン-3とガレクチンの糖鎖リガンドを溶液内で混合した時にできる沈殿物中のガレクチンとリガンドに含まれるラクトサミンの比率を精密に調べた。その結果、彼らは、ガレクチン-3が少なくとも五量体を形成できると推測した42。この”5”という価数の多量体が、生理的な条件でも起きているのかは今日まで不明である。
ここで指摘したい点は、論文でも述べられているように、ガレクチン-3の多量体は不均一と推測される点である。ガレクチン-3の多量体化には天然変性領域とCBDが共に関与して起こることが本論文でも明示されており、必ずしも五量体(ペンタマー)である必要はない。しかしながら、この「ペンタマー」という言葉がなぜか一人歩きしているようである。このペンタマーを5枚の花びら(CBD)と5本のめしべ(非レクチン領域)を持つ花のように美しく描かれたイラストが視覚的にわかりやすいせいであろう、Nature系、及びその他のレヴュー誌にこのイラストが頻繁に使われるようになっている。このイラストは、読者に必要以上の固定観念―ガレクチン-3の多量体がC型レクチンのコレクチンのように構造的に非常に安定したもの 注4)―を与えていないだろうか。安定した多量体でもないし、五量体と決まったわけではない点は押さえておくべきポイントである。
注4)コレクチンは糖結合部位、コラーゲン様の構造とコイルコイルの構造を持つネック構造からなるC型のレクチンである。三量体がコレクチンの一つの単位となり、それがさらに多量体化する。三量体の糖結合部位はネック構造に支えられて正三角形の固定構造になっており、論文ではきれいな花束のようなイラストで描かれる。ちなみに、コレクチンはマンノース、フコース、グルコースに弱い親和性を持ので、単独の糖結合部位にはあまり糖結合特異性がない。しかしながら、3量体の正三角形の構造により、コレクチンは宿主の複合糖鎖に結合せず、微生物膜上の繰り返し構造を持った糖にのみ結合するという特異性が生まれる56。
先に述べたように、ガレクチン-3の多量体化はそのリガンドが膜上にある場合には生理的な濃度で検出可能だが、このような条件下では、多量体の正確な生化学的状態の解析は難しい。より正確な情報を得るためには、ガレクチン-3とそのリガンドが均一に分散している系での研究が必要である。
2012年にLefflerのグループは蛍光異方性アッセイ(Fluorescence anisotropy assay)という手法を用いて、可溶性のガレクチン-3のモデルリガンド糖タンパク質、アシアロフェツイン(Asialofetuin)存在下でのガレクチン-3の多量体の研究を詳細に行った43。例えば、アシアロフェツイン 20 µMの場合、ガレクチン-3が~30 µMの濃度以上で、糖鎖リガンドの数より多くのガレクチン-3がその結合に関与することが示された。このことから、N末非レクチン領域の多量体化よりもCBD同士の多量体化が、ガレクチン-3の多量体化に貢献するとLefflerらは示唆している。
残念ながら、以前の研究で明らかにされている協調的結合が起き、多量体が形成されるとされている比較的低い濃度(1~2 µM)で得られたデータは、横軸の濃度範囲が広いこともあり(0~150 µM)、グラフからは読み取れない。よって、生理的濃度でも、ガレクチン-3と可溶性リガンドの相互作用が、上記のような過剰なCBD凝集にまで至っているかは不明である。ガレクチン-3のCBDのみ、または糖結合を低下させた変異ガレクチン-3を使用した場合でも、ガレクチン-3より高い濃度(75~90 µM以上)ではあるが、同様の過剰なCBDの凝集が見られた。以上の結果から、Lefflerらは可溶性リガンドによるガレクチン-3の多量体化には、まず、核となる凝集形成があり、その後に、CBD同士の多量体化が起きるのではないかと推察している。
2014年にGuerlesquinのグループも、水溶液中での単量体のガレクチン-3 注5)やCBDの分子サイズが、ラクトース(Galβ1-4Glc)またはラクト-N-ネオテトラオース(LNnT:Galβ1-4GlcNAcβ1-3Galβ1-4Glc)存在下で変化するかを、動的光散乱法(Dynamic light scattering)という手法で調べた44。ガレクチン-3(37 µM)はLNnT低濃度(70 µM)下では、33%のレクチンの分子サイズが3.14 nmから4.64 nmに、LNnT高濃度(140 µM)下では91%が100 nm以上に増加することを見出した。これに対し、同じ条件下、CBDの分子サイズは単量体のままで全く変化しなかった。一方、ラクトース(8 mM)存在下では、ガレクチン-3もCBDも単量体のままであった。
注5)ここで使用されたガレクチン-3はHisタグがついたものである。通常ガレクチン-3の精製はラクトースカラムを使い、結合したレクチンをラクトースで押し出し、その後ラクトースを除くため、精製されたレクチンに糖が混ざっている可能性は少ない。Hisタグ添加のせいか、あるいは精製時に除かれなかった糖が混在しているせいかは不明であるが、Hisタグによる精製直後のガレクチン-3は67%が多量体と推定される大きさであったと報告している。そこで、彼らは、ガレクチン-3をさらに精製し、単量体のみを使用して多量体化の実験を行なっている。重要な点は、一度単量体に精製したものは安定であったということである。さらに、CBDの場合はHisタグ精製直後であってもほとんどが単量体であったので、精製直後に見られたガレクチン-3の多量体はHisタグに関係した多量化でなく、むしろ精製時に除かれなかった糖(例えば、大腸菌由来のリポ多糖)により既に多量体化していた可能性が考えられる。
上記実験では、Lefflerの報告と同様、非常に高い濃度のガレクチン-3を用いているが、この結果は、ガレクチン-3が、LNnTのように比較的親和性の高いリガンドが高濃度で存在した場合、非レクチン領域依存的に多量体化が起こることを示唆している。さらに、LNnT存在下でのガレクチン-3とCBDのNMRスペクトルを比較した時、ガレクチン-3のいくつかのピークが減少しているのに対し、そのような現象はラクトース下ではみられない。よって、このピークの減少がガレクチンの多量体化に関連しているのではないかと推察している。さらに、以前、NMR解析40, 45により推定されていた非レクチン部分が、CBDのF面、およびS面の糖結合部位近くに接触している可能性(図2A -ガレクチン-3)が、この新しいNMR解析でも確認された。これらの結果から、彼らは、ガレクチン-3は高親和性リガンドに結合することで、CBDに接触していた非レクチン部分が外れ、この部分がまず多量体化を誘導し、その結果、CBD同士の多量体化が進むのではないかと推察した。
その後、2016年に、Mayoのグループらの詳細なNMR解析から、天然変性領域内のPGAX(プロリン―グリシン―アラニン―任意のアミノ酸)の反復配列が続く領域が、CBDのF面に接触していることが示唆された46。さらに、2018年にGabiusとRomeroのグループは、天然変性領域9つのリピートの内CBD 付近の7から9番目までの3つの繰り返し領域のついたCBDの結晶化に成功し、上記NMR解析と同様、この繰り返し領域がCBDのF面に接触していることを確認している47。
さて、ガレクチン-3及び、そのCBDは溶液状態では単量体であり、さらに、ガレクチン-3のCBDのみの結晶体でも単量体である48。ここで結晶化された短い天然変性領域を持つガレクチン-3は四量体であった。この糖結合部分がチャネルのように見える四量体が、生化学的にどのような意味があるかは今後解明されて行くと期待されるが、多量体化の際、CBD同士が相互作用することを確認できた点は重要である。
最近(2022年)、膜上の糖脂質GM1とガレクチン-3の結合様式が、X線反射率法(X-ray reflectivity)によって解析された49。この報告によると、GM1に結合したガレクチン-3のCBDは、以前の解析37,44と同様、3~4 nmであった。さらに、非レクチン領域は膜から離れて外側に張り出しており、その長さは2 nm程度と推測された。この(解析)結果から推察すると、GM1に結合したガレクチン-3は、他の固定化した糖タンパク質との相互作用の研究から提唱されているような、CBDが積み重なって多量体化している像とは合致しない。興味深いことに、本来伸び切った状態では50 nm37あるはずの非レクチン領域が2 nmしかない。
このことは何を示しているのか?ガレクチン-3とGM1の結合が、膜に固定された糖タンパク質のように、協調的な結合を起こしているかは不明なので、GM1に結合したガレクチン-3が多量体化しているかはわからない。しかし、非レクチン領域は伸びた状態(50 nm)で多量体化すると仮定すれば37、この領域に当たる部分が伸びていない(2 nm)。ということは、この部分は多量体化していないことにならないか。推察に過ぎないが、リガンドが比較的小さなGM1のみの状態では、CBDは糖に結合していても、非レクチン領域がCBDから外れることができず(例えば図2B-2の状態)、よって結合したガレクチン-3の長さが短いとは考えられないか?更なる解析が必要である。
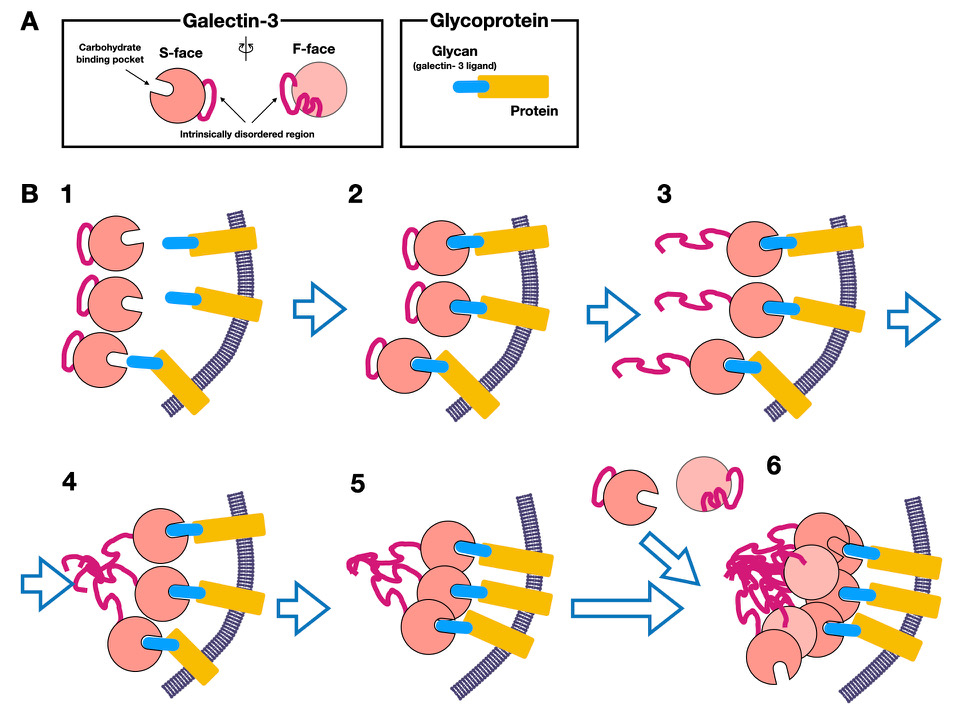
近年のガレクチン-3多量体化の研究は、より精密な分子機構に迫るために、生理的条件(膜上に固定された糖鎖に対して数µM以下のガレクチン-3を添加する条件)ではなく、あえて高濃度のガレクチン-3と水溶性リガンドとを用いた分析条件を設定している。また、すべての解析結果が必ずしも一致していない。2000年代に行われた、リガンドで固定された状態における解析結果と最近の解析の一致点を探ると、現時点で想定できるガレクチン-3の多量体化を、大筋として以下のようにまとめることができる(図 2B)
1)ガレクチン-3が膜上の特定のリガンド(例えば糖タンパク質)に結合する(図 2B-1, 2)ことで、CBDのF面に緩く結合していた非レクチン領域(天然変性領域)が外れる (図 2B-3)。
2)CBDからはずれた非レクチン領域内にある天然変性領域がまず多量体化し(図 2B-4)、その後に近接するCBDも多量体化することで、比較的小さな多量体(核となる凝集)が膜表面に集積する(図 2B-5)。
3)その後、CBD同士が多量体化することで、さらにガレクチン-3の多量体化が促進する(図 2B-6)。
4)この現象が協調的結合(Cooperative binding)の形成になり、それにより糖リガンドとの結合が安定する。
ただし、ここで熟考したいことは、最初の(核となる)凝集時に起こるCBDの多量体化現象(図 2B-3から5)と、糖に(おそらく)結合していないガレクチン-3が、糖リガンドに結合して核となった凝集に惹きつけられ結合し、さらに多量体化に加入する現象(図 2B-6の上部)が、果たして同じ分子機構で起きているかということである。想像するに、最初の現象はリガンドへの結合により誘導されたCBDの微妙な構造変化が関与しているのだろう。というのも、多量体化のほとんどの報告では、通常の条件では非レクチン領域を持たないCBD同士の結合は非常に稀であることから、この親和性は非常に低いと思われる。従って、最初のCBDの多量体形成に至るには、CBD同士が非常に近傍にあり、かつ天然変性領域の多量体化のような結合(LLPS誘導?)に支えられなければ困難なほど、このCBD同士の親和性は弱いのだろう。また、その後の凝集核に惹きつけられて起こる多量体への参画も、天然変性領域が何らかの形で関与していないだろうか?未解明な点が多い多量体化現象はガレクチン-3に固有の現象であるとともに、LLPS現象により起きている可能性がある。最後にこのLLPS現象について概説し、後編への橋渡しとしたい。
生物学的なLLPS 注6)とは、いくつかの生体高分子(タンパク質、RNA―そしておそらく糖鎖も)が弱い相互作用によって集まった状態で、均質に混じり合っているよりも二相に分離した方が安定な場合に“相”分離する現象である。ドレッシングはLLPSが目に見える身近な例である。ドレンシングには油と酢の他に、添加物として調味料や細かく刻んだ野菜などが入っている。これらの添加物は、それぞれの特性により油の相と酢の相に別れて分離する。さらにそれを混ぜても、しばらくすると小さな水溶性の液滴が形成され、油相から分かれ始め、やがて大きな液滴になっていく。
この例でもわかるように、LLPSが起きた場合、相がより安定なため液滴(ドロプレット)が形成される。この液滴は静電気、カチオン―π、π―πなどの相互作用で安定しており、内部には、構造を持たない天然変性タンパク質や、RNAのような多価イオンが多く含まれる。液滴は数多くの様々な「弱い相互作用」から成りたっているため、流動性があり、温度、pH、塩濃度、低分子(例えばATP)の微妙な変化によっても、急速に形成されたり溶解したりする。さらに、この液滴形成により、いくつかの生体高分子が液滴に非常に濃縮されることもあれば、ある特定の物質が液滴から排除されることもある。このLLPS現象により起こる分子の濃縮と排除により、例えば、特定の反応が効率的に進むことは容易に想像できるであろう。
注6)LLPSについて興味のある方は、白木健太郎氏による秀逸でなおかつ簡潔明瞭に書かれた解説本『相分離生物学』東京化学同人出版を読まれることをお薦めする。非常に根本的な(生化学的な)ことから応用まで広く網羅しているのが特徴であり、英語訳がまだ出ていないのが残念である。また、近年様々な分野においてのLLPSの総説が各科学雑誌に書かれているので詳しくはそれらを参照していただきたい。
さて、LLPS現象を起こすには天然変性タンパク質の存在が必要である50。通常タンパク質(例えば酵素やレクチンの多く)はリボソームからでてきたポリペプチドが折り畳まれ、三次または高次構造を持つことにより、特異的な活性や機能を持つ。これに対して、特定の構造を持たない(三次構造を持たない)領域が一定の長さ含まれるタンパク質がある。このような天然変性領域を持ったタンパク質が天然変性タンパク質である。興味深いことに、30残基以上の不規則な領域のある天然変性タンパク質の割合は、真正細菌ではわずか4.2%であるのに対して、真核細胞では33%にも及ぶ51。真核生物への進化に伴い天然変性タンパク質が増加しているのは、より複雑なシステムの効率化、精密化のためかもしれない。実際、転写因子、リン酸化酵素、核酸結合タンパク質、RNAポリメラーゼのように、転写・翻訳そしてシグナル伝達に関わるタンパク質の多くは、天然変性タンパク質である。
さて、ガレクチン家系の中で唯一つ、この天然変性領域を持つのがガレクチン-3である。おそらく、哺乳類のレクチンの中でこのように長い天然変性領域を持つレクチンはガレクチン-3だけだろう。後編で詳細に紹介するが、2015年にDennisが「ガレクチン-3はその多量体化により細胞膜上でLLPS現象を起こし、マイクロドメインを形成する」という仮説を提唱し、このLLPS現象を起こしたガレクチン-3が、以前から提唱されている細胞膜上に存在しているガレクチンラティスである可能性を論じた2。その後、2017年に台湾のHuangのグループが、試験管内でガレクチン-3の多量体化がLLPS現象を起こすことを初めて示した3。このガレクチン-3によるLLPS現象に関する報告はHuangのグループを含めまだ3報しかない3, 5, 6、いずれも、ガレクチン-3の多量体化の分子機構やさらに細胞内・細胞外と多岐にわたるガレクチン-3の機能との関連で示唆深い。
ここでLLPS現象について白木氏の著書52から引用したい。LLPSの生物学は『分子と構造から見た物質の化学ではなく、状態と相互作用から見た現象の化学である。生物学的相分離のためであるという回答(Answer)を先に出して、―――未解決のまま残していた問題(Question)を並べてみると次のようになる。何百も何千もある複雑な代謝がなぜ混戦せずに進むのか?―――多様な分子が高濃度含まれたような状態で、なぜ特定の反応が効率的に進むのか?構造を持たず機能もないはずの天然変性タンパク質がなぜたくさんあるのか?シグナル伝達はなぜ一旦情報が集約するような流れをするのか?』
このように、今後、LLPS現象が様々な生物学の分野でパラダイムシフトを起こすことになるであろう。実際、Science誌の2018年を代表する科学の一つにLLPSが選ばれているように、この分野は急速に発展している。
留意すべきこともある。現在のところ、ほとんどのLLPSの証明は生理学的に非常に高濃度(例えばmg/ml)の試料を使った試験管内の実験や、細胞内であっても高い濃度のタンパク質を強発現させた系をもとにしていることだ。物理化学の分野で発展してきたLLPSの現象であるため、これを細胞生物学に当てはめる場合の実験技術はまだ発展途上であり、必ずしも最適でない。
転写制御の第一人者であるRobert Tjianは、自らの研究経験から、まだLLPSが生理的条件で実際に起きているかを示唆できる技術が完成する前の状態であるとし、あまり軽々しくLLPSが関与していると言うべきではないと警鐘を鳴らしている53。むしろ、細胞内で観察された生体高分子が凝集している状態が、実際に流動的な液滴であるかが確認されるまでは『ハブ(hubs)』という概念でとりあえず置いておいた方がよいのではとさえ述べている。
LLPSを考えるとき慎重になる科学者が多いのは理解できる。だが、上述した種々の反応―シグナル伝達、転写諸々の膜のない空間で起きている事象―が実際にLLPSがらみだとしたらどうだろう?今まで用いられている実験系では、弱くてさもすれば曖昧な、さらに様々な高分子が関与するような相互作用を確実に検出することが難しいのがほとんどである。もしかすると、我々は、LLPSが関与する生物学的に重要な現象の多くを見逃してきてはいないだろうか。中には、全く異なる、あるいは間違った方向に導く結論を出してしまった場合もあるかもしれない。なぜなら、LLPSは微妙な温度差、塩濃度、pH他により、急激に分子の凝集度を変化させるからだ。
例えば、生体高分子の相互作用(Molecular interaction networks)を調べる場合、生化学的によく行われる免疫沈澱法や親和性に基づく精製法では、細胞を破壊し、低温でしかも希釈しさらに多くの場合、“非特異的な相互作用を防ぐため”に界面活性剤を入れた状態で行ってしまう。従って、LLPSで要になる弱い相互作用に依存する、タンパク質や分子の凝集はおそらく検出できないだろうし、また逆に、細胞内成分が混合されたために、生体内では実際には起こっていない、タンパク質同士の結合が逆に起きてしまう可能性もある。さらに、近年使われ始めた、出来るだけ細胞内のnativeな状態での相互作用を研究する近接依存性標識法(Proximity labelling 54)で、果たしてLLPS現象を検出できるのか?
もしこのような懸念が実際に起きていたとしたら、これまでに報告されたタンパクの相互関係情報をもとに蓄積されたinteractome、そしてそれをもとにして行われるsystems biology的な分析が果たしてどれくらい正確な情報を与えてくれるだろう?そのように考えると、今後、さまざまなinteractome情報は慎重に扱う必要がさらに増えるであろうし、今までに蓄積された実験結果に基づく『事実』も大きく変わっていく可能性がある。従って、LLPSの流行に左右されずに慎重に研究を進めていくことも大事だが、今までに積み上げたinteractome情報が、本当に細胞内の現象を映し出しているのかも、懐疑的な観点で見直す機会ではないだろうか。
ちなみに、ガレクチンの細胞外でのLLPSの可能性の探求は、細胞内のものより少しだけ早く進むかもしれない。なぜなら、誤解を恐れずに言えば、細胞外に生理的に可能な量のガレクチンを加えた研究をおこなうことは可能だからだ。細胞膜上に存在する糖タンパク質に結合するガレクチンラティス–『ハブ』がLLPS現象であるかどうかは、近未来に解明できるのではないか。たとえば、損傷したファゴソームやライソゾームをガレクチンが認識して引き起こすオートファジーとLLPSの関連も、同様な理由で比較的早い段階で明らかになるだろう。
後編では、ガレクチン-3によるLLPS現象がどのように起きているのか、この現象と様々な細胞内および細胞外のガレクチン-3の機能がどのような関連があるかを紹介していきたい。
原稿を注意深く読んでくださった岩城隼先生、および助言・編集をしてくださった平林淳先生に感謝します。