Oct 01, 2024
浦島 匡 / 石田 高志 / 片山 高嶺
氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年~2022年、帯広畜産大学教授。現在、名誉教授。日本糖鎖科学コンソーシアム幹事。
氏名:石田 高志
協和醗酵バイオ株式会社営業マーケティング部
2009年 東京工業大学大学院生命理工学研究科修士課程修了
2009年 協和発酵バイオ株式会社入社
2017年―2018年 食品素材の研究開発・法人営業・事業開発に従事
2018年―2024年 キリンホールディングス株式会社兼務、ヒトミルクオリゴ糖の事業開発に従事
2025年―現在 協和醗酵バイオ株式会社営業マーケティング部に所属
機能性食品成分の開発と応用に興味をもち、その社会実装に向け、アカデミック機関との連携に従事している。
氏名:片山 高嶺
京都大学大学院生命科学研究科教授
京都大学農学部食品工学科を卒業後、同大学院に進学し、熊谷英彦先生の下で学位を取得。応用微生物学分野を専門とする。同研究室で3年間博士研究員として在籍した後に、京都大学大学院生命科学研究科統合生命科学専攻・山本憲二教授研究室の助手に着任し、糖質関連酵素に関する研究をスタートさせる。ビフィズス菌がヒト由来の糖質に作用する酵素を有していることを見出し、ヒトと腸内細菌の共生に着目する。母乳栄養児におけるビフィズスフローラ形成機構の解明に貢献した。
1. はじめに
ヒトの母乳は平均して11.3グラム/リットルの濃度のヒトミルクオリゴ糖(HMOs)を含み、それは母乳の中でラクトース、脂質に次ぐ3番目の固形分である1。現在までに約200種類のHMOsが構造決定されているが、それらはシアル酸とフコースを除くコア骨格に基づいて、21のシリーズに分類される1(図 1)。代表的なHMOを図 2に示したが、HMOs中でこれらが大半を占め、他のHMOの濃度は痕跡程度にすぎない。母乳栄養児が母乳を摂取した後、大部分のHMOsは小腸で消化を受けずに大腸に到達し、そこで(1)有用性腸内細菌ビフィズス菌の増殖を刺激する、(2)病原性微生物による感染を防ぐ、(3)免疫能を調整する、(4)腸管バリア機能を強化し、壊死性腸炎を防御する、(5)乳児の脳神経系を活性化する、などの健康機能を発揮する。
少数のHMOsの工業生産が開始され、HMOsの健康機能性研究や健康状態と母乳におけるHMOsプロファイルの相関を研究するコホート研究の論文数が世界的に急増している。このミニレビューの中では日本におけるHMOs研究史を紹介するとともに、今後の課題について展望する。
 図 1. 21種のHMOsコア骨格構造(Urashimaら, BBA Advances, vol. 7, 2025, 100136より)
図 1. 21種のHMOsコア骨格構造(Urashimaら, BBA Advances, vol. 7, 2025, 100136より)
コア骨格に対して、フコースやN-アセチルノイラミン酸が付加し、HMOsが多様化する。
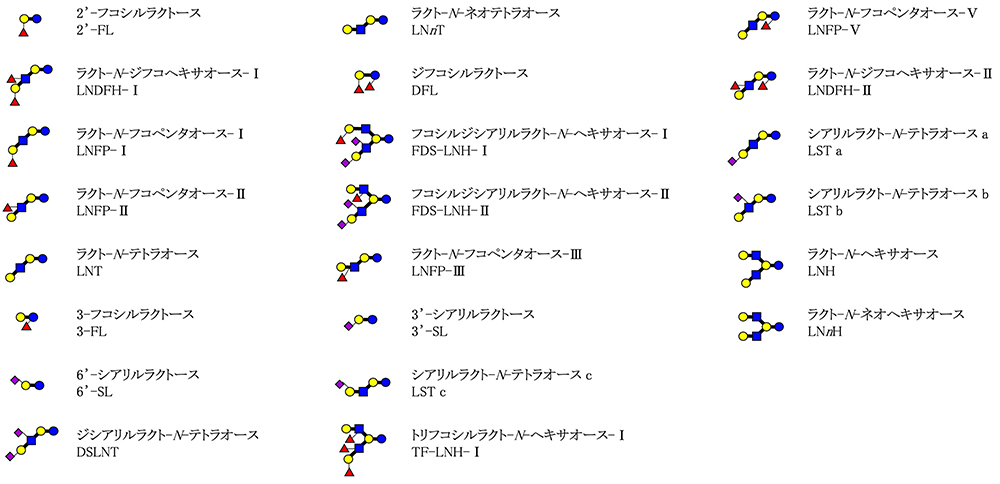 図 2. 代表的なHMOsの名称およびシンボル表記
図 2. 代表的なHMOsの名称およびシンボル表記
2. 世界でのHMOs研究のはじまり
世界でのHMOs研究は、乳児の腸管内で重要な健康機能性を発揮するビフィズス菌の増殖促進因子を探索する目的で開始された。1886年にEscherichは、母乳栄養児の生存に腸内細菌が重要な役割を果たしており、母乳の中の糖質がその増殖に関わっていることに言及した2。また1888年に、Eschbachはヒトの母乳とウシのミルクの糖質を研究し、ヒト乳には牛乳とは異なるタイプの糖質が含まれていることを発表した3。当時、母乳栄養児は製造されていた育児用調合乳を摂取した人工栄養児よりも死亡リスクが7倍低かったが、それは母乳の下痢性感染症などへの耐性のためであった3。1900年にTisserは、母乳栄養児と育児用調合乳を摂取した人工栄養児の腸内細菌叢を比較し4、Moroは1900年に、母乳栄養児の便にLactocbacillus bifidus(現在ビフィドバクテリウムに分類されている)が優勢であることを発見した5。1926年にSchönfeldは、ヒトの母乳の中にビフィズス菌の増殖を促進する成分のあることを発見した6。1930年代にPolonowskiとLespagnolは母乳の中にメタノール不溶性の糖質のあることを発見し、”gynolactose”と命名した7,8。PolonowskiとLespagnolは、Montreuilとともにgynolactoseを二次元ペーパークロマトグラフィーに供し、それは単一な成分ではなくて様々な成分による混合物であることを発見した9。
1950年代にKuhnはGyörgyとの共同研究から、母乳の中のビフィズス菌増殖因子の探索目的で、Polonowskiらによって発見されたgynolactoseを構成する成分の分離と構造解析を開始した10。1965年までにKuhnらを中心として、ラクト-N-テトラオース(Galβ1-3GlcNAcβ1-3Galβ1-4Glc, LNT)、ラクト-N-ネオテトラオース(Galβ1-4GlcNAcβ1-3Galβ1-4Glc, LNnT)や、ラクトースやそれらをコア骨格に含むフコシル、またシアリル誘導体が合計14種類構造決定された11。
3. 日本のHMOs研究のパイオニアー木幡 陽
日本でのHMOs研究史の概要は図 3と図 4に示す。日本でのHMOs研究は木幡 陽(神戸大学医学部、東京大学医科学研究所など)によって開始された。木幡は武田薬品株式会社に勤務していた当時、母乳には一定の濃度含まれるものの牛乳にはほとんど含まれていないヌクレオチド成分の探索を行ない、ヒト母乳にウジリン2リン酸(UDP)と2糖や3糖の共有結合したユニークな物質の含まれることを発見した。それらはGalβ1-4GlcNAcα1-UDPおよびFucα1-2Galβ1-4GlcNAcα1-UDPと構造決定された12,13。ミルクの中のオリゴ糖ヌクレオチドの発見は、少ないが他種のミルクの中でも例はある。Rosemanのグループは、ヤギ初乳にSiaα2-3(6)Galβ1-4GlcNAcα1-UDPおよびSiaα2-3(6)Galβ1-6GlcNAcα1-UDPを14、浦島のグループもトナカイのミルクにGalβ1-4GlcNAcα1-UDP15を、ヒツジの初乳にNeu5Gcα2-3Galβ1-4GlcNAcα1-UDPおよびNeu5Gcα2-6Galβ1-4GlcNAcα1-UDPを発見した16。一方で、これらは再現性をもってミルクや初乳に発見されないので、その生理的な意義は現在でも不明である。
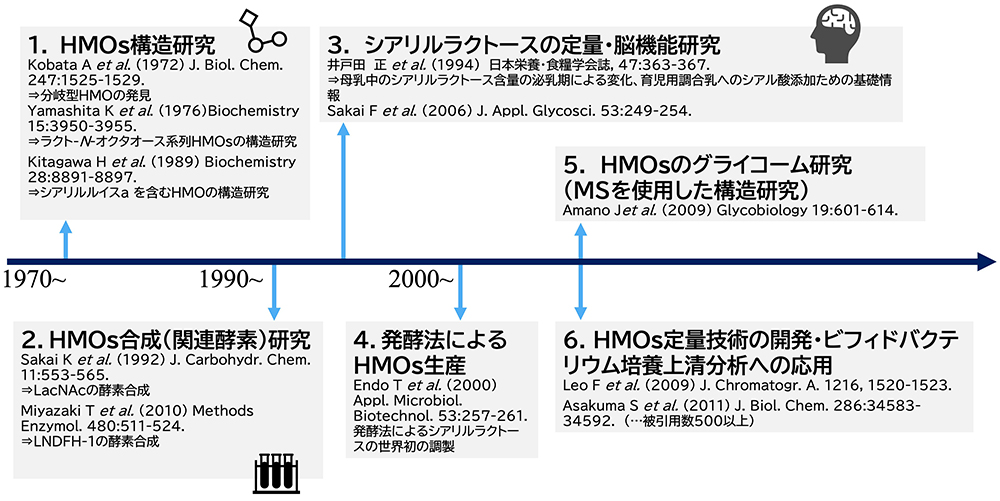 図 3. 日本におけるHMOs研究の経緯(1)
図 3. 日本におけるHMOs研究の経緯(1)
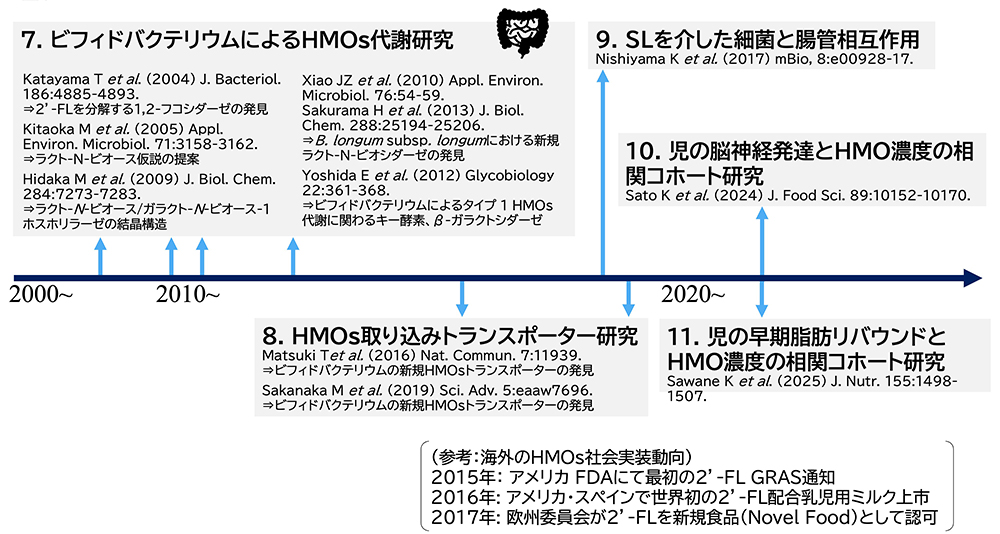 図 4. 日本におけるHMOs研究の経緯(2)
図 4. 日本におけるHMOs研究の経緯(2)
ヒト乳中のGalβ1-4GlcNAcα1-UDPおよびFucα1-2Galβ1-4GlcNAcα1-UDPの存在から、それをドナーにしてアクセプターとなる糖鎖にオリゴ糖部分を転移する酵素のあることが予想された。木幡はそのような糖転移酵素を発見する目的から、Györgyの研究室に留学し探索を試みたが、ヒト乳を材料として同酵素の活性は検出できなかった11,17。UDPオリゴ糖をドナーとして、オリゴ糖単位を転移する糖転移酵素は現在に至るまで発見されていない。木幡は代わりにA型またAB型のドナーの母乳を酵素源とし、2’-フコシルラクトース(Fucα1-2Galβ1-4Glc, 2’-FL)やラクト-N-フコペンタオース-Ⅰ(Fucα1-2Galβ1-3GlcNAcβ1-3Galβ1-4Glc, LNFP-Ⅰ)をアクセプター、UDP-GalNAcをドナーとして酵素反応を行い、A抗原[GalNAcα1-3(Fucα1-2)Gal]を含むオリゴ糖の生合成を証明した11,17。またB型あるいはAB型のドナーの母乳を酵素源とし、2’-FLやLNFP-Ⅰをアクセプター、UDP-Galをドナーとして酵素反応を行い、B抗原[Galα1-3(Fucα1-2)Gal]を含むオリゴ糖の生合成を証明した18,19。これらは、AまたB抗原の生合成系を証明した大変に評価の高い研究成果である。
木幡は上のように、糖転移酵素や糖加水分解酵素の研究に使用できる基質として利用する目的から、帰国後もヒト乳からのHMOsの分離と構造解析研究を継続して行った。日本におけるHMOs研究のはじまりである。1972年に初めて分岐型HMOとして、ラクト-N-ヘキサオース[Galβ1-3GlcNAcβ1-3(Galβ1-4GlcNAcβ1-6)Galβ1-4Glc, LNH]とラクト-N-ネオヘキサオース[Galβ1-4GlcNAcβ1-3(Galβ1-4GlcNAcβ1-6)Galβ1-4Glc, LNnH]を構造決定し20,21、ついで山下克子とともにそれらのフコシルまたシアリル誘導体や22,23、パラLNH24(直鎖型、図 1参照), パラLNnH24(直鎖型、図 1参照)、ラクト-N-オクタオース(LNO、分岐型、図 1参照)25,26、ラクト-N-ネオオクタオース(LNnO、分岐型、図 1参照)25,26をコア骨格とする多くのHMOsの構造決定を行った11,17。木幡以前に構造決定されたHMOsはラクトース、LNT、LNnTをコア骨格とする直鎖の6糖までであり、今日のような多様性をもったHMOsの構造情報の解析は、木幡らの研究が起点になったと言っても過言でない。
ヒトの母乳から分離、構造決定されたHMOsは、糖転移酵素や糖質分解酵素の基質特異性やガレクチンなどレクチンの糖鎖エピトープの解析にも活用されてきた。表 1に1980年代にスウェーデンにあった会社から、ヒト乳から分離されて標準品として市販されていたHMOsを示し、その中で木幡や山下によって構造決定された構造をハイライトした。今日、母乳を原料とする製品を市販することの倫理問題などもあって、このような試薬ビジネスは縮小気味である。しかしながら、それら標準品の活用がグライコバイオロジー研究の発展に果たした役割は大きく、木幡や山下の貢献は大きい。
表 1. 1980年代にヒト母乳から分離され、スウェーデンのBioCarb社から販売されているHMOs試薬
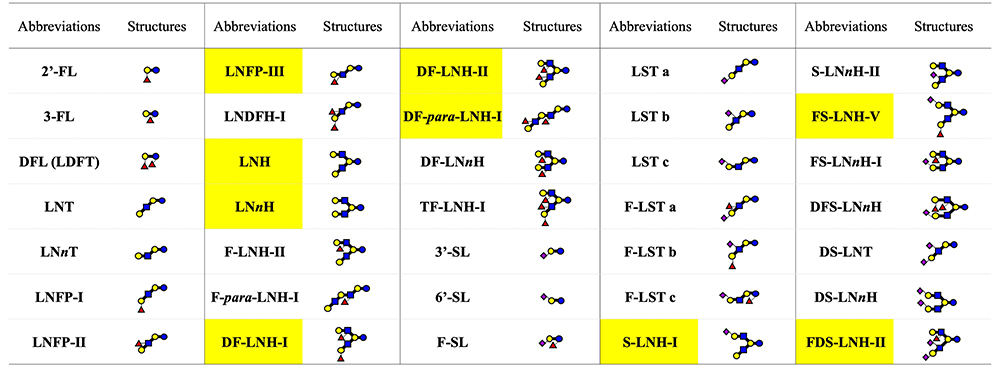
黄色塗りのHMOsは木幡・山下によって構造決定されたもの。
HMO, human milk oligosaccharide; FL, fucosyllactose; DFL, difucosyllactose; LDFT, lactodifucotetraose; LNT, lacto-N-tetraose; LNnT, lacto-N-neotetraose; LNFP, lacto-N-fucopentaose; LNDFH, lacto-N-difucohexaose; LNH, lacto-N-hexaose; LNnH, lacto-N-neohexaose; F-LNH, fucosyl lacto-N-hexaose ; DF-LNH, difucosyl lacto-N-hexaose ; DF-LNnH, difucosyl lacto-N-neohexaose; TF-LNH, trifucosyl lacto-N-hexaose; SL, sialyllactose; F-SL, fucosyl sialyllactose; LST, sialyllacto-N-tetraose; F-LST, fucosyl sialyllacto-N-tetraose ; S-LNH, sialyl lacto-N-hexaose ; S-LNnH, sialyl lacto-N-neohexaose; FS-LNH, fucosyl sialyl lacto-N-hexaose; FS-LNnH, fucosyl sialyl lacto-N-neohexaose; DFS-LNnH, difucosyl sialyl lacto-N-neohaxaose ; DSLNT, disialyllacto-N-tetraose; FDS-LNH, fucosyl disialyl lacto-N-hexaose
19世紀や20世紀の初めに市販されていた育児用調合乳を摂取した人工栄養児の腸内細菌叢の中でビフィドバクテリウムの占有率は低く、その原因として牛乳に含まれるミルクオリゴ糖と母乳中のHMOsの濃度の違いが明らかであった。人工栄養児の腸内細菌叢でビフィドバクテリウムの占有率をあげる目的から、ラクトースを原料として乳酸菌の生産するβ-ガラクトシダーゼによる転移反応を使用したガラクトオリゴ糖を調製し、代用乳に添加する開発が国内メーカーを中心として行われてきた。そのような技術によって開発されたガラクトオリゴ糖には、6’-ガラクトシルラクトース(Galβ1-6Galβ1-4Glc, 6’-GL)が含まれている。母乳にも6’-GLの含まれることが山下と木幡によって発見されていたので27、ガラクトオリゴ糖の調製・開発研究へのモチベーションになっていたことも間違いない。
4. 日本におけるHMOs構造研究のその後
木幡と山下の研究以降も、HMOsの構造解析研究は世界的に継続して行われ、現在までに約200種類のHMOsが構造決定された。それはコア骨格に基づいて21のシリーズに分類されている1。国内の研究では、1988~1993に京都大学の山科郁男研究室で行われた北川裕之(現在は神戸薬科大学)の一連の研究が注目される11。北川らは、ガン組織に対するモノクローナル抗体MSW113の糖鎖エピトープ構造を解析する目的で、MSW113を固定したアフィニティーカラムに母乳からの糖質画分を負荷し、吸着・溶出してきたHMOsの構造解析を行った。その結果、シアリルルイスa単位(Neu5Acα2-3Galβ1-3[Fucα1-4)]GlcNAc)を非還元末端側に含み、LNT、LNH、LNO、イソLNO(図 1参照)をコア骨格とする一連のHMOsが構造決定された11,28-30。
一方、天野純子ら(財団法人野口研究所)は、2009年に血液型A, Leb+のドナーの母乳を材料として、ラクト-N-デカオース(LND, 図1参照)またラクト-N-ネオデカオース(LNnD, 図 1参照)をコア骨格とする22のHMOsを構造決定した31。この研究で、著者はピレン誘導体化したHMOsの混合物を逆相系の高速液体クロマトグラフィー(HPLC)を用いて各HMOの分離を行い、 陰イオンモードでのMALDI-TOFMSを使用して構造決定した。現在、微量の試料を使用して分析可能なタンデム質量分析方法による構造解析が世界的にも主流になっているが、この研究はその先駆けということができる。
5. ミルクオリゴ糖の育児用調合乳への添加と母乳中のシアリルラクトースの定量研究
今日、組み換え微生物を使用し発酵法によって工業的に調製された少数のHMOs [2’-FL、3’-シアリルラクトース(Neu5Acα2-3Galβ1-4Glc、3’-SL)、6’-シアリルラクトース(Neu5Acα2-6Galβ1-4Glc, 6’-SL)、LNT、LNnTなど)が、海外での育児用調合乳に添加され市販されている。しかし、そのような製法によって調製されたHMOsの食品への利用は、国内では消費者庁による許可が得られていない。HMOsには重要な健康機能性が証明されているので、安全性の担保を前提として、実用的な使用が国内でも許可されることが望まれる。一方、HMOsにも含まれるシアリルラクトースを、乳児への脳神経系活性化機能を期待して育児用調合乳にはじめて添加したのは、日本の企業である。
脳には、ガングリオシドやポリシアリル糖タンパク質などシアル酸を含む成分が高濃度に含まれるが、母乳に含まれるシアリルオリゴ糖が母乳栄養児の脳のそれら成分の合成材料になることは予想されていた。実際にJacobiら(2016)は、ピッグレットに3’-SLまた6’-SLを21日間投与した後に、小脳のガングリオシド濃度は3’-SLの投与によって上昇し、脳梁のシアル酸濃度も3’-SLまた6’-SLの投与によって上昇することを報告している32。Muddら(2017)は、磁気共鳴イメージング装置を使用してシアリルラクトースを含む調合乳を摂取させたピッグレットに、濃度依存的ではないが、脳梁と左海馬の容積が拡大することを報告した33。
ヒト乳と育児用調合乳の原料になる牛乳にシアル酸濃度の差があることから、雪印乳業(現:雪印メグミルク株式会社)は、1990年代以降チーズホエーからシアリルラクトース(3’-SLと6’-SLの混合物)を分離し34、同社の育児用調合乳に添加、市販している。シアリルラクトースを育児用調合乳に添加するための学術的な基盤を証明するため、井戸田 正ら(1994)は2434名の日本人女性の出産後3日〜482日に回収した2279の母乳の、3’-SLと6’-SLの定量分析を行った35。また、酒井史彦ら(2006)は、シアリルラクトースを摂取させたラットの脳でガングリオシドとGM3(Neu5Acα2-3Galβ1-4Glc-Cer)の濃度の上昇と、モリス水泳迷路を使用した学習能力が高まる傾向のあることを発見した36。
チーズホエーから分離したシアリルラクトースを、低開発国において栄養障害をもつ乳児の栄養改善に利用しようという試みもある。ジェフリー・ゴードンのグループのCharbonneauら(2016)やCowardinら(2019)は、マラウィやバングラデッシュで栄養障害をもつ乳児の便から分離した腸内細菌を無菌ラットやピッグレットに移植し、チーズホエーから分離したシアリルオリゴ糖を摂取させたところ、それを含まないコントロール食を摂取させた動物よりも体重と骨密度が上昇することを観察した37,38。この取り組みには、上の雪印乳業による先駆的な取り組みとの関連性が予想される。
6. 組み換え細菌を使用した菌体反応法や発酵法によるHMOsの調製方法の開発
実用的には使用できないが、HMOsを少量のスケールで化学合成や糖加水分解酵素による逆合成、ならびに糖転移酵素によって合成する試みは行われている。鯵坂勝美(明治ヘルスサイエンス研究所、新潟薬科大学)のグループの宮崎は、N-アセチルグルコサミン転移酵素やフコース転移酵素、またβ-ガラクトシダーゼによる逆反応によって、ラクト-N-ジフコヘキサオース-Ⅰ(Fucα1-2Galβ1-3[Fucα1-4]GlcNAcβ1-3Galβ1-4Glc, LNDFH-Ⅰ)の合成を行った39。
今日、2’-FL、3-フコシルラクトース[Galβ1-4(Fucα1-3)Glc、3-FL]、3’-SL、6’-SL、LNnT、LNTなどの少数のHMOsが遺伝子組み換え細菌を使用して工業生産され、2’-FLやLNnTを含む育児用調合乳が海外50カ国以上で市販されている。国内では、高度精製品を除いて組み換え微生物によって工業生産された製品を食品添加物として利用することは、消費者庁による許可が出ていないので実用化されていないが、菌体反応法によるHMOsの調製方法を世界で初めて開発したのは日本の研究者である。
菌体反応法とは、細菌の菌体の中で酵素の組み合わせによって糖ヌクレオチドの供給を簡便に行ない、界面活性剤や有機溶剤によって物質透過性を高める方法である。併せて糖転移酵素を発現した細菌を、得られた糖ヌクレオチドとアクセプター糖とともに培養することによって、ターゲットとするHMOsを調製する。遠藤哲夫と小泉聡司ら(協和発酵バイオ)(2000)は、シチジン-1-リン酸(CMP)シアル酸合成酵素およびシチジン-3-リン酸(CTP)合成酵素を発現する組み換え大腸菌とCorynebacterium ammoniagenesを酵素源として用い、オロット酸とシアル酸を主原料にして、CMP-Neu5Acを蓄積させた40。ついで、CMP-Neu5Ac合成系にNeisseria gonorrhoeae由来のα2,3シアル酸転移酵素を発現する遺伝子を大腸菌に組み込んで3’-SLを生産させた40。これは、DSMやNovonesisなどの海外企業による取り組みよりも10年以上も早く、世界的にも先駆的な研究であった。
国内で使用許可が出ていないものの、協和発酵バイオ社(当時)は菌体反応法をさらに進めて糖ヌクレオチドの合成、再生と糖転移酵素の発現を同一菌体で行う発酵法を開発し、2’-FL、3’-SL、6’-SLの生産システムを構築した。3’-SLまた6’-SLの調製には、グルコースを原料としてN-アセチルノイラミン酸を生産するように遺伝子組み換えを行ったシアル酸生産性の大腸菌に、CMP-シアル酸合成酵素とシアル酸転移酵素の遺伝子を導入する生産系が開発されている41。2’-FLの調製は、グアニジン-2-リン酸(GDP)フコース生合成系の改良とフコース転移酵素遺伝子を導入した遺伝子組み換え大腸菌を使用して行われる。
7. ビフィドバクテリウムによるHMOs代謝経路の解明
乳児型ビフィズス菌4種(Bifidobacterium bifidum, B. longum subsp. infantis, B. longum subsp. longum and B. breve)によるHMOsの代謝研究は、半合成培地に唯一炭素源としてHMOsを添加して培養し、培養上清に残ったHMOsの濃度を測定することから開始された。そのためには、HMOsの定量方法の開発が重要である。母乳の中の各HMOの濃度を測定する研究は、現在では膨大な論文が発表されているが、高性能アニオン交換クロマトグラフィーを使用した定量方法などの開発が着手されたのは意外と遅く、2000年代以降である。浦島のグループは、ピリジルアミン(PA)や2-アミノ安息香酸(2-AA)による誘導体形成後、順相系によるHPLCによって母乳中の各HMOの定量分析を行っていたが42,43、2-AAによる誘導体を使用した分析方法を、HMOsとともに培養したビフィドバクテリウム培養物の培養上清の各残存HMOの定量分析に応用した44。朝隈貞樹(独立行政法人北海道農業研究センター)ら(2011)は、in vitroでの培養中に乳児型ビフィドバクテリウム4種がどのようにHMOsを利用するか探索するのにこの定量方法を使用し、B. bifidumやB. longum subsp. infantisは互いに異なる特徴的なHMOs消費パターンを有することを明らかにした44。これはビフィドバクテリウムによるHMOs代謝の先駆的な研究であり、現在までに500報以上の論文に引用されている。
HMOsが母乳栄養児の腸内で、ビフィドバクテリウムの増殖と定着を促すことは従来から知られていたが、それらによるHMOsの代謝経路が解明されたのは、2000年以降になってからである。乳児型ビフィドバクテリウム4菌種によるHMOsの代謝経路の解析は、日本の研究者による貢献が大きい。表 2には、これらの中で日本の研究者による研究成果を示した。B. bifidumでは、HMOsは菌体外酵素によって単糖や2糖に分解される。それは菌体外でシアリダーゼやフコシダーゼによってシアル酸やフコースを遊離し、ついでLNTなどタイプ1 HMOsからラクト-N-ビオシダーゼの働きでラクト-N-ビオース-I(Galβ1-3GlcNAc, LNB)を遊離する。これら菌体外酵素はいずれも京都大学の片山高嶺や芦田 久(現在は近畿大学)のグループによって、精製およびクローニングされた45-47。LNBはトランスポーターによって菌体内に取り込まれ、ラクト-N-ビオース(LNB)/ガラクト-N-ビオース(GNB)ホスホリラーゼによって、Gal-1-PとGlcNAcに変換される48。GlcNAcは、N-アセチルヘキソサミン 1-キナーゼやUDP-グルコース ヘキソース-1-リン酸ウルジルトランスフェラーゼによってUDP-GlcNAcに変換される49。このような菌体内代謝経路は、農研機構食品総合研究所の北岡本光(現在は新潟大学)のグループによって証明された。なお、LNBに対する菌体内代謝は、当初はBifidobacterium longum の菌株を対象にして研究されたが、その後、4種の乳児型ビフィドバクテリウムはいずれも同じ経路を所有することが示された。北岡と西本は、LNBを工業的に生産する技術の開発に成功しているので50、LNBがプレバイオティクスとして機能性食品に添加される可能性はある。一方、B. bifidumは菌体外代謝によって遊離された単糖のうち、Neu5AcやFucに対する代謝経路を持たない。朝隈らの研究では、B. bifidumを中性HMOsを唯一の炭素源として培養した時、消費されなかったFucやGalが培養上清に残存していた44。これらの単糖は、HMOsに対する代謝能の低いB. longum subsp. longumやB. breveによって利用されるので、腸管内でビフィドバクテリウム間のcross-feedingと共生が予想された。B. breveはNeu5Acを利用し増殖できるが、6’-SLを利用できない。西山啓太(現在は東北大学)と向井孝夫(北里大学獣医学部)は、B. breveはB. bifidumと混合培養したとき、6’-SLに対して良好な生育を示すが、B. bifidumのシアリダーゼ遺伝子ノックアウト株と培養すると、B. breveは増殖できないことを報告し51、シアル酸を介した2菌種のcross-feedingを証明した。片山グループの後藤は、帝王切開出生乳児や離乳後の児、また成人の便に、HMOsとB. bifidumを添加して培養すると、B. bifidum以外のビフィドバクテリウム種の数が上昇し、ビフィドバクテリウム間のcross-feedingを証明した52。
表 2. ビフィドバクテリウムによるHMOs代謝への日本の研究者による研究成果

HMO, human milk oligosaccharide; LNB, lacto-N-biose-I; GNB, galacto-N-biose
HMOsに対し高い資化性をもつB. longum subsp. infantisのHMOs代謝経路の解明には、カリフォルニア大学デービス校のデビット・ミルズのグループによる貢献が大きい。D.A. セラら(2008)は、ゲノムの中にHMOクラスターⅠと命名したトランスポーターとエキソグリコシダーゼの遺伝子の集まった大きな遺伝子クラスターのあることを発見したことから、同種はインタクトなHMOsをトランスポーターの働きで菌体内に取り組み、シアリダーゼ、フコシダーゼ、β-ガラクトシダーゼ、N-アセチルグルコサミニダーゼなどの菌体内エキソグリコシダーゼによって、非還元末端から順次単糖にまで加水分解する代謝経路の存在を証明した53。一方、HMO-1クラスター内にコードされるβ-ガラクトシダーゼは、ヒト乳においてN-アセチルラクトサミン(Galβ1-4Glc, LacNAc)をもつタイプ2 HMOsよりも優先的なLNBを含むタイプ1 HMOs(LNTなど)には加水分解能を持たないので、かれらの研究からはHMOsの代謝経路は完全には証明されなかった。片山グループの吉田らは、ゲノム内でHMO-1クラスターの外にある遺伝子から、異なる基質特異性をもったβ-ガラクトシダーゼをクローニングし、LNBやLNTを加水分解することを証明した54。この酵素は、Galβ1-3Galβ1-4Glc (3’-GL)やGalβ1-3Galβ1-3Galβ1-4Glc (3’,3”-DGL)を加水分解できるので、本来はGalβ1-3Galに対し基質特異性をもつ酵素の特異性がGalβ1-3GlcNAcにも広がったのかもしれない。この発見によって、母乳の中で優先的なタイプ1 HMOsに対するB. longum subsp. infantisの代謝能も含めて証明されたが、HMOクラスターⅠにコードされるトランスポーター群の特異性については詳細な解析は現在までにされていない。
朝隈らの研究では、B. longum subsp. longumはin vitro実験での増殖能は低く、LNTやLNFP-1など特定のHMOsのみを消費していることが示されていた44。同種によるLNTやLNFP-Ⅰの代謝能は、片山グループの桜間によるラクト-N-ビオシダーゼのクローニングによって証明された55。この酵素はB. bifidumのラクト-N-ビオシダーゼとは基質特異性が異なり、LNTだけでなく、そのフコシル、またシアリル誘導体であるLNFP-Ⅰやシアリルラクト-N-テトラオース a(Neu5Acα2-3Galβ1-3GlcNAcβ1-3Galβ1-4Glc, LST a)も基質とすることができる。加えてこの酵素の発現には、特異的なシャペロンタンパク質を必要とすることも注目される。
ビフィドバクテリウムによるHMOsの代謝経路を証明するには、HMOsを菌体内に取り込むトランスポーターの特異性を解析することも必要である。松木隆広(ヤクルト)らはフコシルラクトース(FL)に特異的なトランスポーターを同定した56。かれらは乳児の便から、HMOsを炭素源として増殖する14のビフィドバクテリウム株を分離し、その中でFLを含む培地で特異的に増殖する株を選抜した。ついでそれらのゲノムを解析して、FLの輸送に関与するらしい基質結合タンパク質の遺伝子が、フコシダーゼやパーミアーゼの遺伝子に隣接した位置に配置されていることを発見した。それをノックアウトしたB. breve株は、HMOsを含む培地での増殖速度が低かったので、同タンパク質はFLトランスポーター(FL-SBP)であることが証明された。一方、片山グループの阪中幹祥(現在は龍谷大学)は、B. longum subsp. infantisの株は2種のFL-SBPの遺伝子を含むことを発見し、FL1-SBPならびにFL2-SBPと命名した。さらにそのうちの片方ずつと両方の遺伝子をノックアウトした株を作成し、2’-FL, 3-FL, LNFP-1またジフコシルラクトース [Fucα1-2Galβ1-4(Fucα1-3)Glc, DFL] での増殖能を比較した57。FL1-SBPをノックアウトした株は、野生株よりも2’-FLまた3-FLを含む培地での増殖速度が低かった。一方、FL2-SBPをノックアウトした株は、野生株よりもLDFTとLNFP-1を含む培地での増殖速度が低下した。これらのことは、FL1-SBPの基質特異性はFL2-SBPとは重なるものの、各フコシルHMOsへの親和性は異なることを示している。継続した構造解析は特異性を決定するアミノ酸残基を明らかにした。
ビフィドバクテリウムによるHMOsの代謝に関わるGNB/LNB結合タンパク質や2菌種のラクト-N-ビオシダーゼ、GNB/LNBホスホリラーゼやGal-1-PやGlcNAcの代謝に関わる下流酵素の結晶構造は、伏信進矢(東京大学)のグループによって解析された58-63。
このように、乳児の腸内に棲息するビフィドバクテリウム4菌種は、HMOsに対して異なる代謝経路と代謝能を有しているが、腸内では共生している。片山グループの尾島は、HMOsを炭素源とするビフィドバクテリウムの混合培養実験において、先に接種した菌株がたとえHMO資化能の低い菌種であったとしても、cross-feedingの恩恵を受けて優先的に増殖するという先住効果を観察したが、それは共生と競争のメカニズムを探索するための重要なヒントを提供している64。
8. HMOsに対するコホート研究
2’-FL、3-FL、LNnT、LNT、3’-SL、6’-SLなどの少数のHMOsが工業レベルで製造されるようになってから、それらを使用してHMOsの機能をin vitroやin vivo研究で探索した研究論文数は、世界的に急増している。明らかになってきた機能は、病原性細菌・ウィルスへの感染防御、抗炎症性など免疫調整、未熟児に深刻な疾病である壊死性腸炎(NEC)の予防・治療、脳神経機能の活性化、栄養障害による低体重の改善などである1。残念ながら、日本からの研究論文は少ないが、食品機能研究への動物実験が制限されているためかもしれない。
また、2’-FL、2’FL+LNnT、また5HMOs(2’-FL、3’-SL、6’-SL、LNT、3-FL)を添加した育児用調合乳を人工栄養児に摂取させ、成長や便性を観察する介入研究も海外では実施されている65-68。
母乳におけるHMOsのプロファイルと母乳栄養児の壊死性腸炎や感染症の発症頻度との相関や、HMOsプロファイルと児の脳機能発達との相関を調査するコホート研究も実施されている。これらのコホート研究に対する国内での取り組みは遅れていたが、2024年に最初の後追いコホート研究の実施例が報告された。佐藤ら(株式会社明治)は、東北メディカル・メガバンク機構のコホート研究に参加した母子から、出産後1ヶ月の150の母乳に含まれる8HMOs {2’-FL、3-FL, 3’-SL、6’-SL、LST a、LST b(Galβ1-3[Neu5Acα2-6]GlcNAcβ1-3Galβ1-4Glc、シアリルラクト-N-テトラオース b)、LST c(Neu5Acα2-6Galβ1-4GlcNAcβ1-3Galβ1-4Glc、シアリルラクト-N-テトラオース c)、DSLNT(Neu5Acα2-3Galβ1-3[Neu5Acα2-6]GlcNAcβ1-3Galβ1-4Glc、ジシアリルラクト-N-テトラオース)}の濃度を定量するとともに、出生後1、5および9ヶ月で測定された頭周囲長の成長や認知機能の発達記録(コミュニケーションスキル、粗い動作スキル、よい動作スキル、問題解決能力とパーソナルソーシャルスキルを評価)と各HMO濃度の相関を調査した69。頭周囲の成長スコアは2’-FLおよびLST bの濃度と、神経の発達スコアは2’-FLの濃度と正に相関していた。また、参加者の中でドナーの母親が分泌型者の場合に限り、神経の発達スコアは3’-SLおよびDSLNTの濃度と正に相関していた。
同様のコホート研究は海外でも実施されている。Bergerらは、出産後1ヶ月に回収した母乳の2’-FL濃度は乳児の認知発達スコアと正に相関するが、6ヶ月に回収した母乳では相関しないことを報告した70。Oliverosらは、出産後1ヶ月に回収した母乳中の6’-SL濃度と6ヶ月および18ヶ月での乳児の認知ならびに動作スコアと正の相関を、2’-FL濃度と6ヶ月での動作スコアとの正の相関を報告した71。Choらは、母乳の中にA4糖(GalNAcα1-3[Fucα1-2]Galβ1-4Glc)の検出されるドナー(血液型A型者と予想される)の場合に限り、3’-SL濃度と聞き取り言語および発声言語のスコアに正の相関のあることを報告した72。Mansellらは、出産後6週間前後に回収した母乳において、2’-FL濃度が乳児の12ヶ月〜4歳での頭周囲の成長スコアと正に相関することを報告した73。Wejrydは、1000グラム以下で出生した低体重出生児の摂取する母乳に含まれる15HMOの濃度と2歳時での神経発達の相関について探索研究を行い、3-FL濃度と神経発達の損傷の低さと、またLST b濃度と高い認知スコアとの相関を観察した74。一方、LST a濃度は悪い神経発達や低い言語および動作スコアと相関していた74。
小児肥満を考える上で、脂肪リバウンド(AR)と言われる子供の肥満指数(BMI)が幼児期に一旦減少し、その後5~6歳頃に再び増加に転じる時点の現象が注目されている。5歳以前の早期ARは長期にわたる肥満や代謝障害の高いリスクと関係するが、それは母乳栄養によって影響を受けるかもしれない。澤根(江崎グリコ)と東北メディカル・メガバンク機構は、93の早期ARケースと91のコントロールからなる184の母子ペアを含むコホート研究において、分娩後1ヶ月で回収した母乳の中の15のHMOの濃度とAR状態との相関について調査した。分析は、母の分泌型また非分泌型によって階層化して行われた。その結果、HMOsのα-分散指標、トータルシアリルHMOs濃度と3’-SL濃度は、分泌型母から出生した児の早期ARと逆相関し、ARに関してLST a濃度と母の分泌状態との間で相互作用する傾向が観察された75。
このようなコホート研究の実施例は少ないので、日本人の場合も含めて実施例を増やしていく必要がある。上の結果の解釈には慎重さが必要なのは言うまでもなく、将来の仮説提出へのデータの一つに過ぎない。
9. 日本でのHMOs研究の今後への展望
HMOs研究の初期において、構造解析に対して木幡らや北川らによる研究が世界をリードしたことを紹介した。また、チーズホエーから分離したシアリルラクトースの育児用調合乳への添加は国内企業が世界に先行し、組み換え細菌を使用した3’-SLの菌体反応法による生産方法の開発は、国内企業の研究者がいち早く成功した。ビフィドバクテリウムによるHMOs代謝経路の解明は、片山や北岡らよる貢献が大きい。
一方、少数のHMOsが海外の多くの国では市販され、育児用調合乳に添加されているが、国内ではその商業的な使用はまだ許可されていない。国内でのHMOsの機能研究、コホート研究の実施例は海外よりもずっと少なく、介入研究は行われていない。
工業的に生産されたHMOsの商業ベースでの利用は、将来的に国内でも法規制対応が進み、海外と同様に育児用調合乳や食品用途での使用が可能になるかもしれない。今後はHMOsの実用的な利用のため、機能研究、臨床研究、介入研究、コホート研究への取り組みが求められる。200種類以上もあるHMOsの中で工業生産できるようになったHMOsは依然として少数であるので、より複雑な分子量の大きなHMOsの生産方法の開発も継続する課題である。
References
- Urashima T, Ajisaka K, Ujihara T, Nakazaki E (2025) Recent advances in the science of human milk oligosaccharides. BBA Adv. 7: 100136.
- Escherich T (1886) Die Darmbakterien des Säuglings und ihre Beziehungen zur Physiologie der Verdauung. Verlag von Ferdinand Enke, Stuttgart.
- Montreuil J (1992) The saga of human milk gynolactose. New Perspectives in Infant Nutrition, pp. 3-11, Georg Thieme Verlag, Stuttgart, New York.
- Tissier H (1900) Recherches sur la flore intestinale des nourrissons (état normal et pathologique). G. Carre and C. Naud, Paris, France.
- Moro E (1900) Über den Bacillus acidophilus n. spec. Ein Beitrag zur Kenntnis der normalen Darmbakterien des Saulings. Jahrbuch der Kinderheilkunde 52: 38-55.
- Sch<önfeld H (1926) Über die Beziehungen der einzelnen Bestandteile der Frauenmilch zur Bifidusflora. Jahrbuch der Kinderheilkunde 113: 19-60.
- Polonowski M, Lespagnol (1929) Sur la nature glucidique de la substance lévogyre du lait de femme. Bulletin de la Société De Chimie Biologique 101: 61-63.
- Polonowski M, Lespagnol A (1931) Sur deux nouveaux sucres du lait de femme, le gynolactose et l’allolactose. Comptes Rendu de l'Académie de Science 192: 1319.
- Polonowski M, Montreuil J (1954) Etudes chromatographique des polyosides du lait de Femme. Comptes Rendu de l’Academie de Science 238: 2263-2264.
- György P, Norris RF, Rose CS (1954) Bifidus factor. I. A: a variant of Lactobacillus biifidus requiring a special growth factor. Arch. Biochem. Biophys. 48: 193-201.
- Kobata A (2017) Structures, classification, and biosynthesis of human milk oligosaccharides. In Prebiotics and Probiotics in Human Milk (McGuire M, MacGuire MA, Bode L eds.), pp. 17-44, London, San Diego, Cambridge, Oxford, Academic Press.
- Kobata A. (1963) The acid-soluble nucleotides of milk. II. Isolation and identification of two novel uridine nucleotide oligosaccharide conjugates from human milk and colostrum. J. Biochem. Tokyo. 53: 167-175.
- Kobata A (1966) The acid-soluble nucleotides of milk. IV. The chemical structure of UDP-X3. J. Biochem. 59: 63-66.
- Jourdian GW, Shimizu F, Roseman S (1961) Isolation of nucleotide – oligosaccharides containing sialic acid. Fed. Proc. 20: 161.
- Taufik E, Ganzorig K, Nansalmaa M, Fukuda R, Fukuda K, Saito T, Urashima T (2014) Chemical characterization of saccharides in the milk of a reindeer (Rangifer tarandus tarandus). Int. Dairy J. 34: 104-108.
- Sasaki M, Nakamura T, Hirayama K, Fukuda K, Saito T, Urashima T, Asakuma S (2016) Characterization of two novel sialyl N-acetyllactosaminyl nucleotides separated from ovine colostrum. Glycoconj. J. 33: 789-796.
- Kobata A (2010) Structures and application of oligosaccharides in human milk. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. 86; 731-747.
- Kobata A, Grollman EF, Ginsburg V (1968a) An enzymatic basis for blood type A in humans. Arch. Biochem. Biophys. 124: 609-612.
- Kobata A, Grollmen EF, Ginsburg V (1968b) An enzymatic basis for blood type B in humans. Biochem. Biophys. Res. Commun. 32: 272-277.
- Kobata A, Ginsburg V (1972a) Oligosaccharides of human milk. 3. Isolation and characterization of a new hexasaccharide, lacto-N-hexaose. J. Biol. Chem. 247: 1525-1529.
- Kobata A, Ginsburg V (1972b) Oligosaccharides of human milk. IV. Isolation and characterization of a new hexasaccharide, lacto-N-neohexaose. Arch. Biochem. Biophys. 150: 273-281.
- Yamashita K, Tachibana Y, Kobata A. (1977a) Oligosaccharides of human milk; structures of three lacto-N-hexaose derivatives with H-haptenic structures. Arch. Biochem. Biophys. 182: 546-555.
- Yamashita K, Tachibana Y, Kobata A (1976a) Oligosaccharides of human milk: Isolation and characterization of three new disialylfucosylhexasaccharides. Arch. Biochem. Biophys. 174: 582-591.
- Yamashita K, Tachibana Y, Kobata A (1977b) Oligosaccharides of human milk. Structural studies of two new octasaccharides, difucoayl derivatives of para-lacto-N-hexaose and para-lacto-N-neohexaose. J. Biol. Chem. 252: 5408-5411.
- Yamashita K, Tachibana Y, Kobata A (1976b) Oligosaccharides of human milk: isolation and characterization of two new nonasaccharides, monofucosyllacto-N-octaose and monofucosyllacto-N-neooctaose. Biochemistry 15: 3950-3955.
- Tachibana Y, Yamashita K, Kobata A (1978) Oligosaccharides of human milk: Structural studies of di- and trifucosyl derivatives of lacto-N-octaose and lacto-N-neooctaose. Arch. Biochem. Biophys. 188: 83-89.
- Yamashita K, Kobata A (1974) Oligosaccharides of human milk: V. Isolation and characterization of a new trisaccharide, 6’-galactosyllactose. Arch. Biochem. Biophys. 161: 164-170.
- Kitagawa H, Nakada H, Numata Y, Kurosaka A, Fukui S, Funakoshi I, Kawasaki T, Shimada K, Inagaki F, Yamashina I (1988) Immunoaffinity isolation of a sialyl-Le(a) oligosaccharides from human milk. J. Biochem. 104: 591-594.
- Kitagawa H, Takaoka M, Nakada H, Fukui S, Funakoshi I, Kawasaki T, Tate S, Inagaki F, Yamashina I (1991) Isolation and structural studies of human milk oligosaccharides that are reactive with a monoclonal antibody MSW 113. J. Biochem. 110: 598-604.
- Kitagawa H, Nakada H, Fukui S, Funakoshi I, Kawasaki T, Yamashina I, Tate S, Inagaki F. (1993) Novel oligosaccharides with the sialyl-Le(a) structure in human milk. J. Biochem. 114: 504-508.
- Amano J, Osanai M, Orita T, Sugahara D, Osumi K (2009) Structural determination by negative-ion MALDI-QIT-TOFMS after pyrene derivatization of variously fucosylated oligosaccharides with branched decaose cores from human milk. Glycobiology 19: 601-614.
- Jacobi SK, Yatsunenko T, Li D, Dasgupta S, Yu RK, Berg BM, Chichlowski M, Odle J (2016) Dietary isomers of sialyllactose increase ganglioside sialic acid concentrations in the corpus callosum and cerebellum and modulate the colonic microbiota of formula-fed piglets. J. Nutr. 146: 200-208.
- Mudd AT, Fleming SA, Labhart B, Chichlowski M, Berg BM, Donovan SM, Dilger RN (2017) Dietary sialyllactose influences sialic acid concentrations in the prefrontal cortex and magnetic resonance imaging measures in corpus callosum of young pigs. Nutrients 9: 1297.
- Deya E, Ikeuchi Y, Yoshida H, Hiraoka Y, Uchida Y, Inventor, High purity sialic acid and process for the preparation there of. Japan. Patent Patent 07-103139, 1995.
- Idota T, Matsuoka Y, Nakano T, Kawakami H, Nakajima I (1994) Changes in the sialyllactose content of human milk during lactation. J. Jpn. Soc. Nutr. Food Sci. 47: 363-367
- Sakai F, Ikeuchi Y, Urashima T, Fujihara M, Ohtsuki K, Yanahira S (2006) Effects of feeding sialyllactose and galactosylated N-acetylneuraminic acid on swimming learning ability and brain lipid composition in adult rats. J. Appl. Glycosci., 53: 249-254.
- Charbonneau MR, O’Donnell D, Blanton LV, Totten SM, Davis JCC, Barratt MJ, Cheng J, Guruge J, Talcott M, Bain JR, Muehlbauer MJ, Ilkayeva O, Wu C, Struckmeyer CT, Barille D, Mangani C, Jorgensen J, Fan YM, Maleta K, Dewey KG, Ashorn P, Newgard CB, Lebrilla C, Mills DA, Gordon JI (2016) Sialylated milk oligosaccharides promote microbiota-dependent growth in models of infant undernutrition. Cell 164: 859-871.
- Cowardin CA, Ahern PP, Kung VL, Hibberd MC, Cheng J, Guruge JL, Sundaresan V, Head RD, Barille D, Mills DA, Barratt MJ, Huq S, Ahmed T, Gordon JI (2019) Mechanisms by which sialylated milk oligosaccharides impact biology in a gnotobiotic mouse model of infant undernutrition. Proc. Natl. Acad. Sci. U.S.A. 116: 11988-11996.
- Miyazaki T, Sato T, Furukawa K, Ajisaka K (2010) Enzymatic synthesis of lacto-N-difucohexaose I which binds to Helicobacter pylori. Methods Enzymol. 480:511-524.
- Endo T, Koizumi S, Tabata K, Ozaki A (2000) Large-scale production of CMP-NeuAc and sialylated oligosaccharides through bacterial coupling. Appl. Microbiol. Biotechnol. 53: 257-261.
- Ujihara T, Yamamoto H, Tabata K. inventor, Kyowa Hakko Bio C., Ltd, assignee. Method for manufacturing N-acetylneuraminic acid and sugar containing N-acetylneuraminic acid, World patent WO2015037698, 2015 Mar 19, https://patentscope.wipo.int/search/en/WO2015037698.
- Asakuma S, Urashima T, Akahori M, Obayashi H, Nakamura T, Kimura K, Watanabe Y, Arai I, Sanai S (2008) Variation of major neutral oligosaccharides levels in human colostrum. Eur. J. Clin. Nutr. 62: 488-494.
- Leo F, Asakuma S, Nakamura, T, Fukuda K, Senda A, Urashima T (2009) Improved determination of milk oligosaccharides using a single derivatization with anthranilic acid and separation by reversed-phase high-performance liquid chromatography. J. Chromatogr. A. 1216: 1520-1523.
- Asakuma S, Hatakeyama E, Urashima T, Yoshida E, Katayama T, Yamamoto K, Kumagai H, Ashida H, Hirose J, Kitaoka M (2011) Physiology of consumption of human milk oligosaccharides by infant gut-associated bifidobacteria. J. Biol. Chem. 286: 34583-34592.
- Ashida H, Miyake A, Kiyohara M, Wada J, Yoshida E, Kumagai H, Katayama T, Yamamoto K (2009) Two distinct alpha-L-fucosidases from Bifidobacterium bifidum are essential for the utilization of fucosylated milk oligosaccharides and glycoconjugates. 19: 1010-1017.
- Kiyohara M, Tanigawa K, Chaiwangsri T, Katayama T, Ashida H, Yamamoto K (2011) An exo-α-sialidase from bifidobacteria involved in the degradation of sialyloligosaccharides in human milk and intestinal glycoconjugates. Glycobiology 21: 437-447
- Wada J, Ando T, Kiyohara M, Ashida H, Kitaoka M, Yamaguchi M, Kumagai H, Katayama T, Yamamoto K (2008) Bifidobacterium bifidum lacto-N-biosidase, a critical enzyme for the degradation of human milk oligosaccharides with a type-1 structure.74: 3996-4004.
- Kitaoka M, Tian J, Nishimoto M (2005) Novel putative galactose operon involving lacto-N-biose phosphorylase in Bifidobacterium longum. Appl. Environ. Microbiol. 71: 3158-3162.
- Nishimoto M, Kitaoka M (2007) Identification of N-acetylhaxosamine 1-kinase in the complete lacto-N-biose I /galacto-N-biose metabolic pathway in Bifidobacterium longum. Appl. Environ. Microbiol. 73: 6444-6449.
- Nishimoto M, Kitaoka M (2007) Practical preparation of lacto-N-biose I, a candidate for the bifidus factor in human milk. Biosci. Biotechnol. Biochem. 71: 2101-2104
- Nishiyama K, Nagai A, Uribayashi K, Yamamoto Y, Mukai T, Okada N (2018) Two extracellular sialidases from Bifidobacterium bifidum promote the degradation of sialyl-oligosaccharides and support the growth of Bifidobacterium breve. Anaerobe 52: 22-28.
- Gotoh A, Katoh T, Sakanaka M, Liing Y, Yamada C, Asakuma A, Urashima T, Tomabechi Y, Katayama-Ikegami A, Kurihara S, Yamamoto K, Harata G, He F, Hirose J, Kitaoka M, Okuda S, Katayama T (2018) Sharing of human milk oligosaccharides degradants within bifidobacterial communities in faecal cultures supplemented with Bifidobacterium bifidum. Sci. Rep. 8: 13958-13971.
- Sela DA, Chapman J, Adeuya A, Kim JH, Chen F, Whitehead TR, Lapidus A, Rokhsar DS, Lebrilla CB, German JB, Price NP, Richardson PM, Mills DA (2008) The genome sequence of Bifidobacterium longum subsp. infantis reveals adaptations for milk utilization within the infant microbiome. Proc. Natl. Acad. Sci. U.S.A. 105: 18964-18969.
- Yoshida E, Sakurama H, Kiyohara M, Nakajima M, Kitaoka M, Ashida H, Hirose J, Katayama T, Yamamoto K, Kumagai H (2012) Bifidobacterium longum subsp. infantis uses two different b-galactosidases for selectively degrading type-1 and type-2 human milk oligosaccharides. Glycobiology 22: 361-368.
- Sakurama H, Kiyohara M, Wada J, Honda Y, Yamaguchi M, Fukiya S, Yokota A, Ashida H, Kumagai H, Kitaoka M, Yamamoto K, Katayama T (2013) Lacto-N-biosidase encoded by a novel gene of Bifidobacterium longum subspecies longum shows unique substrate specificity and requires a designated chaperone for its active expression.J. Biol. Chem. 288: 25194-25206.
- Matsuki T, Yahagi K, Mori H, Matsumoto H, Hara T, Tajima S, Ogawa E, Kodama H, Yamamoto K, Yamada T, Matsumoto S, Kurosaka K (2016) A key genetic factor for fucosyllactose utilization affects infant gut microbiota development. Nat. Commun. 7: 11939.
- Sakanaka M, Hansen ME, Gotoh A, Katoh T, Yoshida K, Odamaki T, Yachi H, Sugiyama Y, Kurihara S, Hirose J, Urashima T, Xiao J,Z Kitaoka M, Fukiya S, Yokota A, Lo Leggio, L, Hachem MA, Katayama T. (2019) Evolutionary adaptation in fucosyllactose uptake systems supports bifidobacteria-infant symbiosis. Sci. Adv. 5: eaaw7696.
- Suzuki R, Wada J, Katayama T, Fushinobu S, Wakagi T, Shoun H, Sugimoto H, Tanaka A, Kumagai H, Ashida H, Kitaoka M, Yamamoto K (2008) Structural and thermodynamic analyses of solute-binding protein from Bifidobacterium longum specific for core 1 disaccharide and lacto-N-biose I. J. Biol. Chem. 283: 13165-13173.
- Hidaka M, Nishimoto M, Kitaoka M, Wakagi T, Shoun H, Fushinobu S (2009) The crystal structure of galacto-N-biose/lacto-N-biose I phosphorylase: a large deformation of a TIM barrel scaffold. J. Biol. Chem. 284: 7273-7283.
- Nam YW, Nishimoto M, Arakawa T, Kitaoka M, Fushinobu S (2019) Structural basis for broad substrate specificity of UDP-glucose 4-epimerase in the human milk oligosaccharide catabolic pathway of Bifidobacterium longum. Sci. Rep. 9:11081.
- Sato M, Arakawa T, Nam YW, Nishimoto M, Kitaoka M, Fushinobu S (2015) Open-close structural change upon ligand binding and two magnesium ions required for the catalysis of N-acetylhexosamine 1-kinase. Biochim Biophys Acta 1854: 330-340.
- Ito T, Katayama T, Hattie M, Sakurama H, Wada J, Suzuki R, Ashida H, Wakagi T, Yamamoto K, Stubbs KA, Fushinobu S (2013) Crystal structures of a glycoside hydrolase family 20 lacto-N-biosidase from Bifidobacterium bifidum. J. Biol. Chem. 288: 11795-11806.
- Yamada C, Gotoh A, Sakanaka M, Hattie M, Stubbs KA, Katayama-Ikegami A, Hirose J, Kurihara S, Arakawa T, Kitaoka M, Okuda S, Katayama T, Fushinobu S (2017) Molecular insight into evolution of symbiosis between breast-fed infants and a member of the human gut microbiome Bifidobacterium longum. Cell. Chem. Biol. 24: 515-524.
- Ojima MN, Jiang L, Arzamasov AA, Yoshida K, Odamaki T, Xiao J, Nakajima A, Kitaoka M, Hirose J, Urashima T, Katoh T, Gotoh A, van Sinderen D, Rodionov DA, Osterman AL, Sakanaka M, Katayama T (2022) Priority effects shape the structure of infant-type Bifidobacterium communities on human milk oligosaccharides. ISME J. 16: 2265-2279.
- Marriage BJ, BuckRH, Goehring KC, Oliver JS, Williams JA (2015) Infants fed a lower calorie formula with 2’FL show growth and 2’FL uptake like breast-fed infants. J. Pediatr. Gastroenterol. Nutr. 61: 649-658.
- Puccio G, Alliet P, Cajozzo C, Janssens E, Corsello G, Sprenger N, Wernimont S, Egli D, Gosoniu L, Sttenhout P (2017) Effects of infant formula with human milk oligosaccharides on growth and morbidity: a randomized multicenter trial. J. Pediatr. Gastroenterol. Nutr. 64: 624-631.
- Dogra SK, Martin FP, Donnicola D, Julita M, Berger B, Sprenger N (2021) Human milk oligosaccharide-stimulated Bifidobacterium species contribute to prevent later respiratory tract infections. Microorganisms 9: 1939.
- Parschat K. Melsaether C, Nutrients 13: 2871.
- Sato K, Nakamura Y, Fujiyama K, Ohneda K, Nobikuni T, Ogishima S, Mizuno S, Koshiba S, Kuriyama S, Jinno S (2024) Absolute quantification of eight human milk oligosaccharides in breast milk to evaluate their concentration profiles and associations with infants’ neurodevelopmental outcomes. J. Food Sci. 89: 10152-10170.
- Berger PK, Plows JF, Jones RB, Alderete TL, Yonemitsu C, Poulsen M, Ryoo JH, Peterson BS, Bode L, Goran MI (2020) Human milk oligosaccharide 2’-fucosyllactose links feeding at 1 month to cognitive development at 24 months in infants of normal and overweight mothers. PLoS One 15: e0228323.
- Oliveros E, Martín MJ, Torres-Espínola FJ, Segura-Moreno T, Ramírez M, Santos A, Buck R, Rueda R, Escudero M, Catena A, Azaryah H, Campoy C (2021) Human milk levels of 2’-fucosyllactose and 6’-sialyllactose are positively associated with infant neurodevelopment and are not impacted by maternal BMI or diabetic status. J. Nutr. Food Sci. 4: 024.
- Cho S, Zhu Z, Li T, Baluyot K, Howell BR, Hazlett HC, Elison JT, Hauser J, Sprenger N, Wu D, Lin W (2021) Human milk 3’-sialyllactose is positively associated with language development during infancy. Am. J. Clin. Nutr. 114: 588-597.
- Mansell T, Furst A, O’Hely M, Chang M, Ponsonby AL, Vuillermin P, Tang M, Burgner D, Saffery R, Bode L (2023) Age-dependent association of human milk oligosaccharides with body size and composition up to 4 years of age. Am. J. Clin. Nutr. 117: 930-945.
- Wejryd E, Jern EF, Marchini G, Åden U, Landberg E, Abrahamsson T (2025) Human milk oligosaccharides in breast milk at two weeks of age in relation to neurodevelopment in 2-year-old children born extremely preterm: an explorative trial. Nutrients 17, 832.
- Sawane K, Takahashi I, Ishikuro M, Takumi H, Orui M, Noda A, Shinoda G, Ohseto H, Onuma T, Ueno F, Murakami K, Higuchi N, Tanaka T, Furuyashiki T, Nakamura T, Koshiba S, Ohneda K, Kumada K, Ogishima S, Hozawa A, Sugawara J, Kuriyama S, Obara T (2025) Association between human milk oligosaccharides and early adiposity rebound in children: a case-control study of the Tohoku Medical Megabank project birth and three-generation cohort study. J. Nutr. 155: 1498-1507.








