 |
O-マンノース(Man)型糖鎖はタンパク質のセリン(Ser)あるいはスレオニン(Thr)の水酸基にManを介して結合する糖鎖である(1)。根元のManとN-アセチルグルコサミン(GlcNAc)の結合様式により、GlcNAcβ1-2Man(コアM1)、GlcNAcβ1-2(GlcNAcβ1-6)Man(コアM2)、N-アセチルガラクトサミン(GalNAc)β1-3GlcNAcβ1-4Man(コアM3)、の3グループに分類される(図 1)。コアM1とコアM2には他のO型やN型糖鎖にみられる多様な構造が修飾される。一方、コアM3には2個のリビトール-5-リン酸(Rbo5P)がホスホジエステル結合で修飾され、さらに“マトリグリカン”と呼ばれるグルクロン酸(GlcA)とキシロース(Xyl)の2糖の繰り返し構造が伸長する。コアM3糖鎖は、ラミニンなどの細胞外マトリックス分子の細胞表面レセプターとして知られるα-ジストログリカンの糖鎖として発見された。マトリグリカンは、ラミニンとα-ジストログリカンの結合に必要であり、骨格筋の維持と脳の発生に関与するジストロフィン-糖タンパク質複合体の形成に寄与する。コアM3糖鎖の異常によりラミニンとα-ジストログリカンが結合できないと、α-ジストログリカノパチーと総称される先天性筋ジストロフィー症の原因となる(金川基「糖鎖異常型筋ジストロフィー(ジストログリカン異常症)の病態と治療法」を参照)。
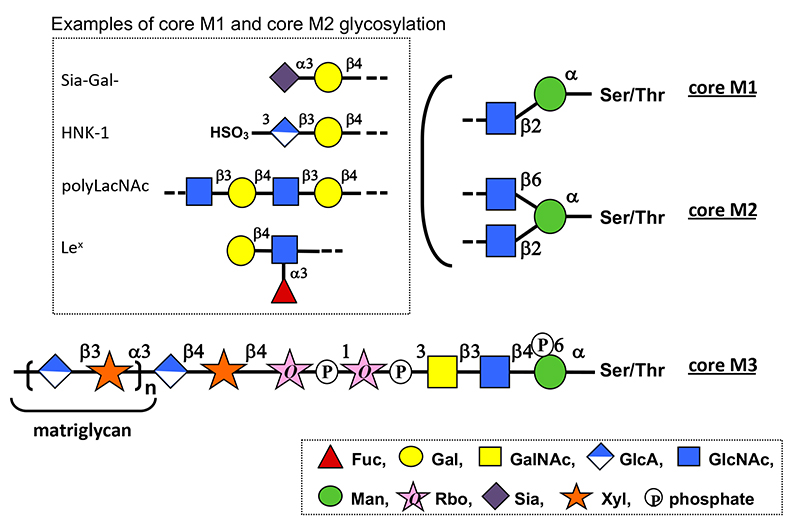
図 1. O-Man型糖鎖の構造
|
O-Man型糖鎖の生合成(図 2)(1-8)の開始酵素はO-Man転移酵素(POMT1とPOMT2のヘテロ複合体)であり、小胞体(ER)でドリコールリン酸マンノース(Dol-P-Man)からSer/ThrにManを転移する。O-Man修飾に続き、ERにおいてPOMGNT2によりコアM1/コアM2糖鎖の生合成に進むか、コアM3糖鎖の生合成に進むかの選別が行われる。POMGNT2によりManにβ1-4結合でGlcNAcが転移されるとコアM3糖鎖の生合成に進む。一方、POMGNT2がGlcNAcを転移しなかったManはゴルジ体に移行した後でPOMGNT1によりβ1-2結合でGlcNAcが転移されてコアM1となる。脳の場合は、MGAT5B (別名GnT-IX)によりコアM1のManにβ1-6結合でGlcNAcが転移されてコアM2も形成される。コアM1/コアM2の非還元末端側の生合成は他のO型やN型糖鎖と同様の機構が想定されている。
POMGNT2によりGlcNAcβ1-4Manが形成されてコアM3糖鎖が修飾される部位として、α-ジストログリカンの316、318、372番目のThrが報告されている。GlcNAcβ1-4Manが形成されると、B3GALNT2によりGlcNAcにGalNAcがβ1-3結合で転移され、さらにPOMKによってManの6位がリン酸化される。Manリン酸化はFKTNとFKRPによるRbo5P転移反応においてアクセプター基質となるコアM3に結合するために必要となる(1, 2)。POMKによるリン酸化の後はゴルジ体に移行して、FKTNにより1つ目のRbo5PがGalNAcの3位にホスホジエステル結合で転移される。細胞内におけるFKTNのRbo5P転移にはPOMGNT1との複合体形成が必要となる。POMGNT1はレクチンドメインと触媒ドメインをもっており、触媒ドメインはβ1-2GlcNAc転移酵素としてコアM1の合成を担うが、レクチンドメインにはコアM3のGalNAcβ1-3GlcNAcと結合することでFKTNをコアM3にリクルートするはたらきがある。FKRP は2つ目のRbo5Pを1つ目のRbo5Pの1位にホスホジエステル結合で転移する。FKTNとFKRPによるRbo5P転移反応では供与体としてシチジン二リン酸-リビトール(CDP-Rbo)が利用される。CDP-RboはCRPPA/ISPDによりCTPとRbo5Pから産生される。ところで、α-ジストログリカンのコア M3 糖鎖からは、Rbo5P 修飾の代わりにグリセロール-3-リン酸 (Gro3P) による修飾も見出されている(3)。Rbo5P 修飾と同様に、FKTNとFKRP はCDP -グリセロール (CDP-Gro) からGro3P をコア M3のGalNAcに転移することができる(4)。しかしFKRPは、FKTNによってGro3Pが修飾されたコアM3糖鎖にはRbo5Pを転移できない。また、CDP-GroはCDP-Rboに競合してFKTN とFKRPのRbo5P転移を阻害する。これらの知見は、CDP-Gro がコアM3糖鎖合成の負の制御因子であることを示している。CDP-GroはPCYT2によりCTPとGro3Pから産生される(5,6)。
2つのRbo5P転移の次は、RXYLT1により2つ目のRbo5PにXylがβ1-4結合で転移され、B4GAT1によりXylにGlcAがβ1-4結合で転移される。最後に、α1,3-Xyl転移活性とβ1,3-GlcA転移活性の2つの触媒ドメインをもつLARGEによってXylとGlcAが交互に連続的に転移されてマトリグリカンが形成される。Rbo5Pに修飾される最初のGlcA-Xylユニット(GlcAβ1-4Xylβ1)は、マトリグリカンの3GlcAβ1-3Xylα1とは結合様式が異なる。LARGEにはRbo5PへのXyl転移活性および(RXYLT1によって転移された)β結合のXylへのGlcA転移活性はないため、RXYLT1とB4GAT1 が形成したGlcAβ1-4Xylβ1はマトリグリカンを伸張させるためのリンカーとして重要な役割を担っている。また、GlcAの硫酸化がマトリグリカンの伸長を阻害することが報告されている(7,8)。
今後、O-Man型糖鎖修飾を受けるタンパク質の探索が進み、O-Man型糖鎖の多様な構造や複雑な生合成機構の生理的意義が明らかになることを期待する。
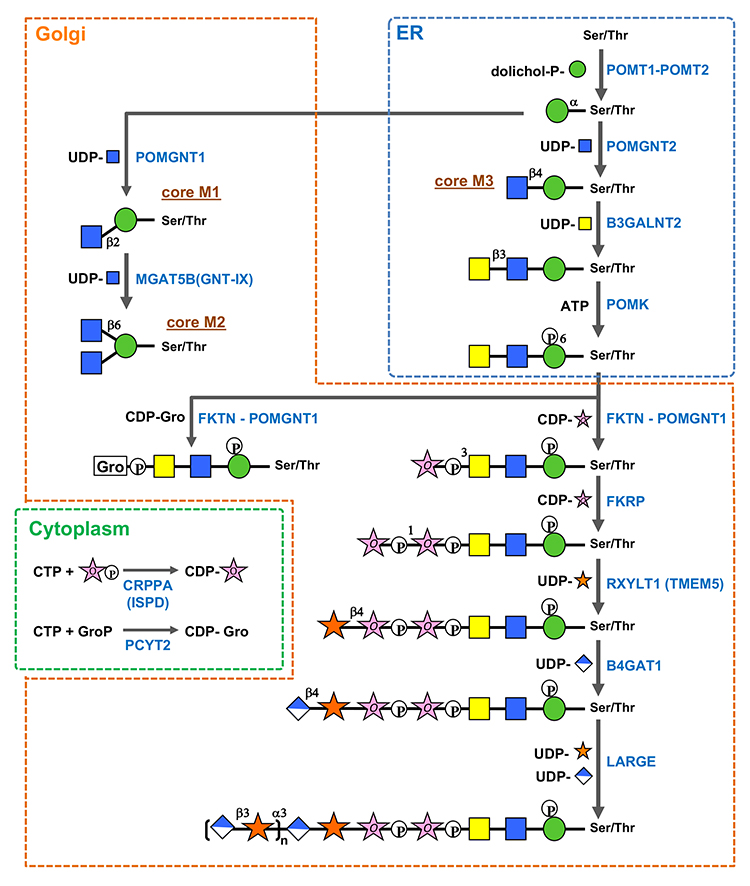
図 2. O-Man型糖鎖の生合成機構
O-Man型糖鎖の生合成に関わる酵素(青字)のうち、MGAT5B (GnT-IX)およびPCYT2以外のいずれかの遺伝子変異によってα-ジストログリカノパチーが引き起こされる。
B3GALNT2, β1,3-N-acetylgalactosaminyltransferase 2; B4GAT1, β1,4-glucuronosyltransferase 1; CRPPA (ISPD), D-ribitol-5-phosphate cytidylyltransferase (isoprenoid synthase domain-containing protein); FKTN, fukutin; FKRP, fukutin-related protein; LARGE, acetylglucosaminyltransferase-like; MGAT5B (GNT-IX), α-1,6-mannosylglycoprotein 6-β-N-acetylglucosaminyltransferase B (N-acetylglucosaminyltransferase IX); PCYT2, phosphate cytidylyltransferase 2, ethanolamine; POMGNT1, protein O-linked mannose β-1,2-N-acetylglucosaminyltransferase 1; POMGNT2, protein O-linked mannose β-1,2-N-acetylglucosaminyltransferase 2; POMK, protein O-mannose kinase; POMT, protein O-mannosyltransferase; RXYLT1 (TMEM5), ribitol-5-phosphate xylosyltransferase 1 (transmembrane protein 5).
|
萬谷 博(東京都健康長寿医療センター 老化機構研究チーム 分子機構)
Related Glycoword: ジストログリカンと細胞接着(遠藤玉夫)
| References |
| (1) |
Manya H, Endo T: Glycosylation with ribitol-phosphate in mammals: New insights into the O-mannosyl glycan. Biochim. Biophys. Acta. 1861, 2462-2472, 2017 |
| (2) |
Kuwabara N, Imae R, Manya H, Tanaka T, Mizuno M, Tsumoto H, Kanagawa M, Kobayashi K, Toda T, Senda T, Endo T, Kato R: Crystal structures of fukutin-related protein (FKRP), a ribitol-phosphate transferase related to muscular dystrophy. Nat. Commun. 11, 303, 2020 |
| (3) |
Yagi H, Kuo CW, Obayashi T, Ninagawa S, Khoo KH, Kato K: Direct mapping of additional modifications on phosphorylated O-glycans of α-dystroglycan by mass spectrometry analysis in conjunction with knocking out of causative genes for dystroglycanopathy. Mol. Cell. Proteomics 15, 3424-3434, 2016 |
| (4) |
Imae R, Manya H, Tsumoto H, Osumi K, Tanaka T, Mizuno M, Kanagawa M, Kobayashi K, Toda T, Endo T: CDP-glycerol inhibits the synthesis of the functional O-mannosyl glycan of α-dystroglycan. J. Biol. Chem. 293, 12186-12198, 2018 |
| (5) |
Imae R, Manya H, Tsumoto H, Miura Y, Endo T: PCYT2 synthesizes CDP-glycerol in mammals and reduced PCYT2 enhances the expression of functionally glycosylated α-dystroglycan. J. Biochem. 170, 183-194, 2021 |
| (6) |
Umezawa F, Natsume M, Fukusada S, Nakajima K, Yamasaki F, Kawashima H, Kuo C-W, Khoo K-H, Shimura T, Yagi H, Kato K: Cancer malignancy is correlated with upregulation of PCYT2-mediated glycerol phosphate modification of α-dystroglycan. Int. J. Mol. Sci. 23, 6662, 2022 |
| (7) |
Nakagawa N, Manya H, Toda T, Endo T, Oka S: Human natural killer-1 sulfotransferase (HNK-1ST)-induced sulfate transfer regulates laminin-binding glycans on α-dystroglycan. J. Biol. Chem. 287, 30823-32, 2012 |
| (8) |
Sheikh MO, Venzke D, Anderson ME, Yoshida-Moriguchi T, Glushka JN, Nairn AV, Galizzi M, Moremen KW, Campbell KP, Wells L: HNK-1 sulfotransferase modulates α-dystroglycan glycosylation by 3-O-sulfation of glucuronic acid on matriglycan. Glycobiology 30, 817-829, 2020 |
2024年 3月15日
|
|---|








