この作品はクリエイティブ・コモンズ 表示 4.0 |
 |
|---|
グリコサミノグリカン鎖に共通の糖―タンパク質結合領域を構成する四糖構造の生合成機構 | |||||||||||||||
 |
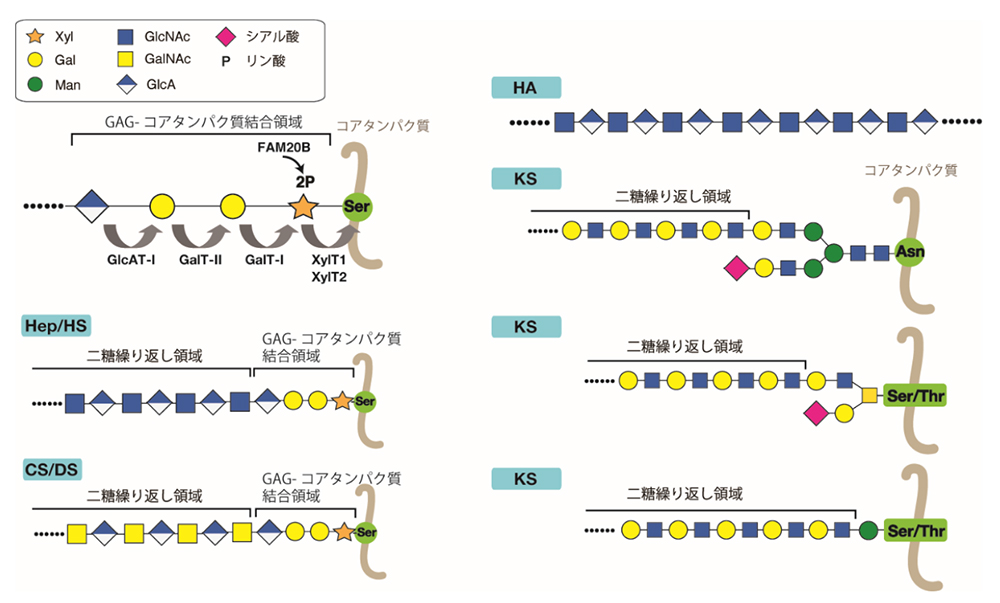
プロテオグリカン(PG)を構成するグリコサミノグリカン(GAG)は, 体中のいたるところに豊富に存在するヘテロ多糖であり, コンドロイチン硫酸 (CS)、デルマタン硫酸(DS)、ヘパリン(Hep)、ヘパラン硫酸(HS)、及びケラタン硫酸(KS)に分類される。ヒアルロン酸(HA)は硫酸化されていないこと、コアタンパク質に結合していないためPGとして存在しないことが他のGAGと異なる(“ヒアルロン酸生合成酵素”の項目を参照)。それぞれのGAG鎖は異なった構造をもっており、特有の機能を担う。HA及びKS以外の GAG 鎖は、コアタンパク質中の特定のセリン残基に結合領域四糖(GlcAβ1-3Galβ1-3Galβ1-4Xylβ1-; GlcA, Gal, Xylはそれぞれグルクロン酸、ガラクトース、キシロースを表す)を介して結合している(図 1)。構造の異なるGAG 鎖が、共通の構造を介してコアタンパク質に結合しているという驚くべき発見は、1960年代に酵素分解と酸による部分分解後に単離された中性の糖ペプチドの構造を比較することによってなされた (1)。KSはN- あるいはO-結合型糖鎖を介してコアタンパク質に結合している(“ケラタン硫酸の生合成およびその硫酸化制御”の項目を参照)。CS、DS、Hep 及びHS において結合領域は共通であるため、この構造の合成不全は上記の GAG鎖の欠損を引き起こす。 結合領域四糖は、単糖が一つずつ、それぞれの単糖の転移反応を触媒する糖転移酵素によって転移されることによって合成される。キシロース転移酵素(XylT)、β4-ガラクトース転移酵素-I (GalT-I)、β3-ガラクトース転移酵素-II(GalT-II)および β3-グルクロン酸転移酵素-I(GlcAT-I)が順番に、Xyl、Gal、Gal、GlcA残基を転移していくと結合領域四糖が完成する(図 1)(2)。Xyl残基は、XYLT1 あるいは XYLT2 遺伝子によってコードされた XylT によって、ウリジン二リン酸(UDP)-Xylから特定のセリン残基に転移されることで結合領域の合成が開始する。次に、B4GALT7 遺伝子によってコードされた GalT-I によって、2番目の Gal 残基が UDP-Gal から Xylβ-O-Serに転移される。3番目の Gal 残基は、B3GALT6 遺伝子によってコードされた GalT-II によって、UDP-Gal から Galβ1–4Xylβ-O-Ser に転移される。最後に、4番目の GlcA 残基が、B3GAT3 遺伝子によってコードされたGlcAT-I によって、UDP-GlcA から Galβ1–3Galβ1–4Xylβ-O-Ser へ転移される。結合領域三糖が合成されるまでの間に、FAM20B 遺伝子によってコードされたGAG Xylキナーゼが、アデノシン三リン酸をリン基供与体としてXyl 残基のC-2位のリン酸化反応を触媒する。リン酸化された結合領域三糖 Galβ1–3Galβ1–4Xyl(2-O-リン酸)に GlcA 残基が転移されると同時に、PXYLP1遺伝子にコードされた 2-O-リン酸化Xyl脱リン酸化酵素によってXyl残基の2位のリン酸基が加水分解される。
GAGの生合成における未解明の問題の一つは、CS、DS、Hep あるいは HS といった種々のGAGを作りわける分子機構についてである。多くのPGにおいて、GAG付加部位周辺のアミノ酸配列が、GAGのうちHSあるいはCSのどちらを付加させるかの選択に影響を与える可能性が考えられている。例えば、酸性アミノ酸のクラスターは HSPG に共通して見られるが、CSPG には稀にしか存在しない。また、セリン-グリシンから成るGAG付加部位の周辺に疎水性アミノ酸が存在すると、HSの生合成が促進される可能性も示唆されている。さらに、結合領域四糖の硫酸化やリン酸化などの修飾構造の違いがGAGの生合成を制御すると考えられている。硫酸化された結合領域にはHSあるいはHep鎖が付加していないため、結合領域の硫酸化は HS生合成経路を迂回させるためのシグナルとしてはたらく可能性が考えられているが、その真偽は明らかになっていない。さらに、生合成酵素は生理的条件で相互作用し、ギャゴソームと呼ばれる複合体を形成する。2002年にEskoとSelleckによって提唱されたギャゴソームモデルでは、いくつかのHS生合成酵素が複合体を形成し、協調してはたらく可能性が示されている (3)。生合成酵素の組み合わせが異なる様々なギャゴソームが、ゴルジ体でGAG鎖の重合反応や微細修飾構造の合成反応の連携を図っている。 結合領域四糖の合成に関わる糖転移酵素遺伝子の変異によって引き起こされる遺伝病が数多く知られている(表 1)(4)。これらの遺伝病では、体中の様々な部位の結合組織に異常が起きている。結合領域四糖の合成に関わる糖転移酵素遺伝子の変異によって引き起こされる遺伝病は総じて “PGリンカー病” とも呼ばれている (5)。
灘中 里美 / 北川 裕之(神戸薬科大学 生化学研究室)
|
||||||||||||||
2023年12月13日