|
糖質加水分解酵素 (Glycoside Hydrolase, GH) はEC番号では3.2.1.–に分類され、Carbohydrate-Active enZymes (CAZy) データベースでは160を超えるGHファミリーに分類される大きな酵素クラスであり、アミラーゼ、セルラーゼを含む多数の酵素からなる。GHの活性中心(触媒残基)は一般的には一対のアスパラギン酸 (Asp) またはグルタミン酸 (Glu) からなる。基質の一部(N-アセチル基やヒドロキシ基)が触媒基として働くものや、ごく一部の例外(触媒残基がチロシンやヒスチジンであるもの)が知られているが、基本的には、GHの活性中心は、ファミリーが異なっていてもほとんど同じと言ってよい。
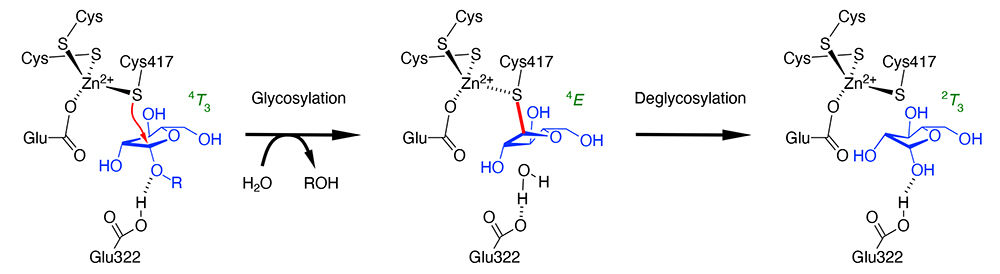
筆者らは2014年に、ビフィズス菌由来のβ-L-アラビノフラノシダーゼ (HypBA1) が亜鉛に3つのシステインと1つのグルタミン酸が配位した活性中心を持ち、そのうちの1つのシステイン (Cys417) が、酵素に結合したアラビノフラノースのアノマー炭素 (C1原子) の近くに存在することを見出した(1)。HypBA1はアノマー保持型の加水分解反応を触媒することが分かっており、この事実は、システインが求核触媒として働くことを強く示唆していた。すなわち、Cys417が通常のアノマー保持型GHの求核触媒としてのAspやGluと同様に働くと予想された。また、Glu322はアラビノフラノースのO1ヒドロキシ基と水素結合しており、こちらは通常のアノマー保持型GHと同様に酸/塩基触媒残基として機能すると予想された。しかし、システイン修飾剤が酵素活性を失わせるという実験結果から、GHの活性中心がシステインであるという主張は古くから数多くあったが、その全てが後に否定され、AspとGluを触媒残基とするものが大部分であると判明している。したがって、HypBA1のように、前例のないアミノ酸残基が活性中心と予想される場合には、その反応機構を証明するためにさらなる検証が必要であった。さらに、求核触媒残基がシステインの場合には共有結合中間体の安定性が高すぎると予想されるために、なぜ脱グリコシル化 (deglycosylation) 反応が起こるのかということも疑問点として挙げられていた。
HypBA1の反応機構を検証するためには、主に2種類のアプローチが必要であった (2,3)。すなわち、システイン残基を特異的にラベリングするプローブとしての阻害剤の利用、そして計算化学的手法の導入である。特異的な阻害剤としては、アラビノフラノシル基を導入したハロアセトアミド化合物と、アラビノフラノース配置のシクロフェリトール化合物を用いた。前者は求核触媒残基がシステインであるペプチド:N-グリカナーゼのラベリングでの成功例があり、後者は多数のGH酵素で特異的阻害剤として用いられてきた経緯がある。HypBA1とこれらの阻害剤を反応させてX線結晶構造解析を行ったところ、いずれもCys417と共有結合した付加物が結晶構造中で観察できた。これは反応中間体の模倣体であり、それまでに得ていたアラビノフラノース複合体構造(反応産物にあたる)、および合成基質のp-ニトロフェニル-β-L-アラビノフラノシドとの複合体構造(ミカエリス複合体にあたる)と合わせて、反応前、中間体、反応後の3状態にあたる結晶構造が得られたことになる(下図)。結晶構造からは、反応経路に従って変化するアラビノフラノースの5員環の配座に関する情報が得られた(4T3 → 4E → 2T3)。また、脱グリコシル化における問題点は、詳細なQM/MM計算を行ったところ、自由エネルギー的に無理のない遷移状態を取って反応することが明らかになった。システインの硫黄原子に亜鉛原子が配位することにより、この反応が進行しやすくなっていると推察された。なお、HypBA1はGH127に属するが、別のファミリー (GH146) の酵素も同様に亜鉛残基に3つのシステインと1つのグルタミン酸が配位した活性中心を持っていることが分かっている。システインが活性中心であるGH酵素は今後も見つかる可能性があるといえよう。
伏信 進矢(東京大学大学院農学生命科学研究科)
| References |
| (1) |
Ito T, Saikawa K, Kim S, Fujita K, Ishiwata A, Kaeothip S, Arakawa T, Wakagi T, Beckham GT, Ito Y, Fushinobu S: Crystal structure of glycoside hydrolase family 127 β-L-arabinofuranosidase from Bifidobacterium longum. Biochem. Biophys. Res. Commun. 447, 32-37, 2014 |
| (2) |
McGregor NGS, Coines J, Borlandelli V, Amaki S, Artola M, Nin-Hill A, Linzel D, Yamada C, Arakawa T, Ishiwata A, Ito Y, van der Marel GA, Codée JDC, Fushinobu S, Overkleeft HS, Rovira C, Davies GJ: Cysteine Nucleophiles in Glycosidase Catalysis: Application of a Covalent β-L-Arabinofuranosidase Inhibitor. Angew. Chem. Int. Ed. 60, 5754-5758, 2021 |
| (3) |
Maruyama S, Sawano K, Amaki S, Suzuki T, Narita S, Kimura K, Arakawa T, Yamada C, Ito Y, Dohmae N, Fujita K, Ishiwata A, Fushinobu S: Substrate complex structure, active site labeling and catalytic role of the zinc ion in cysteine glycosidase. Glycobiology 32, 171-180, 2022 |
2023年 6月15日
|
|---|