
氏名:John E. Scott
1930年英国Macclesfieldに生まれる。Macclesfield King's Schoolではクリケット、チェス、音楽に傾倒する日々を送った。その後進学したManchester大学(1948-1956)には、Nobel賞受賞者BlackettとLewisが在職しており、世界初のプログラムコンピュータが稼働していた。彼のPh.D.学位論文(A.V. Hill賞受賞)には、その後、数十年にわたって世界のヘパリン生産の基礎となった、臨界電解質濃度現象の発見が記されている。
英国空軍に従軍(1956-1958)。
TaplowのMedical Research CouncilのRheumatology Unit在職中(1960-76)に、超微細構造と機能の関係に着目して研究をすすめ、1973年に英国生化学会ゴールドメダルを受賞した。1976年、その分野では初となる化学形態学の教授としてManchester大学に戻った。ここでは組織中のプロテオグリカンに対する電顕組織化学的研究方法の開発と、結合組織マトリックスを組織化している形態モジュールの発見や、細胞外マトリックスのグリコサミノグリカンにおける2次および3次構造の発見が続いた。他にも、初期進化過程等に関心を寄せた。
主な受賞暦は、ヨーロッパ組織化学会から1986年にRobert Feulgen Prize;1995年StockholmでWenner-Gren Distinguished Lectureship。その他に、3つの学会で名誉会員、4つの大学で客員教授(米国とオーストラリア)、Massey大学(ニュージーランド)の名誉フェロー、Manchester大学名誉教授でもある。また9つの学術雑誌の編集委員をつとめ、250の論文と特許、2冊の著書を発表した。
ヒアルロン酸(以下HAと略す)は、生体高分子の中ではきわめて単純な構造を持っている。HA分子は、N-アセチルグルコサミンとグルクロン酸のたった2種類の単糖が交互に2糖単位で、何百または何千と直鎖状に連なった分子である(Fig. 1)。HAは1種類しか存在しない。それは典型的なグリコサミノグリカン(以下GAGと略す)と言える。類似するアニオン性GAGには、コンドロイチン硫酸、ケラタン硫酸およびヘパラン硫酸があるが、これらはHAとは対照的に、その硫酸基が糖鎖に沿ってさまざまな位置に配置されることによって、天文学的な数の異性体として存在することができる。各グルクロン酸はそのカルボキシル基により、生理的なpHで1つずつアニオン電荷を有するので、各HA糖鎖には何百という負電荷が固定されている。これらの電荷はNa+、Ka+、Ca++およびMg++のような移動性カチオンで平衡化されている。この意味から1つのHA分子は小さな可溶性のカチオン交換体といえる。完全にメチルエステル化することで非荷電高分子に変換したHAは不溶となるため、電荷は水溶性を知る上で重要である。
だが、HAは簡単に説明できるものではない。例えば関節の滑液、硝子体またはさい帯のウォートンジェリーのようないくつかの場合には、その役割は明らかに機械的または構造的なものである。その一方で、きわめて低い濃度ではいくつかの細胞と反応することで、非常に高い特異性を示し、重要な応答の引き金となる。多くの細胞はHAのレセプターを有している。進化論的にいえばHAは初期分子であり、生物圏が複雑化するにつれ新しい仕組みを作り出すのに十分な時間があったと言える。
鍵はHAが取りうる形態にある。長きにわたって一流の科学者たちが用いてきた高分子化学の古典的分析法(粘度、光散乱、超遠心)は、溶液中のHAがランダムコイルの形をとるという考えを支持してきた。しかしながらこれらの方法は、数多くの分子の結果を平均化したバルク特性を測定するもので、理論モデルを参照して判断する必要がある。そのようなモデルとの適合性は、必ずしもそのモデルの根拠をなす仮説を証明することにはならない。
ここで、生物現象を分子レベルで理解するにあたって強調しておきたいことがある。それは、系がランダムであればあるほど、その系から得られる情報は少ないということである。物質の生物学的な特質は、エントロピーを減らし、情報を増やし、恒久的かつ再現可能な形態を用いることで得られてきた。さらに、生物種が互いに特異的かつ強く相互作用すると、ランダムな系のエントロピーの多くは失われる。したがってランダム系における相互作用は弱く特異性も低い。それゆえ、HAが優先形態を取るかどうか調べる試みがなされた1。
HA鎖には2種類の結合がある。その1つである糖の環は、比較的固定された形を取る。これらの固定した環状の糖構造の間にグリコシド結合があり、これは1つの酸素原子が糖を1つずつつないでいる。これらの酸素原子はアルファベットのVのアームのように方向付けられた2本の結合に寄与している。これらのアームの端に結合した置換基は360度回転できる。O原子を介したグリコシド結合は、糖が互いに妨げになるため、すべての可能な立体構造を自由にとることはできない。それは少し前に計算と分子モデリングにより示された。それでも各結合においていくつか可能性のある配置がある。この選択肢の数と長い分子鎖の全結合の数をかけ合わせれば、1分子あたりに取りうる形態の数は莫大なものとなる。ランダムなようで、実はそうではない。
HAには優先的な形態があるという最初の証拠は、HA構造中のグルクロン酸残基のグリコール基が、同じような環境下における他の高分子では容易に攻撃されるのに、過ヨウ素酸酸化に抵抗性を示したという化学実験結果から得られた(Fig. 1)。過ヨウ素酸酸化のデータと低解像度X線ファイバーの結果を組み合わせたデータに基づいて作られた分子モデルから、HAには広範な水素結合構造が存在することが示唆された1。NMRの結果が、水溶液中にこの秩序ある構造の存在を確認した(Fig. 1)。その構造は、各2糖単位は糖鎖中の前後の2糖に対し、180度ねじれている。2回ねじれると(全360度)もとの方向に戻るので、この構造は2回軸らせん構造(two-fold helix:2つの分子からなる二重らせん構造(double helix)ではない)である。精密なコンピューターシミュレーションによると、水分子がこの構造を安定化させる重要な働きをしていることが示唆された2。
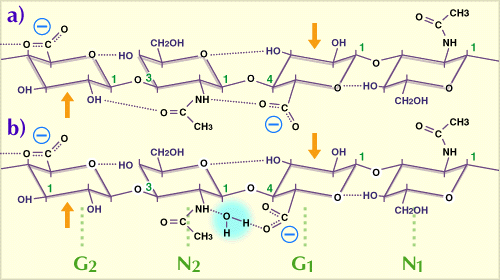
Fig. 1
水溶液中で優先的空間配置をとっている繰り返し2糖を含んだ、HA鎖の4糖。G:グルクロン酸、N:N-アセチルグルコサミン。
点線は水素結合を示し、このうち5つはHAの各4糖中に潜在的に存在する。非水溶媒のジメチルスルホキシド中では、N2のアセトアミドとG1のカルボキシル基の間の水架橋(b)は、直接の水素結合に置き換わる(a)。G1とN1の2糖はG2、N2の2糖に対し、糖鎖の軸の回りで180度回転している。したがって糖鎖は2回軸らせん構造をしている(Ref. 1参照)。矢印は過ヨウ素酸酸化に抵抗性を示すグリコール基(本文参照)。
このテープ状の構造は、平面においても立面においても緩やかにカーブしており(Fig. 2)、このことがいかにしてHA分子が互いで2量体を形成するのかを決める重要な点である。興味深いことにコンドロイチン硫酸、ケラタン硫酸およびデルマタン硫酸も、水溶液中で似たような2回軸らせん構造を取る傾向にある。
Struther ArnottのグループがおこなったX線によるHA研究で二重らせん構造が観察されたが、これは正常な生理的条件よりも低いpHで作成された固体試料を測定したものであった。そのほかの単一鎖による多回軸らせん構造は、より高いpHで付着するカチオンに依存する形で見られた。これらのX線による研究結果は、高分子鎖が生理的条件下の水溶液中で形づくる優先的な構造を解くというよりも、むしろ高分子鎖が取りうる可能な構造を解き明かしているといえよう。
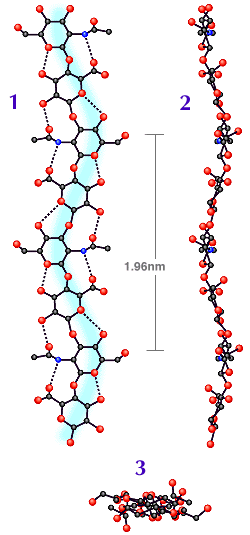
Fig. 2
コンピュータで作製したテープ状HA分子の平面図(1)と立面図(2)。(3)は2回軸らせんを軸方向から見た図。
高分子鎖が(1)と(2)のいずれにおいてもゆるやかにカーブしていること、平面図では互いが直角をなしていることに注意。C原子は黒丸、O原子は赤丸、N原子は青丸で示す。
(Ref. 1のAtkins, EDT, Meader, D and Scott, JE (1980) を一部修正)
この2次構造の意義(単純な糖の配列である1次構造とは異なる)がより明確になったのは、2回軸らせん構造のHAが、カプリル酸とほぼ同じサイズの、おおよそ8個のCH単位からなる広い疎水性領域を持っていることがわかってからである(Fig. 3)1。コンドロイチン硫酸、ケラタン硫酸およびデルマタン硫酸も、その2回軸らせん構造のほぼ同じ位置に似たような疎水性領域を有している。
つまり、HAは多数の水酸基を持ち高度に親水性であると同時に、脂質の特徴である疎水領域としての性質も有する両親媒性といえる。疎水性領域は、水溶液中の分子に対し広範な影響力を持っている。疎水性分子は水中で凝集するため、溶媒との接触面は縮小する。このメカニズムがin vivoにおいて膜を形成する原動力となり、またDNAにおける二重らせんのような構造の安定に寄与している。化学的な結合が形成されるわけではないが、これを疎水結合と呼んでいる。
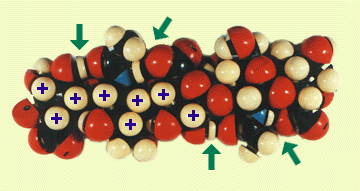
Fig. 3
Fig. 1に基づいて、空間充填型Courtauld原子模型で組み立てたHAオリゴ糖モデル。矢印で示した水素結合は、アセトアミドと隣のグルクロン酸の間にある。C原子は黒、Oは赤、Nは青、Hは白で示す。+印で示した水素原子は、8個のCH基から成る疎水性領域の一部である。(グルコサミン6位の)ヒドロキシメチル基は、容易に回転してそのCH2をこの領域につけ加えることができる(Ref. 1参照)。
疎水性領域により、HAの非常に興味ある性質が説明される。シドニーのPeter Ghoshとモデナ(イタリア)のYvonne Pasquali-Ronchettiは、それぞれNMRとロータリーシャドー電子顕微鏡を使って、膜の重要な成分であるリン脂質がHAと複合体を形成することを見出した。Peter Ghoshは、脂質の炎症メデイエータと血小板活性化因子がHAと同様の結合をするので、この2つとその他の有害な物質を隔離することにより、HAは炎症を起こした関節内で有益に作用するのではないかと推測した。
HAと脂質膜の関係は、HAが細胞膜表面で生合成されることからもわかるように、かなり初期から始まっている。ロンドンのSt. Mary's HospitalのJ. A. Sirsは、HAが赤血球膜の柔軟性を増していることを証明した。ベルゲン(ノルウェー)のR. Reedらが示した、小腸から脂肪を吸収する際にリンパ液中のHA濃度が上昇することも関連がありそうである。
多分HAの生物学的役割の多くは、細胞膜と連携する機能に常に依存してきたと思われる。HAは、Peter Mitchellが細胞膜中であらゆる化合物を移動する「運び屋(transporter)」分子にも見つかると推測した特徴を持っている。これらの運び屋は、膜に出会うと入れ替わるような疎水性と親水性の両方の性質を有するはずで、この性質を利用して細胞から何かを運び出したり、運び入れたりする。
HAはまたそれ自身で互いに凝集するが、これには疎水性領域の間の結合がある程度影響している3。Fig. 2に見られるような、平らでテープ状の構造は魅惑的な性質を有している;テープの両面は全く同一であるが、一方の面は他の面に対し反対に進んでいる−すなわちアンチパラレル(逆平行)なのである。この結果として、テープの一方の面で可能なことはもう一方の面でも可能となる。凝集は両方の面から成長できる。私はこのような高分子を「両方の手を同じようにうまく使える」という意味の“ambidextrous”から“ambidexteran”と名付けた。
HA凝集体の解離を促すような、多くの負電荷の間の静電気的反発力は、疎水結合作用だけでなく、アセトアミドとカルボキシル基の間の水素結合によっても抑えられてその効果を発揮できない(Fig. 4)。これらの非常に短い距離の間で働く相互作用は、2つのHA分子が密接に相補的である必要があり、これはHA鎖が互いに逆平行に位置している時が最適であった(Fig. 4)。そのような状態になってはじめて形状のゆるやかなカーブが相互に補足し合い(Fig. 2)、疎水結合と水素結合が最も強くなる。ブリストル(英国)のE. D. T. Atkinsは、繊維X線実験で、隣接するHA分子においてアセトアミドとカルボキシル基の間の水素結合を認めた。
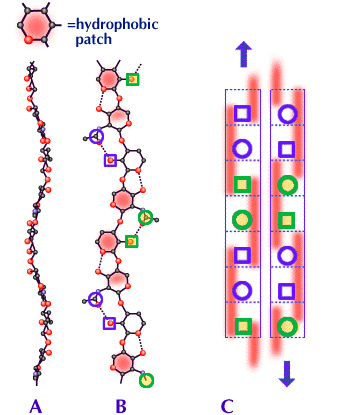
Fig. 4
AとBはHA分子の立面図と平面図である。Bの赤い部分は、高分子鎖中の側面に交互に3糖単位に沿って広がる疎水領域である。
円はアセトアミドを、四角形はカルボキシル基を示す。AとBでは最も関連のある原子のみを示してあり、完全な構造はFig. 2を参照されたい。CはHAの可能な2量体の側面図である(同様な構造はコンドロイチン硫酸、ケラタン硫酸およびデルマタン硫酸、また更にHAを含めたこれらの2つ以上の混合物でも可能である。Fig. 5参照)。2つの分子は互いに逆平行である。点線は各糖単位の輪郭を描いている。赤い長方形は、3糖単位に沿ってのびた疎水領域で、高分子鎖の表と裏に交互に現れる。青い円と四角形は、分子および2量体の同じ側にある(Bも参照)。
A、Bで見られるように、各分子におけるカーブは逆平行の設定でほとんど同じコースをたどるので、2量体における2つの分子は互いにぴったり合っている。こうして疎水領域は互いに密にかみ合い、またアセトアミドとカルボキシル基は水素結合のできる近さとなっている。
ロータリーシャドー法を用いた電子顕微鏡観察によると、HAは非常に低い濃度において(1μg/ml)、ハチの巣状の網目構造を取ることが示された。この濃度における高分子量のHAによる網目構造においては、分子の頭やしっぽは見つからず、網目構造は事実上無限である。どのHA分子も網目を通して残りの全ての分子と結合している。対照的に、低分子量のHAは低濃度において網目構造を形成するが、この場合の網目は島状となり、それぞれ他の島とは分離したものとなる2。
この網目を結びつける相互作用は比較的弱く、条件と温度に応じて凝集体が形成されたり解離したりする。HA濃度が高くなるにつれ、網目はより密になる。たとえば滑液中濃度(> 1 mg/ml)に達する頃には、シートおよび管状の印象的な形態がロータリーシャドー法電子顕微鏡で観察された。
ここで重要なのは、これらの網目構造には秩序があることである。HAの2次構造が凝集体の形を決定し、また“ambidexterans”の網目の分枝はそれぞれ、HA鎖によって確立された上方または下方の2つの明確な固有の方向性を持っている。このことが形態形成の誘導などといった、組織構成に影響力を持っている可能性がある。
Chang、BoackleとArmandは、HAが補体によって活性化された赤血球の溶解を強く阻害することを発見したが4、それは「変性した」HAによってだけ見られた。室温で調製、保存したHA溶液はほとんどこの活性を示さなかったが、変性型を捉えるために100℃に加熱してから急速に凍結すると、溶液は阻害活性を獲得した。冷却に時間をかけると、HAには復元の時間があるので阻害作用の弱いものができた。このように普通の濃度におけるHA溶液の隠された性質は、HA凝集体をばらばらにする操作により明らかになる可能性がある。
HAの秩序ある網目構造を形成する能力は機能発現上も重要であり、特に眼の硝子体液はその代表例である。
水晶体と網膜の間にある、硝子体に占められた空間は、光の遮断や錯乱を引き起こす細胞やけん濁物および血管等がなく、光学的にカラでなければならない。この状態がどのようにもたらされるのか詳細は不明であるが、その概要は以下の通りである。硝子体は安定したゲルであり、ヒト(および多くの動物)の場合はHAを含んでいる。たとえ高分子量のHAでも、硝子体中の濃度(約2 mg/ml)においてはゲル化せず、細いコラーゲン線維の非常にまばらな網目構造が加わることにより、この組織の堅さが増加する。硝子体は、線維で強化された複合物で、水以外の成分量は機械的安定性に適合する最低限にまで減らされており、その結果、光路になるべく固形分を取り込まないようになっている(硝子体は99%が水より成る)。
硝子体中のHAとコラーゲンが、分子レベルでどのようにして組織化されているかについては、新しい電顕組織化学技術が二段階の組織化を明らかにするまで全くわからなかった5。細い(10 nmの)コラーゲン線維は、おそらくコンドロイチン硫酸と思われるアニオン性GAGの橋や連結によって房状または小枝状に分けられて保持されている(Fig. 5)。これらの束は互いに平行に、また時々は直角に走っている。なぜこれらの小枝や房は、何年にもわたる環境によるストレスで、絡み合ったり凝集しないのだろうか。これはHAの機能によるためと思われる。
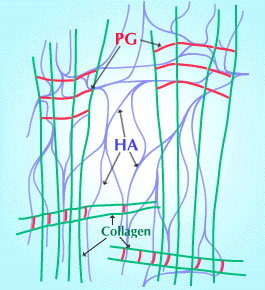
Fig. 5
硝子体液の安定性の基礎として提案された、3成分(HA、コラーゲン線維とプロテオグリカン)の構造の図式。プロテオグリカンは、コラーゲン線維上の特異的結合部位を介してコラーゲン線維とコラーゲンの橋渡しをしており、このコラーゲン・プロテオグリカン構造は、HAの網目構造により離されて保持されている。このHAの網目構造と橋渡し中のコンドロイチン硫酸が相互作用を起こす。(ScottによるRef. 6を一部修正)
Fig. 6

Fig. 6 ここをクリック
HAは、コンピュータモデルやin vitro実験で示されるように、HA同士が作用するのと同じように、コンドロイチン硫酸のようなアニオン性GAGと相互に作用している。この相互作用が硝子体中でも起こるのは、コンドロイチン硫酸の橋渡し構造を離して保持しておくことで、溶解したHAやコンドロイチン硫酸そしてコラーゲン線維から構成されるまばらな網目構造を安定したジェリー状に維持するためである (Fig. 5)。
このモデルはアラバマ州バーミンガムのRichard Mayneの実験によって支持された。つまり、硝子体のHAが特異的ヒアルロニダーゼで分解されると、コラーゲン線維は確かに凝集して目に見える凝固物を形成したのである。コラーゲン線維は、加齢硝子体では「自然に」凝集し、飛蚊症を引き起こして近視眼者を悩ませたり、多くの老齢の人々に影響を与える。同時に硝子体は、特に中央部分で部分的に液化する。HAは、おそらく可視光の放射に絶えずさらされることによって生じるフリーラジカルのメカニズムにより、一部分解される。加齢によるプロセスと、Richard Mayneの実験による硝子体HAの酵素的分解との間の類似性は明らかだ。
小さな化学的分解でも、予想以上に網目構造全体に影響を与える。電子顕微鏡で見ると、フリーラジカルによる軽度な「分解」の直後に、連続していた網目構造が島状に分断した状態になったのが確認されたが2、「分解を受けた」HA分子はまだかなり大きな分子サイズのままであった。この時、低濃度のHA溶液中では、HAの分子鎖は隣接する凝集体のHA分子に届くには長さが足りなかった。Bedford(英国)のD. J. Reesのグループは、低分子量のHAの存在が、高分子量のHA溶液の弾性および粘性的性質を低下させることを発見した。これは、低分子量HAが網目構造の分岐点で競争的に働くことで高分子量HAに置き換わるため、その時点で網目構造が崩壊したからだと推測される。
このようにHAの分解は、二通りの方法で網目構造にダメージを与えると考えられる。HAレセプターまたは結合部位を持つ細胞は、その周りに広いHAの網目(halo=カサ)を固定することができる。これらのカサは、メルボルンのBob Fraserが証明したように、ほかの細胞、粒子および巨大分子が(排除体積効果により)細胞に接近するのを防ぐと考えられる。もしここで粒子が有害もしくは有害化合物を生成する能力があれば、このカサは防御に働く。しかしながら、低分子量のHAで構成されたカサは、高分子量HAに守られた細胞に比べて防御能力は弱く、OHフリーラジカルを生成する酵素が与えた細胞の損傷もはるかに大きかったことがDonatellaと J. E. Scottにより示された。
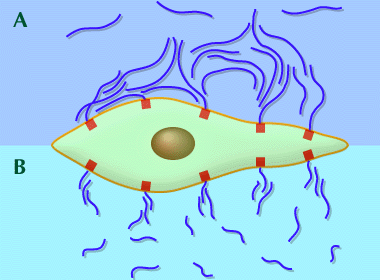
Fig. 7
細胞に固定されたHAの網目構造は、他の細胞や粒子、大きな分子が細胞膜に近づくのを防ぐ。高分子量HAは同じような濃度において、低分子量HAよりも遮蔽効果が高い。赤い四角形はHAのレセプターまたは結合部を示す。
(A) 高分子量HAの網目構造は、隣接する細胞表面の結合部位に結合したHA分子とオーバーラップし、凝集体を作る。
(B) 隣接するHA凝集体にオーバーラップして補強するには長さが足りないため、低分子量の網目構造は、粒子が細胞膜に接近できる隙間や溝ができる。
われわれの実験モデルでは、粒子はグルコースオキシダーゼで、Fenton反応においてOHを含む傷害性フリーラジカルを生み出す酵素である。高分子量HAはこの酵素に対して効果的な遮断壁であり、低分子量HAに比べて細胞の損傷を大幅に減らした(Ref. 6)。
私はHA分子の形(2次構造)が、その糖鎖において隣り合った糖(1次構造)の間の立体的相互作用および水素結合によって決められることについて述べてきた。2次構造は平らなテープ状をしており、その両面に交互にある疎水領域が、水中における優先的な形態の特徴である。
2つの面は同一であるため、HA分子はどちらも自由に使える「両手利き」である。つまり、たとえ低濃度でも水の中で特異的相互作用により凝集して、網目構造(3次構造)を形成することができる。そしてこの網目構造の形成が、眼の硝子体の透過性の維持といった重要な生物学的機能に影響を与えていることについていくつか述べた。