
氏名:Raija Tammi
Raija TammiはフィンランドのTurku大学から、1975年にM.D.を、1981年にPh.D.を授与された。その後、彼女は同じフィンランドのKuopio大学へ移り、解剖学科の助教として勤務している。博士は1984-86年、California大学San Francisco校(アメリカ)の皮膚科学教室でポストドクとして、1994-96年にはCleveland Clinic Research Institute(アメリカ)で研究員としてサバティカルを過ごした。博士は上皮組織のHA代謝を研究してきたが、現在は角化細胞(ケラチノサイト)分化におけるHAの役割に焦点を当てている。

氏名:Markku Tammi
Markku TammiはフィンランドのTurku大学からM.D.とPh.D.をそれぞれ1975年と1979年に授与された。1979年にKuopio大学解剖学科へ移り、現在は解剖学の准教授である。1984-86年、博士はCalifornia大学Berkeley校(アメリカ)の生物化学科でポストドクとして過ごし、1994-96年にはCleveland Clinic Research Institute(アメリカ)で研究員としてサバティカルを過ごした。博士は関節軟骨のグリコサミノグリカンを研究してきたが、最近のテーマは表皮におけるヒアルロン酸の代謝である。
皮膚は、外部環境と身体の内側の間のバリアーを形成している。皮膚は二つの異なった組織から成っており、それらは密に重なり合っている。それは重層した上皮細胞から成る表面上皮と、その下にある密な結合組織から成る真皮である(Fig.1と2)。表皮はケラチノサイト(角化細胞)と呼ばれる明確な細胞層を有している。ケラチノサイトの最底部は基底細胞層を形成している。それらは、真皮と表皮の接合部の境界となっている基底層の上にあり、この基底層は特殊化したコラーゲン、複数の接着点を持つ糖タンパク質およびプロテオグリカンから成っている。基底部のケラチノサイトは分裂し、娘細胞は上部の有棘細胞層へと移動する。この層のケラチノサイトはその後顆粒細胞層へ移動し、最終的に表皮の角質細胞となる。基底部の有棘細胞と顆粒細胞は生きているが、その一方でコルネオサイトと呼ばれる角質層の末期細胞はもはや死んでいる。表皮は常に更新している組織であり、細胞分割と最終分化したコルネオサイトへの進行のプログラムは、非常に厳密に制御されている。表皮における物理的・機械的強度は、細胞内の緊密なケラチンフィラメントネットワークが担っており、これは細胞間の結合(デスモソーム)および基底細胞と基底層の接合部(ヘミデスモソーム)につながっている(Fig.1)。
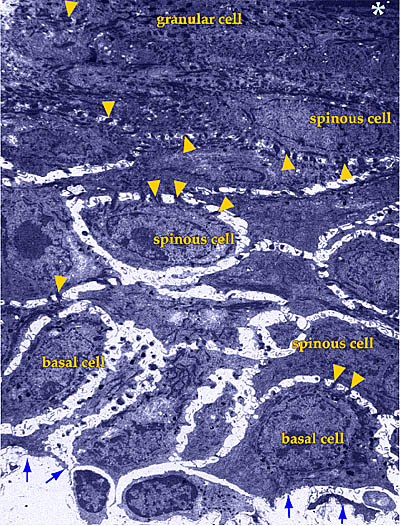
Fig. 1 ヒト成人表皮の低倍率透過型電子顕微鏡。
写真矢印は基底層の位置を、アスタリスクは角質層の開始部分を示す。矢頭はケラチノサイト間のデスモソームによる接合部を示している。
参考図は正常ヒト皮膚組織を示した。
ここをクリック。
50年の間皮膚の主要成分として知られてきたヒアルロン酸(以下HAと略記する)は、最近まで真皮のみに由来すると考えられてきた。その第一の理由は真皮が皮膚の大部分を占めており、そして結合組織のマトリックスの形成におけるHAの役割が知られていたからである。さらに、従来法による固定処理切片を電子顕微鏡で観察した結果、表皮のケラチノサイトの周りの細胞外スペースは微小(通常は容積の1%以下)であった(Fig. 1)。
しかしながら、組織の微細構造セクションにおけるHAの局在化を目的とした非常に特異的で感度の高い技術を用いた最近の観察により、表皮のケラチノサイトの周りに予想以上に高いシグナルが見つかったのである(Fig. 2)1。
最近の研究では、ケラチノサイトの周りのマトリックスに存在するHAの量だけでなく、表皮におけるこの高分子の代謝と生物学的機能まで明確になりつつある。
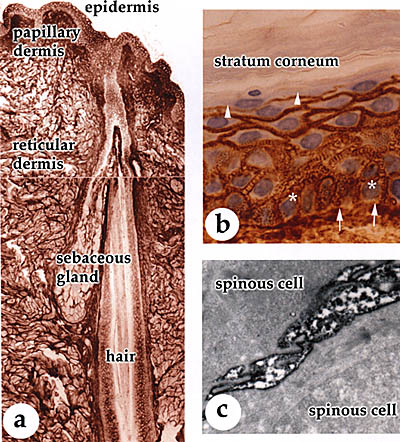
Fig. 2 (a, b)ヒト成人皮膚におけるHAの分布
ヒト皮膚の切片について、ビオチン化したG1タンパクとリンクプロテインの複合物を用いてHAを染めたもの。この結合はアビジン・ビオチン・ペルオキシダーゼ法(褐色)により発色し、また核をヘマトキシリンで対比染色した(b、青色)。アスタリスクで示した基底膜から矢頭で示した顆粒細胞層までの表皮に強い染色が認められる。基底層下の結合組織(papillary dermis: 乳頭真皮)は強く染まっているが、より深い結合組織(reticular dermis: 網状真皮)ではそれほど強くない。皮膚付属器(脂腺および毛包)の上皮細胞も染色された。(b)の矢印は基底膜を示す。
(c)ヒト表皮におけるHAの超微細局在
ヒト皮膚切片を上と同様に染色し、透過型電子顕微鏡で見たもの。ケラチノサイトの間の細胞外ポケットに見られる濃い沈殿はHAを示す。
空間の充填物および細胞外マトリックスの形成体としてのHAは、真皮や軟骨のような間充組織及びその由来組織ではわかりやすい概念である。細胞がぎっしりと配置され、細胞外空間は非常に少なく見える上皮組織では、HAの機能は余り明確ではない(Fig. 1)。実際、もし高濃度のHAがあるとすると、細胞外の空間を膨張させて、おそらく上皮細胞同士の結合を壊し、また上皮の透過バリアーとしての働きを危うくすることになるだろう。この見方からすれば、正常な胃腸2、呼吸器および生殖器官に見られる最も単純な上皮が、HAをほとんどまたは全く発現していないことは驚くことではない。一方、皮膚における重層上皮と、口、食道そして膣のそれぞれの粘膜の重要部分を、軟骨アグリカンとリンクタンパクから調製したHA特異的プローブで染色すると、全て細胞周囲が濃く染まった(このシリーズのHardinghamの項参照)。それに加えて、現在ではEDTA溶液による二価陽イオンのキレートで、表皮を真皮から分離できるようになり、これにより表皮HA含量の正確な測定が可能になった。その存在量は(0.1-0.2 microg/mg乾燥重量)と比較的低かったが、この組織の細胞外スペースは小さく限定されているので、細胞外容積の正確な推定にもよるが、その濃度としては2.5 mg/mlにもなると考えられる。
皮膚の器官培養から、HAは細胞を取り巻くマトリックス中で単に不活性な空間充填物ではなく、実際には活発に代謝されていることがわかった。例えば、ヒト皮膚の体外移植組織を、〔3H〕グルコサミンと24時間培養し、いくつかの時間で追跡すると、表皮および真皮のHAの半減期が約1日であることがわかった(Fig. 3)3。
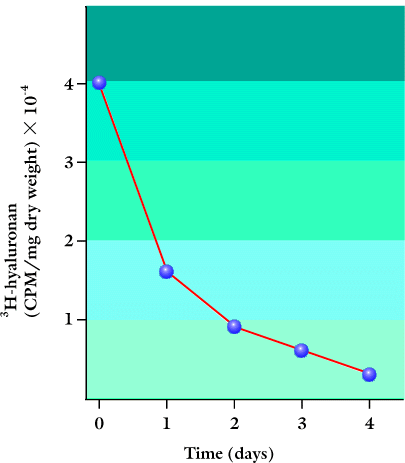
Fig. 3 表皮におけるHAの代謝。
ヒト成人皮膚を取り出して〔3H〕グルコサミンと24 時間培養し、その後4日間器官培養しながら追跡した。EDTA溶液で真皮から表皮を分離し、種々の時間帯に回収された3H- HAの量を示した。
表皮は血管のない、閉鎖された区画であり、基底ケラチノサイトの下の基底層を透過できないような大きな分子は、組織に入り込めない。外側表面には、一様に狭いバリアーが形成されている。最終分化したケラチノサイトの層(角質層のコルネオサイト)は水の移動までも阻止する。これらの二つの境界により、高分子量HA(200万Da以上)の代謝全体、すなわち合成と分解は、組織中のケラチノサイトでのみ行われることになる3。
分解メカニズムの詳細を決定できるような直接的定量データはないが、外部添加した蛍光ラベルHAは単層培養のケラチノサイトの表面に結合し、追跡実験ではケラチノサイトに取り込まれ、おそらくライソゾームで分解される。興味深いことに、スーパーオキシドジスムターゼのようなフリーラジカルスカベンジャーをヒト皮膚培養系に添加すると、表皮部分の内在性HAの代謝を遅らせたことから、活性酸素(フリーラジカル)がケラチノサイトによるHAの分解を仲介していると考えられる4。
表皮の構造、厚さおよびケラチノサイトの代謝回転速度は、発育の段階と組織の生理状態によって変化する。HAはケラチノサイトの増殖、移動および分化に密接に関わっており、したがってこれら全ての調節変化に関与している。それゆえHA代謝はホルモン、サイトカインおよび成長因子のようなシグナル分子群によりコントロールされている。
レチノイン酸(ビタミンA酸ともいわれる)は表皮の最終分化の阻害剤であり、ケラチノサイト間のデスモソームの数を減少させ、外側ケラチノサイトの成熟と死滅に関係しているケラチン合成を阻害し、また正常な構造および機能をもつ角質層の形成を妨げる。レチノイン酸はHAの合成を促進し、ヒト皮膚の器官培養で表皮中の含量を2倍にした5。レチノイン酸処理の結果、細胞間のスペースがHAで一杯になったことが、デスモソームの数の減少の一因となって、ケラチノサイト同志の密な接着が妨げられ、それ故に適切な最終分化が阻害されると考えられる。
ハイドロコルチゾン(コルチゾール)は皮膚病において、抗増殖および抗炎症薬として広く使われている。ハイドロコルチゾンは全ての投与量でHAの分解を阻害するが、薬理学的投与量においては、HAの合成も阻害する6。こうして、生理学的投与量では表皮のHA濃度を安定化させる一方で、薬理学的投与量では実際その含量を減らし、正常な分化を促進する。薬理学的投与量では、レチノイン酸とハイドロコルチゾンはHA合成と表皮の分化のどちらに対しても反対の作用を示すという事実から、HAは最終分化を阻害し、したがってHAの減少または除去がこのプロセスの一つの必要条件である可能性が支持される。
上皮成長因子(EGF)と形質転換成長因子−α(TGF-α)は、ケラチノサイトの増殖と移動を促すことにより、創傷治癒と再上皮化を促進する。HAのよく知られた一般的機能は、細胞の移動を促進する能力である。EGFが最終分化を阻害し、HA合成を増加させる傾向を持つことは、ハイドロコルチゾンとレチノイン酸処理で言われている一般的パターンと合致しており、促進されたHA合成はケラチノサイトの角質化の遅れとその後の表皮の肥厚化を伴い、一方最終分化は、HA合成の減少と、除去の亢進に関連しているという概念を更に支持している。
大抵の胎児組織はHAに大変富み、ゲル様の高度に水和したマトリックスを形成し、胚細胞の迅速な増殖と移動に必要な空間と柔軟性を与えている。胎生期皮膚の分化初期には、間充組織と外胚葉の両方の画分がそのマトリックス中に高濃度のHAを含んでいるが、これは組織の形態形成に伴って大きく減少する。さらに分化が進むにつれ、HAと細胞上のレセプターおよび細胞外マトリックス分子の間の相互作用が大きく変化する。
HAレセプターであるCD44は、表皮の分化において特に重要である。表皮のケラチノサイトには、エピカンと呼ばれるCD44の特別に大きな変異体と他のより小さなスプライス変異体が非常に豊富である。成熟したCD44分子は、くり返し2糖(N-アセチルグルコサミン-ガラクトース)から成るポリラクトサミン鎖と、1本のヘパラン硫酸鎖で高度にグリコシル化されている。このためCD44、中でもエピカンはヒト表皮における主要な35S-硫酸ラベルプロテオグリカンの一つとなっている7。
発育初期にはヒト皮膚は、未分化間充組織に面した上皮と、羊水に面した胎児表皮の二つの細胞層で覆われている。どちらの細胞もその表面にHAを持っているが8 、レセプターであるCD44は見られない。CD44レセプターは層状化遺伝子(例えば特異的なケラチン型)の一式が活性化され、最初の中間細胞層が基底細胞層の上に直接現れたときだけ、上皮細胞上に現れる。この所見は、成人の上皮においてCD44とHAが、重層した上皮では豊富だが単層の上皮ではそうでない、という観察と一致している。このことは、このHAレセプターが表皮の成長と正常な分化のマーカーであることを示唆している。進行した扁平上皮ガンにおけるケラチノサイトの脱分化では、CD44のダウンレギュレーションと細胞表面からのHAの消失が伴っていることは興味深い。
皮膚付属器(即ち毛包、脂腺および汗腺など)の外胚葉部分は、原始上皮から段階的な誘導により進化する。これらの組織誘導の最初の形態的徴候は、HAとCD44の消失を伴った、上皮細胞の密な凝集体の形成である。同様な細胞の凝集は、肢芽間充組織の軟骨誘導時に起きる(後日このシリーズでTooleが述べる予定)。どんな理由にせよ、細胞と細胞の密な接着が必要な場合には、上皮のHAとそのCD44レセプター生成は阻害されるようだ。
HAの明確な機能の一つは、表皮の重層構造中において下層細胞間の細胞外空間を維持して、上層の細胞への栄養供給物の拡散と老廃物の排出を促進することである。高濃度のHAが存在するために膨張する傾向を示すこの空間(細胞外空間)では、デスモソームと隣接する細胞間の粘着結合が不安定となり、その代謝回転を促進する可能性がある。HAはこうして円柱状の基底細胞部分から現れ、平らなコルネオサイトで終わるケラチノサイトの一生を通して、常時細胞の更新を促進しているのだろう。
細胞分裂の後、娘細胞としてのケラチノサイトは、基底層に留まるかまたは上方へ移行し、最終分化して角化する(アポトーシス様のプロセス)。角化のタイミングが表皮の厚さを決定する。角化の開始を決定する全ての要因は、今のところわかっていないが、最近の研究によると特異的細胞表面レセプターを介したマトリックスへの接着が結合組織細胞の成長と生き残りに必要な一つの条件であるようだ。基底細胞層より上の表皮ケラチノサイトにおいては、HAが細胞外マトリックスの主成分である。現在得られているデータは、細胞表面レセプターと相互作用しているHAはケラチノサイトに対して生存シグナルとして働き、最終分化を遅らせるという可能性を示している。
RHAMM(HA介在運動性レセプター)は、細胞接着の代謝回転の亢進と、rasおよびfakを含むシグナル伝達経路を伴ったチロシンキナーゼ活性を通じて、多くの間充組織細胞型の運動性を亢進する9。シグナリングをブロックするためのRHAMMに対する中和抗体の作用が示したように、ケラチノサイトはこの経路を通して外来性HAに反応する。さらに、表皮ケラチノサイトにRHAMMの発現が抑制されたトランスジェニックマウスでは創傷治癒が遅れたことから、再上皮化段階での細胞移動が適切に機能していないことが示された。表皮CD44レセプターが阻害されたマウスでは、創傷に対する活発な対応もできなくなった。これらの結果からRHAMMとCD44は、ケラチノサイトのHAによって促進される移動のシグナルに関与することが示唆された。
フリーラジカルの効果的スカベンジャーとしてのHAは、表皮中で、紫外線により生じた反応性酸素を除去することで防御的役割を果たすのであろう。HAの速い代謝回転は表皮から有害物質を取り除く助けになるだろう。免疫系の細胞(例えばランゲルハンス細胞とリンパ球)は表皮に入ったり出たりする。HAは細胞外スペースを作り出すことによりこれらの細胞が移動するのを促進し、それらのCD44レセプターに対する低親和性結合サイトを提供する。
培養モデルにおいて、ケラチノサイトが正常に分化発達を行なうためには通常、下層のフィーダーセルからサポートとシグナルを受ける必要がある。ルーチンの実験でフィーダーセルによる複雑化をさけるため、われわれは新生児ラット表皮に由来するケラチノサイト細胞株を研究してきた。この細胞株は、フィーダー細胞なしで基本的に正常な形態学的重層化と分化を遂げる10 。この種の「器官培養」は、ケラチノサイトを多孔性の膜上に形成された再構築天然コラーゲンマット上に植え付けることにより開始される。気相−液相界面で培養すると、細胞は約10日間で3-5の生細胞層から成る正常な角質層を形成する(Fig. 4a)。細胞はin vivoと同じように、介在するコラーゲンマットと挿入膜を通して栄養源と老廃物を培地中で交換している。
コラーゲン基質は多孔性であり、正常な表皮では基底ケラチノサイトは連続的な基底膜に付着し、下層真皮中のコラーゲンからへだてられている。この状態を再現するため、まず初めにMDCK細胞をコラーゲン基質上に蒔き、その表面を自然の基底膜様の状態にした後、MDCK細胞を除去し、ケラチノサイトを蒔く。基底細胞と2種類の基質との境界を比較すると、基底膜のある場合は正常なヘミデスモソームを介した接着を示すのに対し、基底膜のない場合には疱状や突出した細胞膜が見られる(Fig. 4b)。
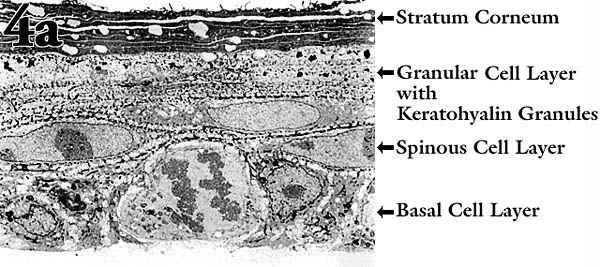
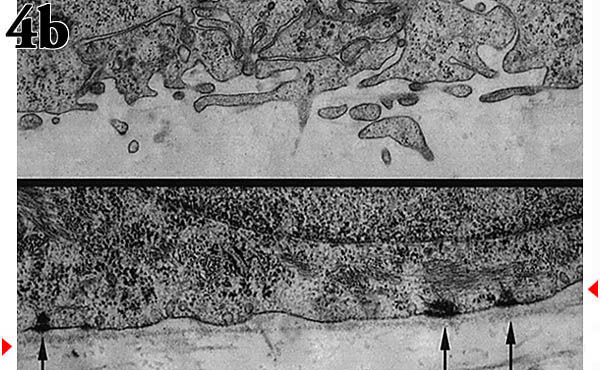
Fig. 4 表皮におけるHA代謝の重要性を検索するための培養モデル。
(a) ケラチノサイトを気相−液相界面に置いた膜(コラーゲンコートしてある)上で培養し、形成された「表皮様構造」の透過型電顕像。
(b) 基底膜がある(下図)、またはない(上図)状態における基底ケラチノサイトとその下のコラーゲンマットの間の境界部の透過型電顕像。矢印はヘミデスモソームを、矢頭は基底膜を示す。
二つの型の培養から得た切片におけるHAの局在から、基底膜が存在するときにはHAが封じ込められていることが示された(Fig. 5)。
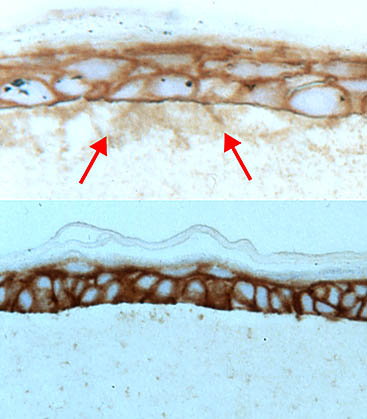
Fig. 5
基底膜がある(下図)か、またはない(上図)状態でコラーゲンマット上に成長したケラチノサイトから得た切片。HA特異的プローブで染色してある。
矢印はコラーゲン層の中のHAを示す。
このことはHAの代謝に顕著な効果を有する。基底膜上での表皮ケラチノサイトの重層培養では、基底膜なしの培養に比べて下層のマトリックスや培養液へのHAの漏れは非常に少ない(Fig. 6)。さらに、その結果基底膜と一緒に培養した細胞の周りのHA濃度は大変高く、in vivoでの表皮の濃度に相当するレベルまで達する。上皮では〔3H〕グルコサミン標識HAは約10時間で定常状態に達することから(Fig. 6)。この系におけるHAの代謝回転は器官培養におけるヒト表皮よりも更に速いといえる。合成、分解またはその両方は、こうしてケラチノサイトにより制御され恒常的平衡が達成される。
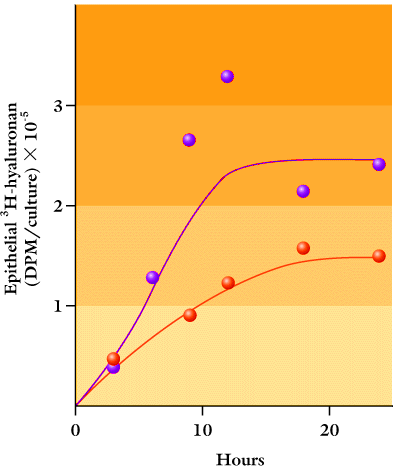
Fig. 6
基底膜がある(青丸)、ない(赤丸)基質上で重層、分化した細胞層における〔3H〕グルコサミン標識HAの量。標識は0時間から開始し、特定の時間ごとに停止させた。プラトー値は、24時間の時点での培養物中の全標識HAのそれぞれ約70%と20%であった。
HAは、表皮の重層化されたケラチノサイトの間の狭い細胞外の空間に非常に高濃度で存在しており、その代謝回転は1日以内である。この動的な代謝から示唆されるのは、HAが分化するケラチノサイトの上方への移動と形態変化における空間確保充填物であること、上部有棘細胞の栄養上および制御用代謝産物の交換のための細胞外スペースを提供し、またさらにHAはケラチノサイトの運動性と生き残りを強化するためのシグナルリガンドとして働いているということである。