
Masellis博士はバンクバーのBritish Columbia大学を卒業後、アルバータ州エドモントンのAlberta大学で博士号を取得した。博士課程ではtetraspan 分子CD9の役割とB細胞接着におけるインテグリン接着分子を主として研究した。また、B細胞と骨髄間質細胞との相互作用についても研究し、興味が高じてさらに多発性骨髄腫の骨髄由来形質細胞の接着と遊走をポスドク研究として行うことになった。1998年、ミネアポリスのAbbott Northwestern病院のVirginia Piperガン研究所に入り、現在はMinnesota大学医学部の兼任助教授でもある。現在は、主に腫瘍細胞と骨の相互作用および間充織細胞の分化と疾患におけるヒアルロン酸と細胞の相互作用を研究している。
腫瘍形成には、内因的にも外因的にもガン細胞と協調した生体反応の動きが絶対的に必要な多くの工程がある。腫瘍の微小環境が腫瘍の進展に重要な役割を果たすことは良く認識されている。特に液性因子と並んでサイトカインや成長因子を含む細胞外因子、細胞外マトリックス分子およびリガンドとしての細胞のこれら全てが腫瘍の生物学的動態に影響を及ぼす。ヒアルロン酸は細胞外マトリックスの主要成分でありN-アセチルグルコサミンとグルクロン酸の繰り返しユニットからなる大きな陰性荷電を持つグリコサミノグリカンである。ヒアルロン酸はマトリックスの形成、細胞増殖、細胞遊走および胚/組織の発生で重要な役割を果たしている。最近の研究ではヒアルロン酸とヒアルロン酸-細胞間の相互作用が細胞遊走や細胞増殖だけでなく細胞の侵襲能やガン化にも影響を及ぼしている証拠が示されてきている。ヒアルロン酸の生物学的機能は、その物理学的性質(大きな陰性荷電を持つ大分子)や他の細胞外マトリックス分子(アグリカン、バーシカン、ニューロカン、ブレビカン、TSG-6、リンクプロテイン)との会合、そして細胞表面受容体(CD44、RHAMM (Receptor for Hyaluronan Mediated Motility)、Lyve-1)との相互作用を通じたシグナル伝達への関与によるらしい。
骨髄微小環境は細胞と、造血細胞の増殖や分化そして生存を維持する細胞外マトリックスとの多機能ネットワークである。(図1)1。骨髄に由来する重要な細胞系統の一つに間充織前駆細胞由来のものがあり、その中に軟骨細胞、脂肪細胞、線維芽細胞、骨細胞が含まれている2。これらの細胞は外部微小環境のシグナルおよび内在性の細胞系統コミットメントシグナルに対応して種々の系統に分化する。しかしながらこれらのシグナルはよく分かっていない。成長因子、サイトカイン、細胞性および細胞外マトリックスを含む多くの因子が骨髄間充織細胞の増殖、分化および機能に影響するらしい。
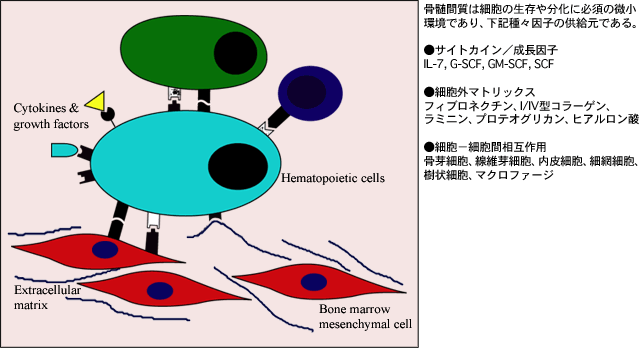
図 1 骨髄造血
骨髄細胞外マトリックスは主にフィブロネクチン、I型とIV型のコラーゲン、ラミニン、グリコサミノグリカンであるヘパラン硫酸、コンドロイチン硫酸およびヒアルロン酸から構成される。ヒアルロン酸は、このマトリックス機能の主たるグリコサミノグリカンで、骨髄の造血と細胞分化に影響を及ぼす様々な役割を演じる。造血においてCD44とヒアルロン酸と相互作用していることが抗CD44モノクローナル抗体を用いて、あるいはヒアルロニダーゼの処理で示されたが、いずれの処置でもin vitroでのリンパ球生成および骨髄造血が有意に低下した3,4。
我々の研究室は、骨髄間充織細胞でヒアルロン酸とヒアルロン酸合成酵素(HAS)の酵素の発現が、あるいはヒアルロン酸が仲介する細胞の相互作用が、どのように多発性骨髄腫の形質細胞や他の骨転移性のガンの局在と生存の影響を及ぼすかに興味を持っている。過去数年以上に渡り、骨を侵襲するガンにおけるヒアルロン酸の役割を明らかにするため、健常人と多発性骨髄腫患者から得た骨髄間質細胞培養のin vitroモデル系を使って、研究を進めている。
ヒアルロン酸とヒアルロン酸合成酵素はガンの進展で重要な生物学的役割を果たしているらしく、ある種の悪性腫瘍では、ヒアルロン酸が疾患進行度の臨床診断的マーカーとなっている。ヒアルロン酸とヒアルロン酸合成酵素遺伝子が腫瘍形成と血管新生の過程に複雑に関与していることを示す証拠が増えている5-7。特に種々のガン組織ではヒアルロン酸産生が正常細胞に比べて増えており、HAS遺伝子発現の結果としてヒアルロン酸レベルが上昇しており、ガン細胞の浸潤との相関性が示された8-14。例えば線維肉腫ではHas2を、あるいは前立腺ガン細胞ではHas3を過剰発現させると、親株細胞に比べてガン組織は大きくなり、一方、Has1を導入した乳ガンでは転移能が増加した。実験の大部分は固形ガンのモデルを使ったが、同様にヒアルロン酸が血液ガンにも関与していることを示す証拠がある。ごく最近の多発性骨髄腫分かったことは、血清中のヒアルロン酸レベルはこの疾患の悪性化と相関していることである15。
多発性骨髄腫は不治の形質細胞のガンで白人の悪性リンパ腫の13%に相当する16。この疾患では骨髄内にモノクローン性の骨髄形質細胞(以後骨髄腫形質細胞と呼ぶ)が出現し、モノクローンタンパク質、高カルシウム血症、骨融解病変および貧血が見られることが特徴である。B細胞成熟過程における多発性骨髄腫発生の概略を図2に示す。骨髄腫は完治療法がなく、生存期間中央値は3-4年である。
骨髄の微小環境は骨髄疾患の進展に重要な役割を演じているらしい。骨髄中に骨髄腫形質細胞が好んで集積する事実は、この場所にいる骨髄間充織細胞が骨髄腫クローンの増殖と維持を最も良くサポートすることを意味する。共培養系により、物理的な細胞−細胞の接触、可溶性とマトリックス会合型の成長因子/インターロイキン、そして細胞とマトリックス間の相互作用が、骨髄腫の骨髄形質細胞の成長と生存、ならびに化学療法治療剤に対する反応性に影響を及ぼすことが示された(図1参照)。更に骨髄腫の骨髄形質細胞にはCD19+ B細胞(以後骨髄腫B細胞)が骨髄腫患者の末梢血中にあるが、このものは末梢血から骨髄へ細胞を侵入させる悪性腫瘍クローンの成分を含むらしいという推測がある。
他の研究室そして我々の研究室でも、骨髄腫患者から得られた骨髄間充織細胞では接着因子の受容体発現、サイトカイン発現そして細胞外マトリックスの発現が変化していることを明らかにした。骨髄腫細胞に対して骨髄微小環境が重要な役割が担うと言う考えが次第に受け入れられているにもかかわらず、この疾患の病態生理を形成している骨髄間質の性質やこの間質で生じる特有の異常を見つけることに焦点を当てた研究はほとんどない。
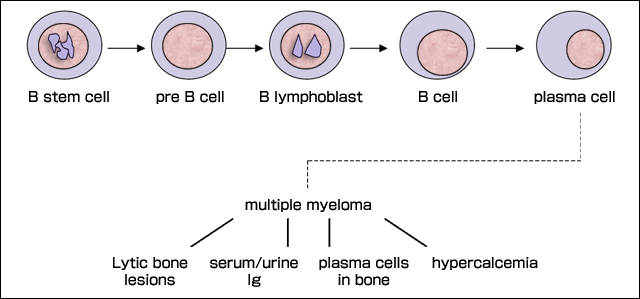
図 2 B細胞の成熟と多発性骨髄腫
ヒアルロン酸全体の代謝はヒアルロン酸合成酵素とヒアルロニダーゼの酵素活性によって決められる。3つのヒアルロン酸合成酵素遺伝子が分かっているがそれぞれヒアルロン酸合成を行う形質膜タンパク質がコードされている17。いずれのヒアルロン酸合成酵素の発現もヒアルロン酸合成に十分であるが、大部分の系における3つのHAS遺伝子産物のヒアルロン酸産生と発現に対する寄与は明らかになっていない。ヒアルロン酸合成酵素はそれぞれが固有の酵素特性を持っているので、動態の異なるヒアルロン酸が合成されるらしい。例えばHas3は低分子ヒアルロン酸 (< 2 x 105)を、一方Has1とHas2はもっと大きな分子量のヒアルロン酸 (>2 x 106)を合成する。同様に種々のヒアルロン酸合成酵素の酵素機能の潜在的な違いがin vivoでは非常に重要であるらしく、ヒアルロン酸に起因する様々な機能におそらく関係しているだろう。
多発性骨髄腫患者の骨髄細胞外マトリックスの必須成分としてのヒアルロン酸の役割を理解する最初の一歩として、健常人および多発性骨髄腫患者の骨髄間充織細胞のヒアルロン酸合成酵素遺伝子発現とヒアルロン酸産生の特徴を明らかにした。両者の骨髄間充織細胞のヒアルロン酸合成酵素遺伝子発現は定量的競合的Rt-PCR法で測定した。その結果、多発性骨髄腫患者では主としてHas1が、一方、健常人では主としてHas2が発現していることが示された(図3)。
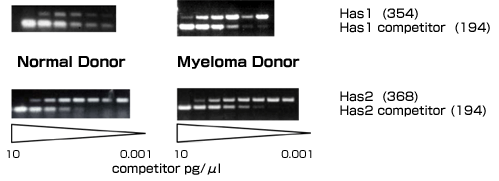
図 3 多発性骨髄腫患者および健常人の骨髄間充織細胞のHas1とHas2に対する競合Rt-PCR
総RNAは集密度80%以下の培養した骨髄間充織細胞から抽出した。cRt-PCRは文献18に従って行った。cRt-PCRは1 μg/ml 総RNAと組み換えHAS DNAを内部競合として用いた(文献18に準拠)。HASの競合濃度は10 pg/μLから1x10-6 pg/μLとした。(図には0.001-10 pg/μLの範囲を示した。)
様々なHASのアイソフォーム発現とヒアルロン酸合成の全体、およびマトリックスの形成との関連性はまだ十分に分かっていない。骨髄腫の骨髄間充織細胞ではHas1を発現し、一方、健常人ではHas2が発現していることから、Has1が骨髄腫細胞にとって重要なヒアルロン酸の表現型となっているらしい。Has1が発現した結果が、最終的に骨髄腫形質細胞の生存率、骨髄腫形質細胞と骨髄間充織細胞の相互作用に影響を及ぼし、また健常骨髄間充織細胞の機能に対しても影響しているらしい。しかしながら、細胞−細胞間の接触で始まるシグナル、あるいは形質細胞で発現された可溶性サイトカインがHAS遺伝子の発現の制御に係わっているかどうかはまだ分かっていない。例えば、骨髄腫の骨髄間充織前駆細胞と形質細胞ARH77の共培養は、骨髄間充織細胞のHas1 mRNA発現を80% (±5%)低下させるが、Has2 mRNAは変化しない。更に骨髄間充織細胞と骨髄腫形質細胞の共培養はサイトカインをアップレギュレートすることから、骨髄腫間充織細胞のHAS遺伝子制御に係わるオートクラインフィードバック機構の可能性が推測され、興味がそそられる(図4)。
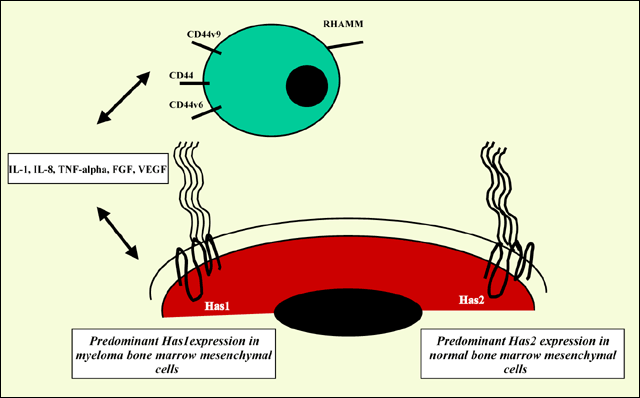
図 4 骨髄腫の骨髄微小環境におけるヒアルロン酸合成酵素、ヒアルロン酸受容体とヒアルロン酸応答性のサイトカインの概略図
HASのアイソフォーム発現はヒアルロン酸合成に相関している。健常人骨髄間充織細胞に比べ、骨髄腫骨髄間充織細胞はヒアルロン酸を9.6倍も分泌しているが(表1)、マトリックスの主要グリコサミノグリカン成分のコンドロイチン硫酸は両グループ間で差がない18。細胞マトリックスと会合しているヒアルロン酸量は、骨髄腫骨髄間充織細胞においては健常人細胞とほとんど同じである。従って過剰なヒアルロン酸は培地中に分泌されている(表1)。
表 1 骨髄間充織細胞の培地と細胞におけるヒアルロン酸の相対量

間充織細胞中で、種々HAS合成酵素のどの様な発現が、特異的にヒアルロン酸の発現やその後のマトリックスの組織化を制御するか、また骨髄腫患者の骨髄中の骨髄腫形質細胞とのヒアルロン酸を介した相互作用を制御するか、を明らかにすることはことさら興味深い。ヒアルロン酸マトリックス形成でのヒアルロン酸結合タンパク質の役割は、骨髄間充織の生物学領域ではまだ明らかにされていないが、HASのアイソフォーム発現やヒアルロン酸合成と同様に重要らしい。
HASのアイソフォーム発現はヒアルロン酸合成に相関している。健常人骨髄間充織細胞に比べ、骨髄腫骨髄間充織細胞はヒアルロン酸を9.6倍も分泌しているが(表1)、マトリックスの主要グリコサミノグリカン成分のコンドロイチン硫酸は両グループ間で差がない18。細胞マトリックスと会合しているヒアルロン酸量は、骨髄腫骨髄間充織細胞においては健常人細胞とほとんど同じである。従って過剰なヒアルロン酸は培地中に分泌されている(表1)。
近年、血清中の異常に低いあるいは高いヒアルロン酸濃度は、多発性骨髄腫の疾患の進行と相関することが明らかになってきた15。異常なヒアルロン酸濃度が患者の短命化を誘導することを示す指標はまだないが、血清中ヒアルロン酸レベルはこの疾患の病態変化を示しているらしい。その点では血清中のヒアルロン酸レベルは、不運な結果に至る特定の骨髄腫患者グループの予後徴候となるかも知れない。骨髄腫におけるヒアルロン酸の臨床的有用性はまだ明らかでないが、ヒアルロン酸とヒアルロン酸受容体がこの疾患の種々な生物学的局面で関与していることは、多くの研究から明らかである(以下参照)。
骨髄腫におけるヒアルロン酸受容体と接着:骨髄腫細胞は、ヒアルロン酸受容体CD44やRHAMMを含む複数の接着受容体を発現している19。CD44に関しては、骨髄腫形質細胞ではもっぱらCD44v3、 CD44v6および CD44v9が発現し20、一方正常骨髄形質細胞ではこれらのアイソフォームは出ていない。臨床的には、骨髄腫形質細胞でのCD44v9の発現と悪性化の進行とは相関している。特異的なCD44のアイソフォームと同様、正常人のB細胞には見つからないRHAMMの固有なアイソフォームが骨髄腫形質細胞に発現していることをCrainieらは示した21。骨髄腫形質細胞ではRHAMMの全長アイソフォームに加えて、48bp欠損のあるRHAMM-48と、147bp欠損のあるRHAMM-147とを発現している。しかしながら今のところ、ヒアルロン酸結合におけるこれらのアイソフォームの役割は明らかではない。興味深いことに、RHAMMはまた骨髄腫骨髄線維芽細胞のあるサブセットでも発現している。RHAMMの発現は骨髄間充織間質細胞の培養系では、細胞内に限られており(図 5)、蛍光顕微鏡でもフローサイトメトリーでも細胞膜での発現は見られない。骨髄腫形質細胞でRHAMMの発現に関して言うと、細胞内RHAMMの発現は骨髄腫骨髄線維芽細胞に限られ、健常人の線維芽細胞にも慢性リンパ球白血病、悪性リンパ腫、急性骨髄性白血病あるいは毛状細胞白血病患者からの骨髄線維芽細胞にはない(図 5)。現在、ヒアルロン酸結合における細胞内RHAMM、あるいは骨髄間充織間質細胞が発現しているRHAMMの特異的アイソフォームの機能は、まだはっきりしていない。
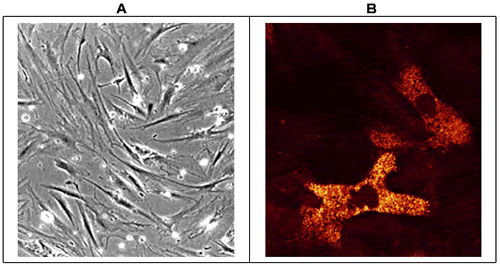
図 5 骨髄腫骨髄間充織細胞におけるRHAMMの発現
骨髄腫由来の骨髄間充織間質細胞を10% FBS添加α−MEMでサブコンフルエントになるまで培養し、その集密度は光学顕微鏡で確認した(倍率10倍)[A]。単層培養細胞は4 ℃、70 %エタノールで透過性を上げて1%ホルマリンで固定した後、抗RHAMMモノクローナル抗体3T3.5で染色し、続いてphycoerythrin結合抗マウスIg抗体とインキュベートしてRHAMMの分布をみた。染色により可視化された細胞は、レーザー共焦点顕微鏡で免疫蛍光像として観察された(倍率40倍)。骨髄腫間充織間質細胞のサブセット( 20%)は[B]に示したように細胞内RHAMMを発現していたが、同一細胞でCD44は検出されなかった(データ略)。イメージ5Aと5Bは同一培養からのものではない。
我々は末梢血CD19+B細胞がCD44依存的に、単層の骨髄間質細胞に接着することを示した。この接着は、骨髄腫の間質細胞でなく末梢血B細胞を抗CD44モノクローナル抗体で処理した時、(30%)減少した。興味深いことにRHAMMに対する抗体では接着が阻害できなかった。更に末梢血B細胞でなく間質細胞をstreptmyces ヒアルロニダーゼで処理すると骨髄腫B細胞の接着が減少したことから、間質細胞上のヒアルロン酸が骨髄腫B細胞上のCD44と相互作用していることが示された。CD44アイソフォーム特異的抗体を使った同様の研究から、骨髄腫骨髄形質細胞の骨髄間質細胞への接着は形質細胞上に発現しているCD44v6とCD44v9を介して起こることが分かった22。さらに我々は骨髄腫形質細胞株が健常人および骨髄腫患者からの骨髄間充織間質細胞に接着し、形質細胞でなく骨髄間充織細胞をヒアルロニダーゼで処理すると一部阻害されることを明らかにした(図6)。おもしろいことにヒアルロン酸を介した接着が骨髄腫細胞の主たる接着メカニズムであり、この疾患におけるヒアルロン酸が仲介するメカニズムの重要な役割が、さらに支持される証拠となった。
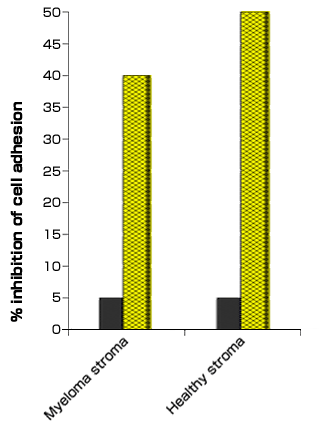
図 6 骨髄間充織間質細胞へ接着する骨髄腫形質細胞におけるヒアルロン酸
骨髄間充織間質細胞は、あらたに診断された未治療の骨髄腫患者および健常人の骨髄由来を使用した。培養はまず10% FBS 添加α-MEM培地に1 x 106 cells/mlで播種した。幾つかの実験では間充織間質細胞単層を0.1 U/ml コンドロイチナーゼABCで(黒棒)、あるいは40 TBU streptmyces ヒアルロニダーゼ(斜線棒)で2時間前処理し、その後5μM BCECF-AMで骨髄腫形質細胞を標識した(Molecular Probes, Eugene, OR)。コンドロイチナーゼABCもヒアルロン酸を分解できるが、コンドロイチナーゼABCで細胞を処理した場合、細胞接着は5%しか抑制されなかった。一方streptmyces ヒアルロニダーで処理した場合は40-50%抑制された。
骨髄腫におけるヒアルロン酸依存性の細胞移動:我々は、骨髄腫B細胞と白血病形質細胞では、細胞はヒアルロン酸上を移動し、フィブロネクチンやラミニンのような他のマトリックス分子上では移動しないことを示した。骨髄腫細胞の移動はヒアルロン酸結合と共に起こり、ヒアルロン酸の結合は機能抑制性の抗CD44抗体および抗RHAMM抗体で抑制される。しかしながら抗RHAMMモノクローナル抗体だけがヒアルロン酸上の移動を阻害出来ることから、CD44でなくRHAMMがヒアルロン酸上の運動を仲介していることが示された19。同様に、骨髄腫骨髄形質細胞はCD44およびRHAMMに依存した形でヒアルロン酸と結合する(図7a)。骨髄腫患者からの末梢血B細胞や末梢血中骨髄腫細胞と違い、骨髄腫骨髄中形質細胞はヒアルロン酸基質上を移動しない19。しかしながら骨髄腫形質細胞の小サブセットはヒアルロン酸でなく、フィブロネクチンに応答して方向性を持つ移動(トランスマイグレーション)をする(図7b)。事実ヒアルロン酸はコントロールとして使われたBSA上での細胞移動を抑制する様に見える(図7b)。骨髄腫患者の末梢血中および骨髄中のB細胞系列は等しくCD44とRHAMM受容体を発現しヒアルロン酸と結合するが、これらの受容体の機能は細胞のタイプに特異的な制御の下にあり、それぞれ異なる細胞応答を仲介しているらしい。
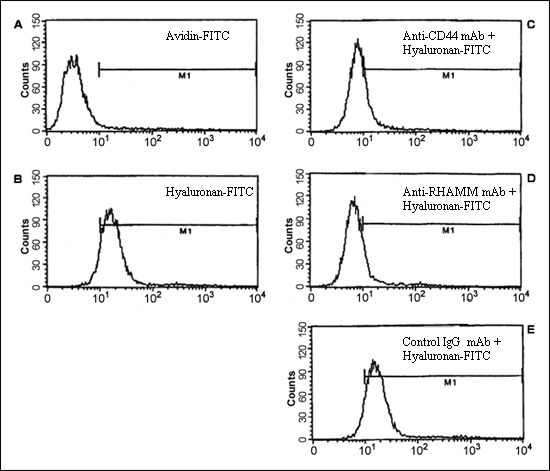
図 7a 骨髄腫形質細胞へのヒアルロン酸の結合
形質細胞のヒアルロン酸-FITC (100 μg/ml)への結合能(B)を、10μg/ml抗CD44抗体(50B4)有(C)、10μg/ml抗RHAMM抗体(3T3.5)有(D)の場合と共に調べた。対照には、アビジン-FITC (100 μg/ml) (A)と非特異的IgG1イソタイプ正常マウスモノクローナル抗体 (E)を用いた。
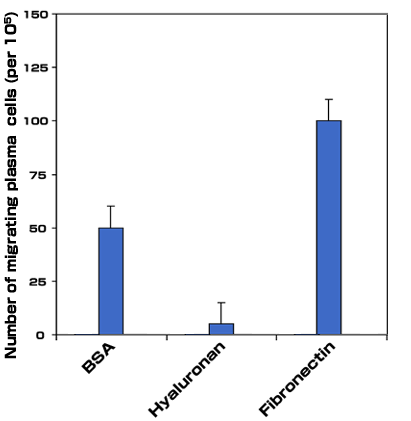
図 7b ヒアルロン酸とフィブロネクチンに対応した骨髄腫細胞の移動応答
骨髄腫形質細胞の移動能を調べるために、改良ボイデンチェンバーアッセイを用いた。1 x 105 形質細胞を100μg/ml のヒアルロン酸あるいは20μg/mlのフィブロネクチンを含む上方のチェンバーに入れ、1.5時間培養後フィルター下面に移動した細胞を倒立顕微鏡下で計測した(倍率20倍)。結果は視野あたりの平均細胞で示した(最低計測視野数は10)。
骨髄腫においてヒアルロン酸が仲介するシグナル伝達:ヒアルロン酸は長期間にわたって細胞外マトリックスの成分として認識されて来たが、実は活性を持つ、不活性な成分以上のものとして関心が強まったのはごく最近のことである。最近の研究から、ヒアルロン酸受容体が仲介するシグナル伝達の誘導が、ヒアルロン酸刺激の結果として造血細胞で始まることが分かった。骨髄腫形質細胞の生存や増殖は、細胞−細胞間や細胞−マトリックス間の接触と同様に、部分的には可溶性因子に依存しているらしい。IL-6は骨髄腫細胞に対する重要な生存因子として性質が良く分かっているが、主に骨髄間充織間質細胞によって産生されている。IL-6枯渇条件下、ヒアルロン酸にはIL-6依存性の骨髄腫細胞(この条件では骨髄腫形質細胞のアポトーシスが誘導される)を生存、増殖させる効果のあることが示された23。ヒアルロン酸存在下(5-80μg/ml)で、アポトーシスの抑制と細胞増殖が見られた。このヒアルロン酸が仲介する生存と増殖の作用はp27kip1発現のダウンレギュレーションと、Rbタンパク質の過リン酸化と関係しており、これらの分子は細胞周期の移行におけるG1期を越えた進行に係わっている。興味深いことに、骨髄腫形質細胞の細胞株におけるヒアルロン酸の生存と増殖に対する効果に、CD44とヒアルロン酸の相互作用は必要ないが、IL-6受容体gp-130サブユニット経由のシグナルが関与していた。従ってヒアルロン酸で開始されるIL-6産生とその利用についてのオートクリンフィードバックのループがある可能性が示唆された。
我々のグループは、骨髄腫の細胞移動を促進するようなヒアルロン酸濃度での形質細胞セルラインARH77をヒアルロン酸で刺激するとRaf-1とMAPキナーゼが活性化されることを明らかにした(表2)。Raf-1キナーゼの活性化は速くて再現性があるが、最初の3分間で起こり、15分後までには元のレベルに戻るMAPキナーゼキナーゼ−GSTのリン酸化を伴っていた。MAPキナーゼ活性の増加は2-10倍の範囲であった(表2)。更にヒアルロン酸刺激は、MEK
阻害剤PD98059で阻害が可能であるIL-1β mRNAのアップレギュレーションをもたらし(表8)、IL-1βのアップレギュレーションはMEKが関与したシグナル伝達経路を通じて生じたことが示された。骨髄腫形質細胞のIL-1β産生は疾患の病態生理学に重要であるが、IL-1βは強力な破骨細胞活性化因子であり、多発性骨髄腫にしばしば伴い重篤な臨床症状である骨融解病変の発生に一役買っている。またIL-1βは骨髄腫細胞増殖に必須なサイトカインであるIL-6を含むサイトカイン産生をアップレギュレートしている。このように、骨髄腫患者では骨髄間充織細胞で発現されたヒアルロン酸が形質細胞上のヒアルロン酸受容体と相互作用した結果が、一連の病態変化の発端となることが推察されるが、それは骨髄腫形質細胞の増殖と同様、骨疾患の悪化に関係したサイトカインのアップレギュレーションを引き起こしていると考えることができる。
表 2 ヒアルロン酸刺激は骨髄腫形質細胞のRaf-1およびMAPキナーゼを活性化する
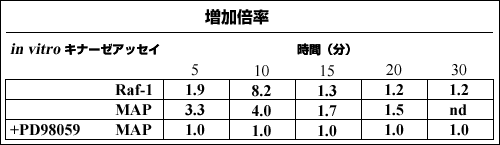
骨髄腫セルラインARH77は最低4時間、無血清で培養して飢餓状態とした後、ヒアルロン酸(100μg/ml)で刺激してキナーゼ活性を測定した。幾つかの実験では、刺激の前に細胞をMEK阻害剤PD98059で30分間処理し、更にヒアルロン酸刺激中も培地中には阻害剤を共存させた。10-100μg/ml濃度のヒアルロン酸で刺激したところ、100μg/mlで最大Raf-1活性が見られた。従って以後の実験はこの濃度で行った。細胞溶解液を調製した;Raf-1 あるいはMAPキナーゼを免疫沈降させ、in vitroキナーゼアッセイはそれぞれ基質としてMEK-GSTあるいは MBPを使って実施した。全ての実験で、増加倍率はそれぞれ0時間のキナーゼ活性に対する相対値として表した。ndは未実施。
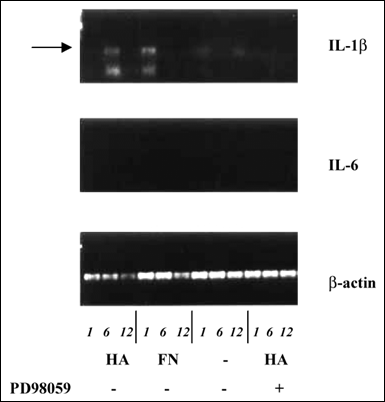
図 8 ヒアルロン酸刺激後の骨髄腫形質細胞におけるIL-1 βとIL-6に対するRt-PCR
IL-1 βとIL-6に対するRt-PCRは、ヒアルロン酸(100μg/ml)あるいはフィブロネクチン(FN, 20μg/ml)で1、6および12時間刺激した骨髄腫ARH77細胞で行った。未刺激のARH77細胞はIL-1 βとIL-6のいずれも発現しなかった。Rt-PCR産物は1.5%アガロースゲル電気泳動を行い、エチジウムブロマイドで染色した。3回行った実験の代表例の結果を示す。矢印で示したヒアルロン酸刺激6時間後とFN刺激1時間後のIL-1 βRt-PCR産物に注目。ヒアルロン酸によるIL-1 βメッセージ刺激はMEK阻害剤PD98059で完全に阻害される。IL-6に対するRt-PCR産物は検出されない。
多発性骨髄腫およびその他の血液学的悪性腫瘍の治療では、ガン細胞の消滅に着目しているが、ガンの増殖応答や正常細胞の機能における骨髄微小環境の影響力を考慮することは重要である。悪性形質細胞の存在に加え、骨髄腫における骨髄の微小環境はおそらくガン細胞および/あるいは化学療法剤に曝された結果異常を示すことが、我々のデータから示唆されている。特に多発性骨髄腫では、ヒアルロン酸合成が、あるサブグループの患者に対しては診断的価値を持つかも知れない。骨髄腫形質細胞を用いたin vitro研究では、ヒアルロン酸受容体の発現増加、細胞移動、細胞接着そして細胞シグナル伝達の変化を含む腫瘍形成に付随した多くの機能に、ヒアルロン酸が関与していることが示された。従って骨髄腫の治療では、ガン細胞の除去に頼るだけでなく、骨髄微小環境がガン細胞の増殖サポートから正常細胞機能のサポートに変わるような、骨髄微小環境の再構築にも頼ることとなろう。骨髄腫におけるヒアルロン酸の役割に対する洞察が増したことで、骨髄腫の新規な治療薬としてヒアルロン酸の利用がいつかは導かれるだろう。例えばヒアルロン酸のオリゴ糖が移動を阻害し、骨髄への形質細胞の接着を阻害し、あるいは細胞−細胞間の相互作用の結果として骨髄間充織細胞と骨髄腫形質細胞間に作られるサイトカインループの樹立を阻害するように、機能するかも知れない。更にヒアルロン酸は診断の道具として大きな役割を果たす可能性がある。そのような点では、おそらくHAS酵素の発現によって決まる分子量の異なるヒアルロン酸の存在は、予後の悪い患者の見分けに使えるかも知れない。この稿に引用した文献と我々の教室の実験結果から、我々は以下のことを提言する。骨髄腫において、骨髄のヒアルロン酸合成とマトリックスの形成は骨髄微小環境にユニークな機能をもたらす。その骨髄微小環境は骨髄腫形質細胞の増殖や生存に影響するばかりでなく、正常骨髄間充織細胞機能にも影響を及ぼしているらしい。