
Jackson博士は生化学者で、20年以上に渡っていくつもの異なる細胞表面タンパク質と膜レセプターについて研究してきた。彼は1978年にTrinity College Dublinから自然科学(生化学)でB. A.(Mod.)を取得した。続いて1983年に生化学教室で、H. Paul Voorheis博士のもとでPh. D. を取得した。彼の博士論文はアフリカ眠り病原虫Trypanosoma bruceiの変異表面糖タンパク質(VSG)に着目したものであり、切断可能なグリコシルホスファチジルイノシトール膜アンカーの発見につながった。John I. Bell教授と働くためにUniversity of Oxford, Nuffield Department of Medicineに移るまでの1983年から1987年まで、幾つかの他の寄生動物の表面抗原の同定の研究を行い、重要なヒト白血球表面レセプターをコーディングしているcDNAクローン発現のための新しい方法を開発した。Oxford大学在任中彼は細胞とマトリックスの接着レセプター、特にヒアルロン酸レセプターCD44に興味を持った。Oxford Wolfson Collegeの細胞生物学教室でのYamanouchi Research Fellowship(1992-1995)、続いてMRC Senior Fellowship(1995-2000)を通じ、成長因子と結合するヘパラン硫酸を持つCD44生成機構としての選択的スプライシングを同定し、さらにリンパ管内皮表面に発現している新しいヒアルロン酸レセプターLYVE-1の発見に至った。ごく最近、彼のグループ(Oxford大学の生化学教室のDr Tony Day とDr Martin Nobleとの共同研究)は、X線結晶構造解析とNMR分光法によってCD44のヒアルロン酸結合ドメイン構造の解明に成功した。現在はさらにX線結晶構造解析を進めるため、CD44:HA複合体の単離を行っている。Jackson博士は、現在Oxford大学の分子医学Weatherall 研究所のMRC Human Immunology Unitのグループリーダであり、リンパ系におけるLYVE-1と他のリンクタンパク質スーパーファミリーヒアルロン酸レセプターの機能と構造の研究、およびこれらのレセプターとリガンドとの相互作用を制御する機構の研究を続けている。
最近まで、ヒアルロン酸(以下HAと略記する)レセプターとその生物学的意味に関する詳細な知識は、リンクタンパク質スーパーファミリーの一つで白血球や腫瘍細胞の接着や移動を促進する分子であるCD44のような分子にほとんど限られていた。ヒトゲノムマッピングプロジェクトの出現とDNAデータベースの拡張に伴いこの状況は変わりつつあり、実際今ではいくつかの新しいHAレセプターが同定されている。そのようなレセプターのひとつがこの総説の主題であるLYVE-1であり、その存在はリンパ管とリンパ洞の内皮に限定されている。そしてそこはHA分解が起きている主な部位であり、また白血球や転移腫瘍細胞がリンパ節へ移動する際に通る部位でもある。今回私が要約するのは、LYVE-1の分子的特徴、その機能制御とその想定される生理的な役割である。加えて、最近の三次元構造解析に基づいたLYVE-1とCD44とのHA結合ドメインが非常に良く似ていることの概要を示し、それらが同じ制御機構のもとにあることを示す予備的証拠について論ずる。最後に、分子マーカーとしてのLYVE-1がいかに、リンパ管系生物学における先駆的研究に貢献しているかを要約する。
HAは豊富に存在しているグリコサミノグリカンで、実質的に全ての組織の細胞外マトリックスに存在している。この分子は多くの機能を持っているが、まず一番の機能は細胞接着と細胞移動の補助である。他のグリコサミノグリカンとは異なり、HAはポリペプチドのコアと共有結合しておらず、枝別れのない多糖として単独で存在している。そして、細胞外マトリックスにあるリンクタンパク質スーパーファミリーの大型プロテオグリカンであるアグリカン、バーシカン、あるいは、リンクタンパク質と非共有結合している。これらの大きなHA—タンパク質複合体はまた、リンクタンパク質スーパーファミリー(以下参照)に属する内在性膜レセプターとの多重低親和性の相互作用を介して軟骨細胞や上皮細胞、線維芽細胞の表面に係留され、その結果骨や軟骨や皮膚の真皮/表皮などの結合組織は安定化されている1,2。HAの分解産物の分子量100 kDa以下のオリゴ糖も、細胞に結合できる。しかしながら、これらの反応は細胞“活性化”の引き金になり、炎症性サイトカインやケモカインの産生3、および一酸化窒素のような血管作用因子あるいは血管新生を誘導したりする4,5。したがって、分解を受けていないHAと断片化したHAの生物学的特性は異なっており、HAの分解はHA断片による“危険”シグナルに細胞や組織が不適切に接触しないように、特定の区画で行われているようである。
マウス体内に注入された放射性同位体でラベルしたHAの運命を追跡することで、HAの半減期は約24時間であることがわかった6,7。この代謝率は細胞外マトリックス分子としてはかなり短く、多くの分子(たとえばコラーゲン)の半減期は数週間以上である。HAの代謝の第1段階はフリーラジカルの攻撃あるいはマトリックスのタンパク分解(部分的には炎症組織のCD44陽性マクロファージに取り込まれる)によって局所組織で起きるが、遊離したHAがリンパ輸入管に入り、局所のリンパ節に運ばれて初めて大部分の分解が始まる(図1)。ここで、中間サイズのHA分子はより小さな断片に分解されるが、その行程の詳細はよく分かっていない。たぶんHAは類洞毛細血管内皮細胞により(おそらく“プロフェッショナル”グリコサミノグリカンレセプターHARE8,9を介して)補足され、リソゾームのヒアルロニダーゼによって分解されるか、あるいは可溶性の酵素によって類洞管腔内で加水分解される。最終的に生じる小さなHA断片はリンパ輸出管のリンパ節を離れやがて血液循環系に入り、大部分は同じHAREレセプターを介して類洞毛細血管を覆っている内皮細胞に取り込まれ9,10、肝臓で最終的な加水分解を受ける。通常、HAとその分解物の濃度は血液や末梢組織ではとても低い値に保たれ、外傷、感染、腫瘍形成あるいはリンパ水腫などが起き、リンパ液の流れの分断やHA代謝分解の変化が生じた時にのみ、その値は上がる11。それゆえ、リンパ管はHAのホメオスターシスにおいて重要な役割を果たしているといえる(図1に要約)。
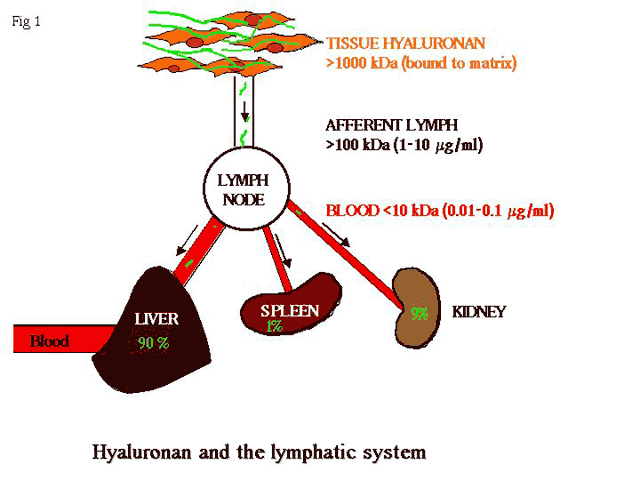
図 1 HA分解におけるリンパ管の中心的役割
皮膚などの組織でプロテオグリカンと複合体を形成している高分子HA(1,000 kDa以上)は100-1,000 kDa程度に部分的に分解され、リンパ輸入管に入り、さらにリンパ節で分解を受ける。低分子断片はリンパ輸出管を介し門脈に運ばれ、最終的にはその90%が肝臓で1%が脾臓で9%が腎臓で分解を受ける。
代謝分解の事を除くと、グリコサミンとしての観点において、リンパ管におけるHAの循環が白血球血管外遊走のための接着基質としてどういう役割を果たしているか、という点で興味深い12。たとえば、血液脈管内では白血球と内皮細胞の両方の表面にHAレセプターCD44が存在し、炎症部位における血管外への移動を容易にするが13,14,15、ここでは局所的なサイトカインの遊離に応答してHA合成が上昇する。しかしながら興味深いことに、CD44はリンパ脈管には存在せず、むしろ関連はあるが別の分子であるLYVE-1(Lymph Vessel Endothelial HA receptor - 1)が主なHAレセプターである16,17。
LYVE-1は、多くのHA結合タンパク質と同じく、リンクタンパク質スーパーファミリーの一つである。このファミリーは、すべて“リンク”モジュールと名づけられた共通のHA結合ドメインを持っており、その3次元構造は、C型レクチンの折りたたみ構造と似ている18,19[このシリーズのDay, A. J. の総説を参照]。 LYVE-1は、完全長のCD44Hのアミノ酸配列をcombined Human Genome Sciences / TIGR ESTデータベースでホモロジー検索した結果、同定された。LYVE-1は322アミノ酸残基からなる内在性膜糖タンパク質でN-末端に 1つリンクモジュールがあり16,17,20、その膜—近位ドメインの終末は、高度にO-グリコシル化されていると予想される16(図2)。O-グリコシル化の程度はかなり大きく、SDS-PAGEの際、アミノ酸配列から推測される分子量に比べ20 kDa程大きい分子量(60-70 kDa)を示すという変則的な移動が見られるのは、大部分このためである。LYVE-1の変わった性質は、細胞外ドメインのC-末端に対になっていないシステイン残基(図3のCys 201)があるからで、それは分子間ジスルフィド結合の形成に関わる(Nightingale T. and Jackson D.G.、未発表)。共有結合LYVE-1 2量体の生理的意味はまだ不明である。最も高い相同性を示すCD44と同じく、LYVE-1は1つのシステイン残基を含む20残基からなる疎水性ドメインにより膜に固定されており、末端70残基が細胞内領域に存在する(図3)。実際、LYVE-1とCD44との間の主な差異は、LYVE-1では膜−近位ドメインが短いこと、リンクモジュール内に5ヶ所でなく2ヶ所の共にシアリル化された糖鎖をもつN-グリコシル化部位があることである(図3)。しかしながら、アミノ酸配列ではLYVE-1とCD44の相同性は43%しかなく、唯一非常に相同性が高い領域はHA結合ドメインのリンクモジュールである16。このことは、二つのレセプターは早い時期に遺伝子重複した後それぞれ進化し分かれた結果と考えることができる。
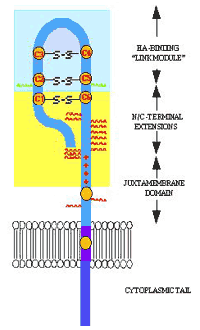
図 2 LYVE-1分子の主な特徴
LYVE-1の模式図。N末端HA結合ドメインには高度にグリコシル化された“茎”領域が終末にある。N-結合型グリカンを緑で、O-結合型グリカンを赤で示した。全てのリンクタンパク質スーパーファミリーにある共通リンクモジュ−ルは青い影をつけた。CD44の場合と同じように制御に関わるリンク拡張ドメインを形成すると考えられているN末端とC末端領域に黄色い影をつけた(図3も参照)。CD44のHA結合に貢献する塩基性残基のグループと比較的似た位置に在る塩基性残基は赤+印で描いた。3つのジスルフィド結合(C1-C6, C2-C5, C3-C4)を形成するシステイン残基と、茎領域と膜貫通領域にあるペアを作っていないシステイン残基を黄色で示した。
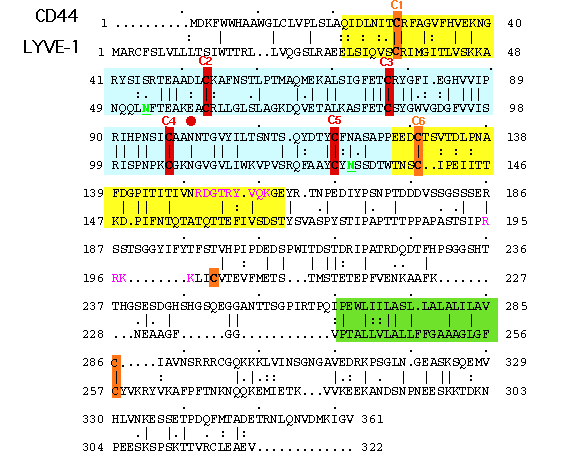
図 3 LYVE-1とCD44のアミノ酸配列のアラインメント(位置合わせ)
示されているのは、ヒトLYVE-1とCD44のアミノ酸配列の位置合わせである。共通リンクモジュールを含むと予想されるHA結合ドメインは青で、N-とC-末端拡張ドメインは黄色でそれぞれ影をつけ、図2が確認できるようにした。共通リンクドメインにあるジスルフィド橋(C2-C5)を形成するシステイン残基は赤で示した。リンク拡張ドメインにあるジスルフィド橋(C1とC6)と膜貫通ドメインおよび付加的にLIVE-1だけにあるペアになっていないシステインはオレンジ色で示した。2つのN-グリコシル化部位(N53, N130)はアンダーラインを付けた緑色の文字で示した。CD44のHA結合と関与しているC末端リンク拡張ドメインの塩基性アミノ酸の部分36は紫色で示した。もっと下流にあるLYVE-1のこの領域のアミノ酸も同様に紫色で示した。膜貫通ドメインは緑色で影をつけた。
リンクドメインの機能から確認されるように、トランスフェクトしたCOS細胞あるいは293T細胞の細胞表面に完全長で、あるいは可溶性の2量体のFc融合タンパク質として発現させたLYVE-1は、可溶性HAにも固定された高分子HAにも結合する16(図4)。実際、LYVE-1はレセプターとしてHAに高い特異性を示し、ヘパラン硫酸やコンドロイチン硫酸などの他のグリコサミノグリカンを用いた競合的結合実験によれば、これらのmM濃度の範囲では結合を阻害しない16,17。このことが、コンドロイチン硫酸との結合が報告されているCD44よりも、LYVE-1の方がHAに特異的に結合するということを示すかどうかはわからない。というのも、このようなグリコサミノグリカンの試料には、HAが混合していることが多いからだ。LYVE-1とHAの絶対親和性はまだ決定されていないが、この問題は、LYVE-1の予想される生理的機能とかなり関係が深い(後で取り上げる)。CD44の場合、HAとの親和性はかなり低い(Kd > 100μM)と見積られており21(Day A. J.、私信)、このことはHAが関与する細胞移動における役割(セレクチンとその糖鎖リガンドの関係と似た、リガンドとの多くの弱い結合が絶え間なくできたり壊れたりしている)と合致する。LYVE-1とCD44 Fc 2量体とのHA結合曲線の比較すると、二つのレセプターの親和性はかなり似通ったもののようである16。しかし、LYVE-1のHA結合親和性について信頼性できる評価をするにはLYVE-1単量体を用いた測定が必要であろう。
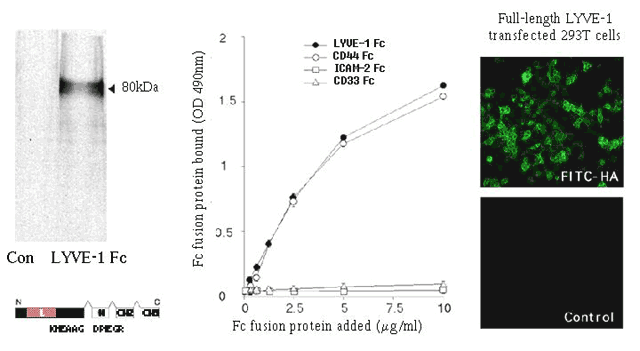
図 4 リコンビナントLYVE-1のHA結合特性
IgG1 Fc 融合タンパク質として発現させた可溶性LYVE-1の細胞外ドメイン(左のパネル)は、固定されたHAと結合する(中央のパネル)。一方、ネガティブコントロールに用いた白血球表面抗原ICAM-2とCD33の可溶性融合タンパク質は、プレート結合アッセイでHAと結合しない。加えて、完全長LYVE-1をトランスフェクトさせたヒト293T線維芽細胞は、細胞表面でFITCラベルされたHAに結合する。一方、トランスフェクトされていない293T線維芽細胞は結合しない。(右のパネル)
LYVE-1の最も際だった特徴は組織での発現パターンにある。ノーザンブロットとRT-PCRを用いた非常に初期の組織分布の解析から、LYVE-1の発現パターンが通常とは異なるということがわかってきた。少なくとも転写物は、造血細胞にも線維芽細胞にも上皮細胞にも見つけることはできず16、これらの細胞系の主なHAレセプターであるCD44とは好対照である。さらに、いくつもの異なる大きさのアイソフォームがあるCD44とは異なり、LYVE-1は1種類しかなく、コーディングエクソンに対する選択的スプライシングは行われていないようである。LYVE-1特異的な抗体を免疫組織学に用いた時に、大きな発見がなされた。これらの研究が示したのは、皮膚、腸、2次リンパ組織の脈管構造において常時LYVE-1が強く染まることである。特に染まったのは、内腔を囲む薄い内皮細胞の裏打ちのある脈管であり、それは時には空の脈管であったが、常に赤血球が欠けていた(図5)。これらの管が血管ではなくリンパ管であることの同定は、二重染色でCD34、von Willebrand因子、CD44のような血管マーカーでは染色されないこと、そしてVEGFR3(チロシンキナーゼレセプターで、リンパ管増殖因子VEGF-Cからの分裂シグナルを伝達する)や内在性膜ムコプロテインのポドプラニンのようなリンパ管内皮分子との共発現によって確かめられた16,17,22。続く研究から、さらに最もLYVE-1を発現している脈管は、初期胚形成においてリンパ管内皮分化に特異的に作用する転写因子PROX-1を発現していることが確認された23,24。LYVE-1は今ではリンパ管内皮のもっとも特異的なマーカーとして認められ25、正常または腫瘍の組織におけるリンパ管形成やリンパの機能を探る研究においては、リンパ管と血管を識別することに計り知れない価値を持っている(後で考察)。
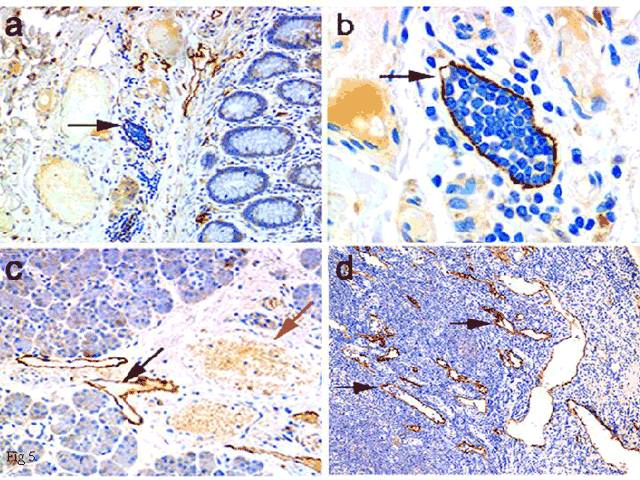
図 5 リンパ管内皮におけるLYVE-1の免疫組織学的検出
ヒトの結腸の小さなリンパ管(パネルa, b)、唾液腺(パネルc)とリンパ節の皮質/髄質洞(パネルd)のLYVE-1は、高感度免疫ペルオキシダーゼ法で染色、検出した。パネルaとbの矢印は、有核白血球で満たされたリンパ管を示している(ギムザ染色)。パネルcでは、LYVE-1陽性の空のリンパ管(黒い矢印)が、赤血球の詰まったLYVE-1陰性の血管(赤い矢印)の近くに見える。パネルdの矢印が示しているのは、LYVE-1陽性のリンパ節皮質洞で、一部白血球を含んでいる。
("The Journal of Cell Biology, 1999, vol 144, pp 789-801" The Rockefeller University Pressより転載)
LYVE-1がほとんどリンパ管にしか存在せず、その発現がCD44と共存することがないという観察は興味深い。明らかにLYVE-1の性質はリンパ管内皮に特化した機能に合わせて仕立てられているに違いないが、その機能とは何であろうか?
1つの可能性としてLYVE-1がHAのトランスポーターとして働くことがある。例えばトランスサイトーシスは、HAを周辺組織からリンパ輸入管の内腔へ、あるいはリンパ節、肝臓あるいは脾臓の類洞内皮を通り越して移動させ、続いて線維芽細胞あるいはマクロファージ様細胞によって細胞内へ取り込ませるのかも知れない。このような考えを支持するものとして、LYVE-1がリンパ管内皮の洞側と基底外側の両方に発現していることが、immunogold-labelled 抗体を用いた透過型電子顕微鏡を用いた研究で示された17,26。この仮説に対する反対意見は、リンパ管は血管と違い可溶性の高分子が比較的透過できるようだということである。リンパ管の主要な機能のひとつは組織中の体液を集めることであり、この特性が発揮されやすいようにリンパ毛細管の小さい内皮細胞の接合の多くは緩やかな重なりを形成しており、隣接する血管内皮細胞間では密着した接合が形成されることとは対照的である。さらに、実際の組織でHAがどれほどリンパ管に浸透するかを測定したところ、リンパ管内皮による影響はほとんどかまったく見られなかった27。したがって、リンパ毛細管へHAを輸送するためにはレセプターの必要はないのかもしれない。
あるいは、LYVE-1は例えば輸入リンパ毛細管、またはリンパ節、肝臓あるいは脾臓の類洞の様なHA分解の主要な部位の内皮細胞自身が細胞内で分解するためにHAを取り込むことに関係しているのかも知れない。この仮説を支持するものとして、我々はLIVE-1が確かにトランスフェクトした線維芽細胞に高分子HAを取り込むことを示した(図6)。興味深いことに、HA取り込みの経路は、CD44と同様に28coated pitsやカベオラを介さないように見える(Prevo R. and Jackson D.G.、未発表)。LYVE-1の細胞内領域はCD44のそれと同様に細胞内取り込みのための通常知られているシグナルを含んでおらず、我々はそれを全て削除してもFITCラベルしたHA取り込みはほとんど影響されない事を見つけた(Nightingale T and Jackson D.G.、未発表)。しかしながら、われわれの観察したin vitroでのHA取り込みの割合は、単離した肝細胞の通常のエンドサイトーシスHAレセプターHAREについて報告されているものと比較して低い29。従ってLYVE-1がin vivoで主要なエンドサイトーシスレセプターであるということはなさそうである。さらに、HAを類洞内皮へ輸送する機構はグリコサミノグリカンに対して比較的特異性が低いことが知られており、LYVE-1の場合とはまったく異なって容易にコンドロイチン硫酸やヘパリンによりブロックされる9。低親和性の共同レセプターとして、類洞でのHA取り込みにLYVE-1が貢献している可能性はあるが、それは推測であり、単離した肝臓類洞内皮細胞を培養で用いた予備実験の結果からは支持されなかった(Prevo R. , Adams D. and Jackson D.G.、未発表)。しかしながら輸入リンパ毛細管の内皮によるHA取り込みにおけるLYVE-1の役割は、無視できない。
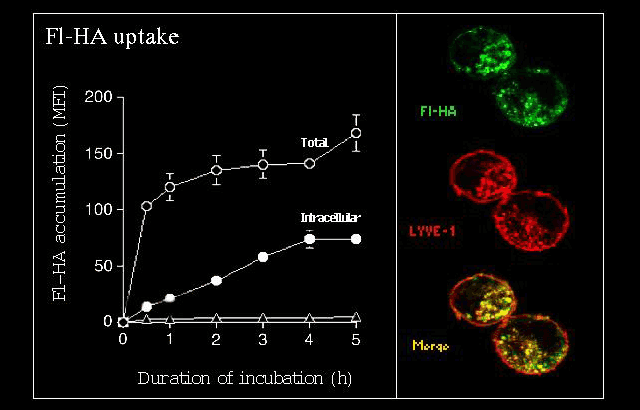
図 6 in vitroにおけるLYVE-1をトランスフェクトした細胞による蛍光標識HAの取り込み
LYVE-1をトランスフェクトしたヒト293T細胞は、培養液のFI-HAと結合し、取り込む。これを、定量的FACS解析を用いた取り込みの時間的経過(左のパネル;MFI、平均蛍光強度)と、蛍光顕微鏡(右のパネル)によって評価した。△はトランスフェクトしていないヒト293T細胞によるHAの取り込みを示している。
もう1つの可能性は、LYVE-1が主に細胞接着に関与して、内皮細胞と白血球との相互作用を促進する、あるいは逆にそれを阻害することである。リンパ輸入管の主要な機能の1つは、抗原提示樹状細胞と活性型リンパ球に対して導管として働くことであるが、そのどちらもその活性型であるHA結合状態でCD44を発現することが知られている。もし、HAがリンパ輸入管の内腔表面上に捕捉されているなら、このことは白血球の輸送を妨げ、閉塞へ導くかもしれない。実際、リンパ管内皮細胞上のLYVE-1のHA結合なしの状態は、モoffモ 状態であるらしい。例えば、ビオチン化したHA結合タンパク質(アグリカンのG1領域とリンクタンパク質の複合体)を用いた組織におけるHAの免疫組織学的な検出では、内皮と結合したHAあるいはLYVE-1と共存するHAを示すことができなかった。同様に、FITC標識のHAで組織を灌流した時、リンパ管によるHAの捕捉は見られず、また予めヒアルロニダーゼ処理で内在性グリコサミノグリカンを除去しておいても結果は同様であった。LYVE-1を発現している新しく単離したリンパ管内皮細胞でも、蛍光顕微鏡とFACS分析で評価すると、培養中にHAと結合しない(Nightingale T. and Jackson D.G., 未発表)。おそらく機能的に不活性の状態ではLYVE-1は、ロイコシアリンとエンドムチンのようなムチン様糖鎖を運ぶ他のシアリル化糖タンパク質で提唱されているのと同様な抗接着機能を果たしているのであろう。たぶんLYVE-1は、最も近い相同性を示すCD44の場合と同じに、適切に活性化された後でのみ接着するようになるのだろう30。
炎症性サイトカインによる白血球におけるCD44の活性化は、ある特定の細胞-細胞外マトリックス相互作用が外部からのある特定の合図で制御される仕組みの明快な例である。正確に言えば、どのようにしてそのような活性化がなされるのかが徐々に明らかになりつつあり、この章で短く要約されるCD44の構造解析を進めることでさらにこの問題は解明されつつある。活性化に対する主要な機構の1つは、リンクモジュールを含むCD44のHA結合ドメインにあるN-型結合糖鎖5カ所中の1つ以上の部位で起きるリモデリング31,32であるらしい。幾つかの細胞種で、HA結合性の喪失はCD44のシアリル化と関係しているらしい33。例えば骨髄細胞のHA結合は、シアリル化N-型グリカン鎖を酵素的な分解で33、ホルボールエステル処理で34、あるいは内因性のシアリダーゼ活性を誘導する35ような状態に曝すことで顕在化される。さらに、ある2つのN-グリコシル化部位(Asn25とAsn120)を破壊すると、数種の“誘導可能”細胞系でHA結合を常時“活性”型にすることができる32。
正確にどのようにN-結合型糖鎖のリモデリングがCD44へのHA結合を顕在化させるのかは、現在X線結晶構造解析やNMR分光法を使った最近の構造解析の結果として明らかにされつつある36。全てのリンクタンパク質ファミリーメンバーと同じくCD44のHA結合ドメインは約100アミノ酸残基からなるタンパク質ユニット、いわゆるリンクモジュールの中央にあり、塩基性あるいは疎水性アミノ酸配列により隔てられている4つの高い保存性を持つシステイン残基を含んでいる。TSG-6分子の構造解析の結果によれば、これはC型レクチン様折りたたみと似ていて、二つの逆平行βシートと二つの短いαへリックスからなり、二つのジスルフィド結合により安定化され中央の疎水性のコアを包み込んでいる18(図7)。露出している、部分的に疎水性のHA結合面は、大部分二次構造要素間で隣接していないループ領域のリジン、アルギニン、チロシン残基から形成されている。しかしながら、CD44のHA結合領域はもっと複雑で、共通リンクモジュールのN-末端とC-末端の両末端から先のポリペプチド鎖部分が関係しており、このことがレセプター機能の制御の非常に重要な点となっている。これらの拡張ドメインを決定している特徴は以下のように短くまとめられる。第1に、CD44の共通リンクドメインは3つ目のジスルフィド結合を形成する追加的なシステイン残基のペアで括られており、ジスルフィド結合はHA結合ドメインが正しく折りたたまれ40、機能するために重要である(図3 参照)。第2に、部位特異的突然変異導入法で示されたのは、リンクモジュールのC末端側にある20-30残基中の4つの塩基性アミノ酸グループ(Arg 150, Arg 154, Lys 158 および Arg 162)がHAとの相互作用に貢献しているということであり36,37、共通リンクモジュールはHA結合ドメインの一部分しか形成していないことを示唆している。第3に、HA結合を誘導するCD44 モノクローナル抗体の抗原決定基マッピングから、HA結合ドメインは共通リンクモジュールのN-末端とC-末端の非連続な部分から形成されていること39が明らかにされ、これらの周辺領域は構造全体として協同し活性化リガンド結合ドメインを形成することが示唆された。
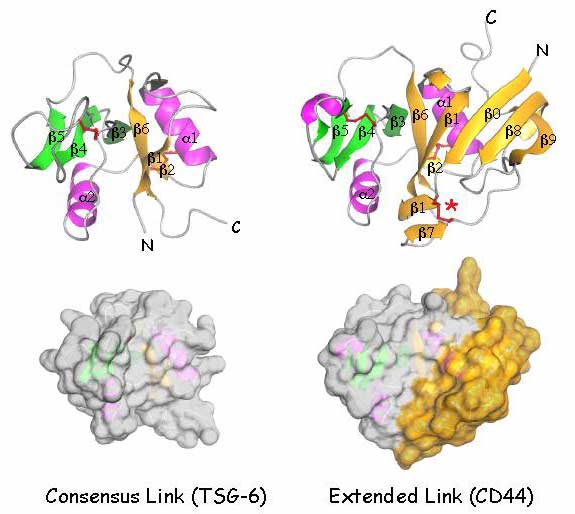
図 7 共通リンクモジュールと拡張リンクモジュールの構造
TSG-6の共通リンクモジュールの立体構造図および空間実体模型と、CD44の拡張リンクモジュールのそれらを比較した。これらは最近大腸菌で発現させたHA結合ドメイン(残基20-178)のX線結晶構造解析とNMR分光法で得られたものである36。TSG-6の共通リンクモジュールは、S1(黄色)とS2(緑色)の2つのβシートで成り立ち、おのおのシートは、β鎖1,2 と6およびβ鎖3,4と5から構成されていて、一対の短いαへリックス(ピンク色のα1とα2)でくくられている。2つの保存された分子内のジスルフィド結合は赤色で示した。HA結合表面は二次構造要素をつなげているループの中の残基から形成されている。CD44のリンクモジュールは付加的に突き出た構造を形成するN末端とC末端の拡張ドメインからの追加的な4つのβ鎖β0,β7,β8とβ9を伴っており、空間実体模型では黄色で示した。またそれは赤の*で示した3番目のジスルフィド結合で安定化している。HA結合の制御に関係するこの拡張ドメインの特徴の幾つかは、LYVE-1中にも相応するものがある(本文参照)。
最近明らかになったCD44の三次元構造(図7)から、伸長したHA結合ドメインは2つの直交するαへリックスと、1つの長いくねったβシートを作る全部で10本のβ鎖から構成されることが示される36。このシート内では、共通リンクモジュールの6本のβ鎖(β1-β6)はN-末端とC-末端の伸長領域から出てくる4本の追加的β鎖(β0, β7, β8, β9)によって補強されて、はっきり区別できる葉状構造を作り(図7+8)、主要HA結合面の面数が増えることで、HA6糖への結合から、8糖にも結合できる可能性がある36。拡張CD44リンクモジュールの最も注目すべき特徴は、キーとなるN-グリコシル化部分(Asn25)がHA結合表面の中央の近くに配置するので、(適切に修飾されれば)おそらく立体障害によってそこの糖鎖がHA相互作用を阻害する可能がある(図8)。
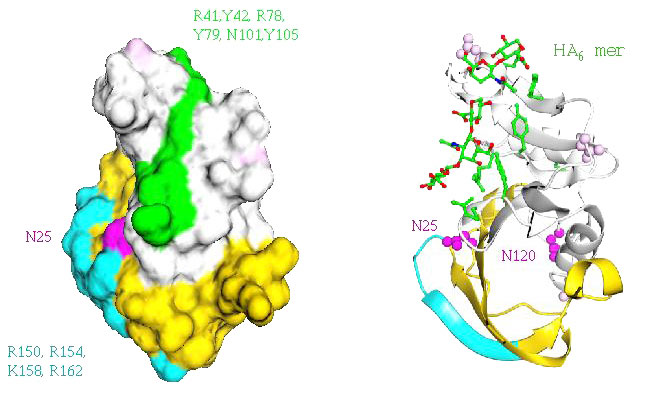
図 8 HA結合制御おける拡張リンクモジュールの役割についての考え
CD44の空間実体模型(左側)で示すと、突き出し膨らんだ付加的な構造を形成している拡張リンクモジュール(黄色と水色)の役割は、主要HA結合面(図中の緑色と文字)に対する接触が可能な付加的な残基(図中の水色と文字)として寄与することである。付加的な残基がつくことで、8糖ユニットの対応が可能な大きいHA結合面が形成される。立体構造図(右側)は同じ配向で示してあり、想定される結合面上にモデル化したHA6糖が置かれている。重要なことは、ピンク色で示される制御のキーとなる2つのN-グリコシル化部位の1つ(Asn25, 図ではN25)は共通リンクモジュールとその突き出た拡張リンクモジュールの連結部にあることで、もし適切な修飾が起これば、そこにある共有結合の糖鎖は立体阻害効果でHA結合を阻害する可能性がある36。
LYVE-1もこのような特徴を持つのだろうか、またCD44と似たやり方でHA結合能を制御しているのだろうか?この2つの質問に対する答えは、十分にイエスである。最初に、LYVE-1における共通リンクモジュールはC61, 85, 106, 128 (C2, C3, C4 ,C5),の4つの保存されたシステイン残基であり、CD44のそれのように2つの付加されたシステイン残基(C1とC6、図3)でくくられていて、その間にはいくつかの残基が入っている(C1-X24-C2-X23-C3-X20-C4-X20-C5-X10-C6)。これはCD44と同じで、この部分の残基配列の相同性は57%である16,17(図3参照)。またCD44と同じく40、付加された2つのシステイン(及びC末端直近からC139までの領域)が完全に揃った状態で有ることが、LYVE-1のHA結合ドメインの折りたたみとグリコサミノグリカンとの結合に重要であることが、大腸菌における発現/再折りたたみ実験とLYVE-1の細胞外ドメインのFc融合構造の段階的切り詰め実験結果からわかった(Banerji S. Nightingale T. and Jacjson D.G.、未発表)。第2に、LYVE-1 配列は、共通リンクモジュールのC末端側下流に塩基性残基(R195RKK198)の部分を含んでおり、HA結合に貢献するCD44の拡張リンクモジュールの“突き出し”部分のそれ(R150DGTRYTKK158)と同じではないが似ている(図3 参照)。これらの実験から、LYVE-1のHA結合ドメインは共通リンクモジュールの境界を越えて広がっていることが示された。第3に、CD44結晶の座標を用いてLYVE-1のHA結合ドメインをモデル化すると、接触する可能性のある3つのアミノ酸残基Lys46、Try87およびAsn109は、CD44における対応部分に対して同じ位置を占めることができるよう見える。更に、LYVE-1の2つのN-グリコシル化部位の位置は、CD44でHA結合を制御するとされているものと同じ場所(Asn130)か、または少なくともおおよそ同じ場所(Asn53)である(図9)。LYVE-1におけるHA結合部位の場所と方向は今のところまだ正確には決まっていないが、もし、この部位で糖鎖が適切に修飾されれば、CD44に対してと同様にHA結合またはレセプターの自己会合に基づく立体効果によりレセプター機能を制御するかも知れない36。この興味深い可能性をはっきりとさせるため、構造解析のための可溶性グリコシル化LYVE-1を発現させる努力が現在進行中である。
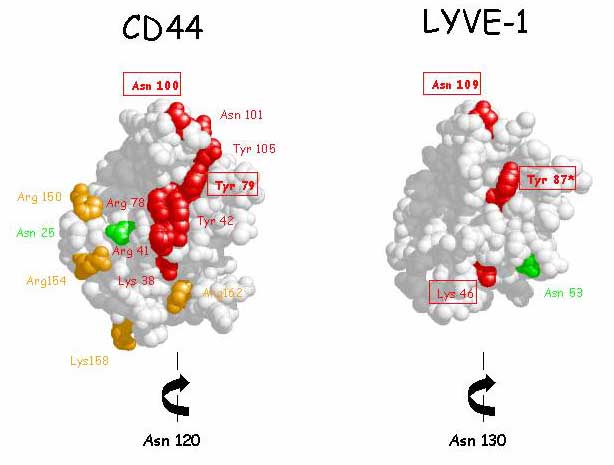
図 9 LYVE-1の HA結合ドメインで想定される制御に関与するN-グリコシル化部位
CD44構造をベースにしたLYVE-1リンクモジュールの空間実体模型。LYVE-1 の2つのN-グリコシル化部位(Asn53とAsn130)は、CD44のHA結合制御と関係がある32と考えられる2つのN-グリコシル化部位(Asn25とAsn120)と分子上でおおよそ同じ場所にある。(CD44のAsn120とLYVE-1 のAsn130はHA結合面の後ろ側に位置するためこのモデルでは見えない。)HA結合面を作るとされるCD44の共通リンクモジュール内の残基(部位特異的突然変異導入法によって同定された37,38)が、相当するLYVE-1の表面内の(囲んで示している)3つの保存された残基と同様に赤あるいは橙で示してある。LYVE-1におけるHA結合アミノ酸残基はまだ確定していない(Banerji and Jackson、未発表)ということにご注意いただきたい。Asn53とAsn130への糖鎖の結合は、もしそれが適切に修飾されていれば、CD44において予想されるように、おそらく直接的な立体障害またはそれぞれのレセプターの自己会合をともなう障害によってHA結合を制御する可能性がある(図8も参照)。
構造に基づいた論争は別として、LYVE-1の機能制御がCD44と同じ方法で行われていることの実験的証拠もある。われわれの実験室の予備実験から、HA結合の程度は大部分細胞の種類に依存しているが、細胞の活性化によっても誘導されることが示された。先に概要を述べたように、LYVE-1をトランスフェクトした293T細胞とCOS1細胞のレセプターはHAに結合するが、一方、初代リンパ管内皮細胞の内因性レセプターは機能的に“オフ”になっているようで、すなわちHAに結合しない。加えて、子宮頚癌やBリンパ腫細胞系などの他の細胞種にLYVE-1をトランスフェクトしてもHA結合は見られなかった。この特徴は、CD44でも同じで、スイッチの“オン”、“オフ”が起きることが白血球や腫瘍細胞系のレセプターのデータからわかっている(ref.31参照)。LYVE-1をトランスフェクトした293T細胞にフォーボルミリステートアセテートを加えるとモ活性化モされ、HA結合が3〜5倍に増えることを見つけた。このことは“弱い結合”の白血病細胞系のCD44が、in vitroでフォーボルエステルか炎症性サイトカインの処理(in vivoで炎症中に循環しているリンパ球中のCD44の“活性化”を再現した条件)によって、HA結合が誘導されるという以前発表された知見とよく類似している。論じたように、CD44のHA結合を誘導する機構は多くの造血系細胞ではN-グリカンの脱シアリル化と関連があるらしく、そのいくつかは直接HA結合ドメインに影響を及ぼす。293T細胞で、LYVE-1に対するHAの結合がPMAで誘導されることは、同様な修飾が関連しているように思われる。さまざまな実験の結果をまとめると(Nightingale T. and Jackson, D. G., 原稿準備中)、293T細胞のPMAで誘導されるHA結合は、存在しているレセプターの除去と対になって生じる翻訳後修飾による“活性”型のde novo 合成と関連があることを分かった(図10)。この修飾がN-グリカンのリモデリングを引き起こす可能性は、フォーボルエステルによる誘導がtunicamycin処理でブロックされる結果と、2つのN-グリコシル化部位への特異的突然変異導入法(元々のLYVE-1の三次元構造が維持されるような条件下)の結果から支持される。
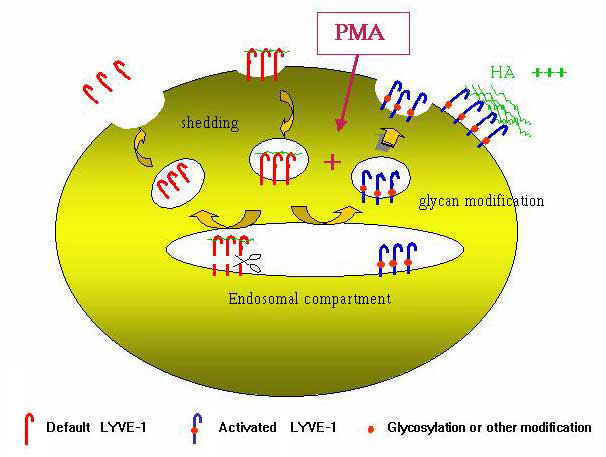
図 10 PMA-誘導によるLYVE-1の HA結合活性化に対する仮説モデル
模式図は、LYVE-1をトランスフェクトした293T細胞のPMAによる活性化で、LYVE-1がFITC-HAに結合するに至る様々なステップを示している。
リンパ管におけるLYVE-1とそのリガンドHAとの相互作用は厳密に制御されていること、そしてそのメカニズムは血液脈管におけるCD44-HAの相互作用の制御機構とかなり似かよっていることが徐々に明らかになってきた。しかしまだはっきりしないところがあり、LYVE-1グリコシル化のパターンが、機能的に沈黙している細胞(すなわち、リンパ管内皮細胞)と293T細胞のような機能的に活性化されている細胞とどう異なっているかは未知である。現在進行中の実験は、この疑問の答えをさぐっている。
ここまでの章では、LYVE-1の構造や生理学的機能の可能性についての最近の研究について論じてきた。それらは、LYVE-1に対するひとつの視点である。もうひとつの視点は、胚のリンパ管形成の研究におけるリンパ管内皮の同定23のための分子マーカーとして、病理組織切片の血管とリンパ管の区別41のための分子マーカーとして、このレセプターを使うというものである(図5参照)。リンパ管に関する基礎生物学の知識は、血管系のものに比べ遅れているが、それは主に特異的なマーカーがなかったからである25。しかし、LYVE-1(およびVFGFR3とポドプラニンのような他の分子)が同定され、リンパ研究の新しい時代が開けてきた。
LYVE-1抗体の利用が特に重要になった分野は、腫瘍におけるリンパ管の形成と腫瘍がリンパ管に広がる際に果たす役割に関しての分野である。乳癌、前立腺癌、直腸癌、胃癌などの多くの癌が、早期にリンパ節に転移するが、それが新しいリンパ管の形成と浸潤によって成されるものなのか(腫瘍リンパ管形成25,26,42-46)、あるいは腫瘍周辺の以前からあったリンパ管への浸潤によるものか(考察は以下を参照)の論争はいまだに続いている。この問題は、臨床応用にとって非常に重要である。なぜなら、もし原発の腫瘍におけるリンパ管形成からリンパ節への転移が予測できるのであれば、その検出は乳癌のように手術時にリンパ節転移が陰性でもしばしば再発するような癌に対して重要な予後判定ツールとなる可能性があるからである。こうした高リスクな患者の早期発見と適切な治療は、生存率を有意に改善させる可能性がある。さらに腫瘍リンパ管形成は、治療法として道理にかなったターッゲットとなるだろう。
LYVE-1を用いた最近の実験と臨床研究の多くで、腫瘍のリンパ管形成が観察され、定量されている。第一に、免疫力のないマウスへのヒト腫瘍の実験的異種移植で人工的にリンパ管形成を増やしてやるとリンパ節転移が増加した。例えばVEGF-Cを過剰発現させたMDA-435あるいはMCF-7乳癌42,46を乳腺に移植したところ、あるいは293EBNA線維肉腫47にVEGF-Dを過剰発現させると、LYVE-1を発現しているリンパ管の増殖を促進し、次いでリンパ節転移を増加させた。このようにリンパ管形成と癌転移との関連が、動物モデルによって証明された。しかしながら、LYVE-1を用いた免疫組織学研究はまた、しばしば頚部リンパ節へひろがる頭頚部扁平上皮癌48や、すぐにリンパ管に広がる原発性悪性黒色腫を含むヒトの自然発生癌においてもリンパ管形成が生じることを明らかにした49-51。さらに、増殖しているリンパ管の数はリンパ節転移および予後が悪いことと相関性を示した。全ての癌においてリンパ管形成がすぐ見つかるわけではないが(ref.52参照)、LYVE-1のようなマーカーを使った腫瘍組織の予後評価は、日常の病理検査で十分に価値を示すだろう。
この興味ある分野はまだ初期のステージにあり、答えを待っている多くの疑問がある。正常/腫瘍のリンパ形成を誘導するおのおのの因子の起源と同定、そして腫瘍がリンパ管に浸潤し、リンパ節にたどり着く機構の解明などである。初代リンパ管内皮細胞の単離と解析のためにLYVE-1を利用することは、このような重要な疑問に答える手段になるだろうと想像している。
この総説は、LYVE-1とそのリンパ管上皮、脾臓上皮と肝臓類洞における特異的な発現とその正確な生理学的機能の謎とに焦点を当てたものである。加えて、最近の構造解析に基づくLYVE-1とCD44の類似性の概要について述べた。このことから、これら2つのレセプターはリンクタンパク質スーパーファミリーの別々の枝を形成し、その枝は特異的な細胞外シグナルに反応してHA結合親和力を制御する能力を進化させたことが示唆される。LYVE-1の研究はまだ始まったばかりで、その大きな研究目的のひとつはin vivoでのLYVE-1/HA相互作用のスイッチのオンオフ方法を明らかにすることであり、また、これらの相互作用がリンパ管における細胞の移動を制御しているのか、あるいはHA代謝を制御しているのかを明らかにすることである。更なる研究が、LYVE-1がシグナル発生分子かどうか、レセプターがリンパ管内皮細胞表面から放出されるかどうか、遺伝子発現制御はどうなっているかを明らかにするであろう。また、LYVE-1遺伝子ノックアウトマウスが最近構築されたので、この分野の研究が一層進むであろう。
謝辞
この仕事には、The Medical Research Council (MRC) とThe Association for International Cancer Research (AICR)およびCancer Research UK (CRUK)の多大な援助を受けた。