May. 18, 2004
Robert Stern
氏名:
Robert Stern
Stern博士は1957年ハーバード大学でB.A.を得た。彼はシアトルのワシントン大学でEdmond Fisher博士とEdwin Krebs博士の研究室で医学生として研究し、1962年M.D.を授与された。彼はイスラエルRehovothのWeizmann Institute of ScienceのUriel Littauer博士の下でポスドクとなり、米国、メリーランド州、NIH、のResearch Scientistとなった。1977年にカリフォルニア州、UCSFに移って以降、ヒアルロン酸とヒアルロニダーゼの生物学に着目している。彼はまた局公認の解剖病理学者で病理学教室で教育と診断業務に関与している。
1. はじめに
ほ乳類ヒアルロニダーゼについては、先にこのヒアルロン酸科学シリーズNo.15の総説で述べた。ここではより最近の研究について概説する。
ヒアルロン酸(以下HAと略す)は脊椎動物組織において代謝回転率が異常に高い。体重70 kgの人には15gのHAがあり、その内の5gが毎日入れ替り、血中のHAの半減期は5分である。このようなダイナミックな分解が起こっているにもかかわらず、HAの分解についての経路を図式として表すことがこれまで出来ていなかった。分解は主として酵素によりポリマーサイズが不連続的に減少する階段状の様式で起こるが、それぞれの固有の分子量を持つHA分解物はそれぞれかなり異なる生物活性を持ち、非常に良く制御された分解カスケードがあるらしい。これらの観察から分解代謝経路を図式化することができそうだ。HAの単調な繰り返し構造はそれぞれの分解段階で分子サイズに依存した酵素基質としての特異性を獲得するが、それは1) HAのサイズに対して特異的に接着するヒアルアドヘリンの種類が変化し、2) サイズに依存してHA分子の折りたたみ構造が変化することで可能になる。この2つの現象は明らかに相互に関係している。大部分のヒアルアドヘリンは共有結合と言うよりむしろ静電的相互作用でHAに結合しているので、分解過程に従い速やかに入れ替わることができる。また、ヒアルロニダーゼ阻害物質も存在し、分解経路の色々な段階で制御するメカニズムが用意されている。このようなアルアドヘリンとヒアルロニダーゼ阻害物質の大部分はまだ同定されていない。
2. ヒアルロニダーゼ様遺伝子ファミリー
ヒトでは3つの遺伝子、Hyal-1、Hyal-2とHyal-3をコードしたHYAL1、HYAL2とHYAL3があり、遺伝子の密集領域である染色体3p21.3上に非常に近接して存在する。それらは非常に複雑に組織化され、ところにより重なっている1。見かけ上は関連していないN-アセチル転移酵素をコードしている遺伝子Fus2は一部HYAL3のイントロンに埋め込まれている。マウスではHYAL1は、しばしばHYAL3と/あるいはFus2と共転写される。組織での共発現だけでなくこのようなpolycistronic(多遺伝子機能単位の)転写に関しては、それが生理学的に重要であると示唆はされているが、それ以上は分かっていない。
染色体3p上のクラスターに由来したHyal-1とHyal-2が、体細胞組織の主たるヒアルロニダーゼとなる。Hyal-2はglycosylphosphatidylinositol-(GPI)結合で原形質膜に繋がれていて、高分子量HAを約20 kDaの限定サイズのHAに分解し、一方Hyal-1はリソゾーム中にあるらしく、HAを小さな2糖に分解する。
Hyal-3は謎めいている。幅広く発現しているが、利用可能なヒアルロニダーゼアッセイを使っても、活性は見られてない。Hyal-1、Hyal-2とHyal-3の発現は軟骨細胞で見出され2、線維芽細胞が軟骨細胞に分化する時増加する3。
3つの遺伝子HYAL4、PHYAL1とSPAM1(精子接着分子1)は同じような様式でクラスター化しているが、その場所は染色体7q31.3上である。それぞれHyal-4とヒトでは転写されるが翻訳されない偽遺伝子およびPH-20をコードしている。この染色体パターンから、2回の遺伝子重複でできた3遺伝子がその後更にひとかたまりで重複されたと考えられる。
PH-20は卵子を取り囲む卵丘塊を通り抜けて精子が進入し易くする酵素で、受精にも必須である4。これは透明帯に結合する別のドメインを持った5多機能酵素タンパク質でもある。より高感度なポリメラーゼ連鎖反応(PCR)分析技術では、PH-20は副睾丸、精嚢、前立腺6、雌の生殖管7、乳腺8、胎盤と胎児の組織9だけでなく、ある種の悪性腫瘍8,10-12でも検出される。PH-20はまた、腎組織特異的なレベルでの糖鎖修飾によりヒアルロニダーゼ活性を欠いた形で尿細管上皮に見出される(P. Martin-DeLeon、私信)。このようにPH-20は一時期考えられていたように精子に特有なものではなく、ヒアルロニダーゼ活性以外の機能も有しているらしい。
偽遺伝子PHYAL1は通常とは違う停止コドンを含み、ヒトでは活性型には翻訳されないが、他のほ乳類では翻訳されるらしい。PH-20を欠損しているマウスにも生殖能力のあることが、このことで説明できるかも知れない13。
7番目のヒアルロニダーゼが見出されたが14、これは髄膜腫の抗原に免疫学的に似た酵素をコードしている。この配列に伴ったヒアルロニダーゼ活性は性質がよく分かっていないが、ある種のスプライシングバリアントはβ-N-アセチルグルコサミニダーゼ活性を持った核内タンパク質を産生する15。
3. 酵素の構造と分解機構
細菌と脊椎動物ヒアルロニダーゼの三次元構造は今では結晶学的解析により入手可能になり16、予想される分解メカニズムが示せるようになった。ほ乳類の酵素の構造は、ヒトPH-20との間に30%の配列同一性があるハチ毒の酵素をもとにモデル化できる。1.6Åの解像度で測定された結晶構造は、バレルがたった7本鎖でできていることを除けば、多くの糖加水分解酵素に共通した構造である古典的な8回折りたたみのβ/α−トリオースリン酸イソメラーゼ(TIM)バレルに似ている17。長い基質−結合用の溝はバレル軸のC-末端に垂直に伸びている。脊椎動物のヒアルロニダーゼはTIMバレルモチーフの中ではβ-シートとα-へリックスの組み合わせでできているらしいが、逆に細菌のリアーゼあるいはエリミナーゼ型のヒアルロニダーゼはα/αバレルでできている。しかしながらそれらは同様にC-末端を横切るように糖鎖−結合用の溝構造を持っている18,a。
aこのシリーズのM. Jedrzejasの総説を参照。
PH-20酵素は2相性のpH活性曲線を描く。PH-20のアミノ酸配列142-172に囲まれた領域は中性pHでの活性のもとになっているが、アミノ酸277-297の配列は酸性でのヒアルロニダーゼ活性に重要である。2つの領域はそれぞれ酸/塩基触媒および求核の攻撃部位である19。
4. ヒアルロン酸の分解様式
HAがCD44のような受容体22-24を通して細胞に取り込まれ、分解される20,21ことは確立された考えである。高分子量の細胞外ポリマーはCD44と、GPIにアンカ−された酵素であるHyal-2の様な受容体が互いに協力することで細胞表面に繋がれている。HA-CD44-Hyal-2複合体は特殊なマイクロドメインに豊富に存在する。これらは脂質ラフトと呼ばれる形質膜が陥入した所で、コレステロールとガングリオシドで構成され、多くの重要なシグナル分子の集積もするので重要である。脂質ラフトの1種がカベオレでカベオリンとフロチリンタンパク質が豊富な構造である。HAポリマーはそれにより、約50個の二糖単位に相当する20 kDaの大きさの限定生成物に分解される25。
水溶液中でのHAの生物学的性質は、NMR分光法による解析で明らかにされたが、可逆的な三次構造によって制御されているらしく、βシート様の配列が水素結合と疎水結合で安定化していることが示唆される。二次と三次の構造間で転移し易いので、機能間の切り替えにとって都合の良いメカニズムである。50個の二糖単位は、このような安定した三次構造の形成が期待できるおおよその分子サイズである26。20 kDaより大きいポリマーは、Hyal-2に対して好ましい基質となる。ヒアルアドヘリンがさらに基質特異性を与えているかも知れない27。 Hyal-2で生成されたHA断片は細胞中に取り込まれて、エンドソームに運ばれ、最終的にリソゾームに行く。そこではHyal-1が20 kDaのHAを小さな二糖に分解する。この二糖の分解は2種のリソゾームのβ-エキソグリコシダーゼ、すなわちβ-グルクロニダーゼおよびβ-N-アセチルグルコサミニダーゼで行われる。
後者に対する証拠はヒトのI-cell病から得られた。I-cell病患者の線維芽細胞は、リソゾーム酵素の取り込みに対するマンノース受容体経路が欠損しており、明らかなHA蓄積症を呈する(図1)。これらの線維芽細胞ではHAが強く染まる(R. Stern and B. Steinmann、未発表)。4糖および6糖のHA分解物はHA結合ペプチド染色(HA-BP)で検出するには小さすぎる。このことからβ-エキソグリコシダーゼは、最終ステップだけでなく、20 kDaのHA断片の分解反応の始めからずっと関与していることが示唆された。
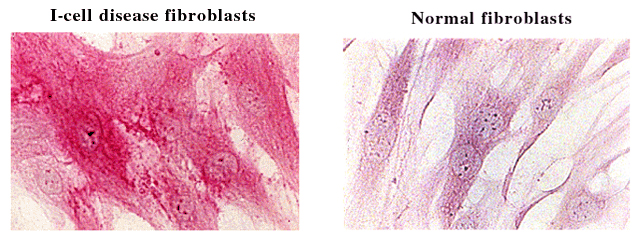
図 1 I-cell病患者由来と健常人由来培養ヒト線維芽細胞におけるヒアルロン酸分布の病理組織学的比較。
培養細胞はアセトンーエタノールで固定しウシ軟骨由来ビオチン標識HA結合ペプチドで染色した。細胞はスイスチューリッヒの小児病院のBeat Steinmann博士のご厚意により入手した。
I-cell病で特異的に欠損しているのはN-アセチルグルコサミン-1-リン酸転移酵素で、これはリソゾームで働く酵素をリソゾームに正しく向かわせるためのマーカーであるマンノース-6-リン酸認識マーカーを生合成するのに必須の酵素である。この酵素がないと新たに生合成されたリソゾーム酵素は正しい経路で進めない。I-cell病患者の血漿はHyal-1レベルは正常であるが、2つのβ-エキソグリコシダーゼが高値であることから28、Hyal-1はマンノース-6-リン酸とは違う経路でリソゾームに運ばれていることが示唆される。β-エキソグリコシダーゼがないと、大きいサイズのHAオリゴ糖がリソゾーム中に蓄積するようである。おそらく欠失しているのは、HA断片を十分に小さなサイズにしてリソゾームから原形質に拡散できるように断片化する能力であろう。単糖だけがリソゾームから拡散できるらしい。あるいはHA断片はアミノ酸や他の糖のような他の代謝物がするように特別なトランスポーターを通じてリソゾームから遊離するのかも知れない。このような推定上のトランスポーターはある種のサイズ制限があるらしく、なぜI-cell病では分子量の大きいHA断片がリソゾームから出ていけないのか、の説明となる。メカニズムに関わらずリソゾーム内に貯まった結果としてI-cell病ではHA-BPで染色されるHAオリゴマーの蓄積が見られるらしい。これは正常線維芽細胞では起きない現象である。
図式的に示したHA分解の全体図を以下に示す:
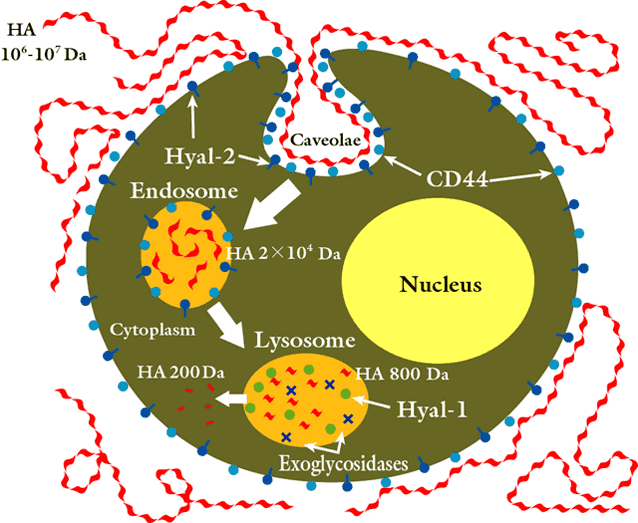
図 2 ヒアルロン酸の推定される分解様式
5. ヒアルロン酸のオリゴ糖サイズに依存した機能
HAはその鎖長の違いによって非常に異なる生物学的機能を有する。高分子HAと低分子HAは細胞の挙動に対して反対の作用および互いに阻害しあう作用があるらしい。細胞外にある高分子HA(〜107 Da)は空間を充填する分子であって組織を水和し、血管新生を抑制する29。また、抗炎症作用や免疫抑制作用もある30,31。低分子HAの断片は別の受容体群と相互作用し、シグナルカスケードや細胞の挙動の大きな変化の引き金となる。高分子ポリマーの機能としては、このような低分子断片への接近から細胞を守り、細胞−細胞間の相互作用を妨げ、さらにストレス反応やシグナルカスケード阻害が挙げられる。
高分子HAは創傷治癒の最も初期の段階で現れるが、その段階では創部に多核白血球が浸潤し易いような空間が必要である。浸潤した細胞は創部をきれいにし、残屑や壊死組織を取り除き、そして細菌を貪食する。同じ高分子HAポリマーは、フィブリノーゲンと高い結合能を持つが32、それは血餅形成の初期反応の1つであり、初期の創傷治癒にとって非常に重要である33。
Hyal-2で分解された20 kDaのHA断片は、強い血管新生作用や免疫刺激能を持つ中間サイズに分解される。このものは、また炎症性サイトカインの刺激能もある34。正常な肺では高分子HAが見出されるが、急性肺傷害後のHAは500 kDa以下のサイズであり、一連の炎症反応を始め維持する濃度となっている( M.M. Mascarenhas、私信)35。より小さい6-20 kDa範囲のオリゴ糖は、免疫系の抗原提示細胞である樹状細胞の活性化能を持つ36,37。
非常に小さなHAオリゴ糖は、またユニークな生物活性を持つ。6個の二糖単位からなるオリゴ糖は、より大きなHA断片の血管新生作用に応答して誘導された内皮細胞の分化を促進する。このことにより、HA分解の過程は注意深く制御されたカスケードであることが示唆される。皮膚角質細胞における遊走、成熟およびシグナル伝達の制御は、また小サイズのHAオリゴ糖と密接に関係しており、ポリマーのサイズの変化によって非常に異なるシグナル伝達経路が誘導されることと関係する(K. Törrönenら、私信)。この経路に大変精巧な選択性があることは、皮膚角質細胞上のCD44に結合しているHAは、HA10糖では置換されるが6糖ではできないと言う観察結果に見て取れる38。
Hyal-1分解では4糖が主要な生成物である。これらを培養細胞に加えるとヒートショックタンパク質の発現を誘導する39。また抗アポトーシス作用があるので、過温条件での培養、あるいは血清枯渇させて細胞を培養した時の細胞死を抑制する39。
6. 腫瘍との関連性
Hyal-1は癌抑制遺伝子産物の候補であり、肺だけでなく40、頭部、頸部および上部気道41と言った多くの喫煙関連の腫瘍組織では欠失されている。酵素はホモ接合の欠失あるいはヘテロ接合性の欠損によってDNAレベルで欠失させられるらしいが、RNAレベルでも同様である。幾つかの研究から2種の転写産物が生じ、大きい方のものは翻訳を阻害するretained intronを含んでいる42,43ことが示された。
Hyal-2は発癌遺伝子あるいは癌抑制遺伝子産物として機能できる。Hyal-2の過剰発現はマウス神経膠星状細胞腫の腫瘍形成を促進する44。Hyal-2はまた幾つかのレトロウイルスの細胞表面受容体でもあり、ウイルスのエンベロープタンパク質は発癌遺伝子の形質転換を仲介する45-47。Hyal-2の癌抑制遺伝子としての機能についての証拠もある。Hyal-2はアポトーシスを促進できる48。さらにアデノウイルス-Hyal-2ベクターはマウスに異種移植した腫瘍の増殖を抑制する49。最後に加えて、srcを形質転換させた線維芽細胞のHyal-2過剰発現クローンでは増殖率が減少した(B. Flamion、私信)。HAとヒアルロニダーゼの両方が、腫瘍促進と同時に腫瘍抑制に関わっていると言う難問については別の論文で取り上げる50。
小さなHAオリゴ糖は腫瘍細胞表面でCD44の分解を誘導し、移動や浸潤を促進する。これら6-14個の二糖単位からなるHA断片を作るヒアルロニダーゼ活性は細胞表面で働く活性であるらしいが、正常細胞ではあまり見られない51。マトリックスメタロプロテアーゼやカテプシンBのようなプロテアーゼの増強を含めて、複雑な酵素による修飾が腫瘍細胞の細胞表面で生じる。このような修飾はヒアルロニダーゼの活性にも関わっているように思われる。
HAオリゴ糖は腫瘍に対して増殖抑制能を有する。このことは幾つかのメカニズムによって生じるらしい。HAオリゴ糖は生体でも腫瘍形成を抑制できる。皮下に投与した場合、オリゴ糖はおそらくCD44に対する高分子HAマトリックスと競合することで腫瘍増殖を抑制する52。腫瘍の増殖や転移に必要な接着を阻害する53。HAオリゴ糖はホスホイノシチド3-キナーゼ/Akt細胞生存経路を抑制することによって足場に非依存的な腫瘍増殖を抑制し54、また多剤耐性を阻止する55このようにHA分解物は腫瘍増殖に対して内在性の腫瘍抑制効果を有すると共に化学療法剤に対して感受性を上げる作用を持つ。
注意しなければならないのは、腫瘍細胞はそれぞれ挙動が違うので、ここに示した分解様式(図2)は、悪性の腫瘍細胞の場合には修正が必要かも知れない。
7. 分解経路についての注意事項
しかしながら、示した分解経路の図式には多くの但し書きがつく。1)HA合成酵素3 (HAS3)の生成物はHAS1やHAS2で合成される高分子HAに比べ、小さなHA分子である。HAS3のレベルは急性肺疾患の様なストレス状態で増加する35。従って炎症性HAオリゴ糖は、HA分解産物として作られるだけでなく、ストレス状態下では直接HA合成酵素の生成物でもあり得る。2)また酸化条件で活性酸素中間体からのフリーラジカルがあると、エンドグリコシド結合がランダムに切断されて分解しHA断片が生じる56,57。フリーラジカルとヒアルロニダーゼはある種の病態、たとえば炎症の最初の段階や創傷治癒の初期に蓄積する多核白血球の呼吸性バーストの様な状態では、両者が協調してHA鎖を切断する活性を持つのかも知れない58。正常あるいは病態のいずれの条件下でもフリーラジカルによる切断と酵素的分解の相対比は定量されていない。 3)この分解体系の図式に使われている観察結果の多くは、サイズ毎に調製したHAオリゴ糖を培養細胞に加えて得られた実験結果に基づいている。これが生理的状況を表しているかどうかは全く明らかでない。HA断片を外から培養細胞に添加することは、細胞内に同様のHAの断片が形成されることと同じではないかも知れない。細胞内HAオリゴ糖が細胞から遊離するにしてもどのように排出されるかも分かっていない。4)HA製剤中の不純物が起炎作用の原因かも知れない。市販製剤中の低レベルDNAはその原因として疑われている59。高純度HAは広い分子量範囲に渡って起炎性がない(Huら、私信)。もしこの現象が検証されれば、低分子HAは血管新生や炎症作用の根拠にならなくなるので、分解体系についての病理生物学的再評価が必要になるだろう。
8. 結語
推定されるHAの代謝回転と分解についての様式、特にその制御機構には多くの答えられていない疑問がある。分解系の試案をここに示したが、この中で階段的に進むHAの分解は一連の連続的酵素反応を使って描かれている。特定サイズのHAの増加は特殊な病態と関係して起こるのかも知れない。Hyal-2活性の刺激あるいはHyal-1の抑制が、炎症、免疫刺激および血管新生を誘導するHA断片の蓄積を引き起こすだろう。
ヒアルロニダーゼの阻害物質は短時間作用物質として働くだろう。これはなぜ代謝回転率がそのように非常に速いのかを反映しているのかも知れない。ヒアルロニダーゼの持続的抑制状態を解放するとHAレベルがすぐに上昇する仕組みとなる。このような阻害物質は多くの組織中に検出されている。このことは、肝臓、筋肉、脾臓、心臓(未発表)と血清60からの酵素精製の最初の処置で阻害物質が酵素から分離された後、総ヒアルロニダーゼ活性が明らかに増加することという、間接証拠から支持される。このような阻害物質はヒアルロニダーゼそのものよりもっと多様な分子から成り立っているのかも知れない61,62。
HAに対する分解経路の全ての面から研究することは、とてつもなく複雑な仕事になって来た。特定のヒアルアドヘリンと、それぞれの段階でのヒアルロニダーゼと結合する特異的阻害物質およびそのHA基質が決定されねばならないだろう。単調な繰り返し構造を持つHA糖鎖がどう分解されるかの解明は、もっと複雑なプロテオグリカン結合型グリコサミノグリカンの分解の解明より、ずっと骨の折れることかも知れない。
References
- Shuttleworth TL, Wilson MD, Wicklow BA, Wilkins JA, Triggs-Raine BL: Characterization of the murine hyaluronidase gene region reveals complex organization and cotranscription of Hyal1 with downstream genes, Fus2 and Hyal3. J. Biol. Chem., 277, 23008-23018, 2002
- Flannery CR, Little CB, Hughes CE, Caterson B: Expression and activity of articular cartilage hyaluronidases. Biochem. Biophys. Res. Commun., 251, 824-829, 1998
- Nicoll SB, Barak O, Csoka AB, Bhatnagar RS, Stern R: Hyaluronidases and CD44 undergo differential modulation during chondrogenesis. Biochem. Biophys. Res. Commun., 292, 819-825, 2002
- Cherr G, Yudin AI, Overstreet JW: The dual functions of GPI-anchored PH-20: hyaluronidase and intracellular signaling. Matrix Biol., 20, 515-525, 2001
- Myles DG, Primakoff P: Why did the sperm cross the cumulus? To get to the oocyte. Functions of the sperm surface proteins PH-20 and fertilin in arriving at, and fusing with, the egg. Biol. Reprod., 56, 320-327, 1997
- Deng X, He Y, Martin-Deleon PA: Mouse Spam1 (PH-20): evidence for its expression in the epididymis and for a new category of spermatogenic-expressed genes. J. Androl., 21, 822-832, 2000
- Zhang H, Martin-DeLeon PA: Mouse Spam1 (PH-20) is a multifunctional protein: evidence for Its expression in the female reproductive tract. Biol Reprod., 49, 446-454, 2003
- Beech DJ, Madan AK, Deng N: Expression of PH-20 in normal and neoplastic breast tissue. J. Surg. Res., 103, 203-207, 2002
- Csoka AB, Scherer SW, Stern, R: Expression analysis of six paralogous human hyaluronidase genes clustered on chromosomes 3p21 and 7q31.Genomics, 60, 356-361, 1999
- Madan AK, Pang Y, Wilkiemeyer MB, Yu D, Beech DJ: Increased Hyaluronidase expression in more aggressive prostate adenocarcinoma. Oncol. Rep., 6, 1431-1433, 1999
- Madan AK, Yu K, Dhurandhar N, Cullinane C, PangY, Beech DJ: Association of hyaluronidase and breast adenocarcinoma invasiveness. Oncol. Rep., 6, 607-609, 1999
- Godin DA, Fitzpatrick PC, Scandurro AB, Belafsky PC, Woodworth BA, Amedee RG, Beech DJ, Beckman BS. PH20: a novel tumor marker for laryngeal cancer: Arch. Otolaryngol. Head Neck Surg. 126, 402-404, 2000
- Baba D, Kashiwabara S, Honda A, Yamagata K, Wu Q, Ikawa M, Okabe M, Baba T: Mouse sperm lacking cell surface hyaluronidase PH-20 can pass through the layer of cumulus cells and fertilize the egg. J. Biol. Chem., 277, 30310-30314, 2002
- Heckel D, Comtesse N, Brass N, Blin N, Zang KD, Meese E: Novel immunogenic antigen homologous to hyaluronidase in meningioma. Hum. Mol. Genet., 7, 1859-1872, 1998
- Comtesse N, Maldener E, Meese E: Identification of a nuclear variant of MGEA5, a cytoplasmic hyaluronidase and a beta-N-acetylglucosaminidase. Biochem. Biophys. Res. Commun. 283, 634-640, 2001
- Markovic-Housley Z, Miglierini G, Soldatova L, Rizkallah PJ, Muller U, Schirmer T: Crystal structure of hyaluronidase, a major allergen of bee venom. Structure Fold. Des. 8, 1025-1035, 2000
- Rigden DJ, Jedrzejas MJ, de Mello LV: Identification and analysis of catalytic TIM barrel domains in seven further glycoside hydrolase families. FEBS Lett., 544, 103-111, 2003
- Rigden DJ, Galperin MY, Jedrzejas MJ: Analysis of structure and function of putative surface-exposed proteins encoded in the Streptococcus pneumoniae genome: a bioinformatics-based approach to vaccine and drug design. Crit. Rev. Biochem. Mol. Biol., 38, 143-168, 2003
- Cherr GN, Meyers SA, Yudin AI, VandeVoort CA, Myles DG, Primakoff P, Overstreet JW: The PH-20 protein in cynomolgus macaque spermatozoa: identification of two different forms exhibiting hyaluronidase activity. Dev. Biol., 175, 142-153, 1996
- Collis L, Hall, C Lange L, Ziebell M, Prestwich R, Turley EA: Rapid hyaluronan uptake is associated with enhanced motility: implications for an intracellular mode of action. FEBS Lett., 440, 444-449, 1998
- Tammi R, Rilla K, Pienimaki JP, MacCallum DK, Hogg M, Luukkonen M, Hascall VC, Tammi M. Hyaluronan enters keratinocytes by a novel endocytic route for catabolism. J. Biol. Chem., 276, 35111-35122, 2001
- Culty M, Nguyen HA, Underhill CB: The hyaluronan receptor (CD44) participates in the uptake and degradation of hyaluronan. J. Cell Biol., 116, 1055-1062, 1992
- Hua Q, Knudson CB, Knudson W: Internalization of hyaluronan by chondrocytes occurs via receptor-mediated endocytosis. J. Cell Sci., 106, 365-375, 1993
- Kaya G, Rodriguez I, Jorcano JL, Vassalli P, Stamenkovic I: Selective suppression of CD44 in keratinocytes of mice bearing an antisense CD44 transgene driven by a tissue-specific promoter disrupts hyaluronate metabolism in the skin and impairs keratinocyte proliferation. Genes Dev., 11, 996-1007, 1997
- Lepperdinger G, Strobl B, Kreil G: HYAL2, a human gene expressed in many cells, encodes a lysosomal hyaluronidase with a novel type of specificity. J. Biol. Chem., 273, 22466-22470, 1998
- Scott JE, Heatley F: Biological properties of hyaluronan in aqueous solution are controlled and sequestered by reversible tertiary structures, defined by NMR spectroscopy. Biomacromolecules, 3, 547-553, 2002
- Day AJ, Sheehan JK: Hyaluronan: polysaccharide chaos to protein organization. Curr. Opin. Struct. Biol., 11, 617-622, 2001
- Natowicz MR, Wang Y: Plasma hyaluronidase activity in mucolipidoses II and III: marked differences from other lysosomal enzymes. Am. J. Med. Genet., 65, 209-212,1996
- Feinberg RN, Beebe DC: Hyaluronan in vasculogenesis. Science, 220, 1177-1179, 1983
- Delmage JM, Powars DR, Jaynes PK, Allerton SE: The selective suppression of immunogenecity by hyaluronic acid. Ann. Clin. Lab. Sci., 16, 303-310, 1986
- McBride WH, Bard JB: Hyaluronidase-sensitive halos around adherent cells. Their role in blocking lymphocyte-mediated cytolysis. J. Exp. Med., 149, 507-515, 1979
- Frost SJ, Weigel PH: Binding of hyaluronic acid to mammalian fibrinogens. Biochim. Biophys. Acta., 1034, 39-45, 1990
- Weigel PH, Fuller GM, LeBoeuf RD: A model for the role of hyaluronic acid and fibrin in the early events during the inflammatory response and wound healing. J. Theor. Biol., 119, 219-234, 1986
- Noble PW: Hyaluronan and its catabolic products in tissue injury and repair. Matrix Biol., 21, 25-29, 2002
- Mascarenhas MM, Day RM, Ochoa CD, Choi WI, Yu L, Ouyang B, Garg HG, Hales CA, Quinn DA: Low molecular weight hyaluronan from streched lung enhances IL-8 expression. Am. J. Respir. Cell Mol. Biol., 30, 51-60, 2003
- Termeer CC, Hennies J, Voith U, Ahrens T, Weiss JM, Prehm P, Simon JC: Oligosaccharides of hyaluronan are potent activators of dendritic cells. J. Immunol., 165, 1863-1870, 2000
- Termeer C, Sleeman JP, Simon JC: Hyaluronan - magic glue for the Regulation of the immune response? Trends Immunol., 24, 112-114, 2003
- Tammi R, MacCallum D, Hascall VC, Pienimaki JP, Hyttinen M, Tammi M: Hyaluronan bound to CD44 on keratinocytes is displaced by hyaluronan decasaccharides and not hexasaccharides. J. Biol. Chem., 273, 28878-28888, 1998
- Xu H, Ito T, Tawada A, Maeda H, Yamanokuchi H, Isahara K, Yoshida K, Uchiyama Y, Asari A: Effect of hyaluronan oligosaccharides on the expression of heat shock protein 72. J. Biol. Chem., 277, 17308-17314, 2002
- Lerman MI, Minna JD: The 630-kb lung cancer homozygous deletion region on human chromosome 3p21.3: identification and evaluation of the resident candidate tumor suppressor genes. The International Lung Cancer Chromosome 3p21.3 Tumor Suppressor Gene Consortium. Cancer Res., 60, 6116-6133, 2000
- Csoka TB, Frost GI, Heng HH, Scherer SW, Mohapatra G, Stern R: The hyaluronidase gene HYAL1 maps to chromosome 3p21.2-p21.3 in human and 9F1-F2 in mouse, a conserved candidate tumor suppressor locus. Genomics, 48, 63-70, 1998
- Frost GI, MohapatramG, Wong TM, Csoka AB, Gray JW, Stern R: HYAL1 LUCA-1, a candidate tumor suppressor gene on chromosome 3p21.3, is inactivated in head and neck squamous cell carcinomas by aberrant splicing of pre-mRNA. Oncogene, 19, 870-877, 2000
- Junker N, Latini S, Petersen LN, Kristjansen PE: Expression and regulation patterns of hyaluronidases in small cell lung cancer and glioma lines. Oncol. Rep., 10, 609-616, 2003
- Novak U, Stylli SS, Kaye AH, Lepperdinger G: Hyaluronidase-2 overexpression accelerates intracerebral but not subcutaneous tumor formation of murine astrocytoma cells. Cancer Res., 59, 6246-6250, 1999
- Rai SK, Duh FM, Vigdorovich V, Danilkovitch-Miagkova A, Lerman MI, Miller AD: Candidate tumor suppressor HYAL2 is a glycosylphosphatidylinositol (GPI)- anchored cell-surface receptor for jaagsiekte sheep retrovirus, the envelope protein of which mediates oncogenic transformation. Proc. Natl. Acad. Sci. USA, 98, 4443-4448, 2001
- Maeda N, Palmarini M, Murgia C., Fan H: Direct transformation of rodent fibroblasts by jaagsiekte sheep retrovirus DNA. Proc. Natl. Acad. Sci. USA, 98, 4449-4454, 2001
- Danilkovitch-Miagkova A, Duh FM, Kuzmin I, Angeloni D, Liu SL, Miller AD, Lerman MI: Hyaluronidase 2 negatively regulates RON receptor tyrosine kinase and mediates transformation of epithelial cells by jaagsiekte sheep retrovirus. Proc. Natl. Acad. Sci. U S A, 100, 4580-4585
- Chang NS: Transforming growth factor-beta1 blocks the enhancement of tumor necrosis factor cytotoxicity by hyaluronidase Hyal-2 in L929 fibroblasts. BMC. Cell Biol., 3, 8-12, 2002
- Ji L, Nishizaki M, Gao B, Burbee D, Kondo M, Kamibayashi C, Xu K, Yen N, Atkinson EN, Fang B, Lerman MI, Roth JA, Minna JD: Expression of several genes in the human chromosome 3p21.3 homozygous deletion region by an adenovirus vector results in tumor suppressor activities in vitro and in vivo. Cancer Res., 62, 2715-2720, 2002
- Stern R: Hyaluronan degradation in tumor growth and metastasis Trends Glycobiol Glycotech (in press), 2004
- Murai T, Miyazaki Y, Nishinakamura H, Sugahara KN, Miyauchi T, Sako Y, Yanagida T, Miyasaka M: Engagement of CD44 promotes Rac activation and CD44 cleavage during tumor cell migration. J. Biol. Chem., 279, 4541-4550, 2004
- Zeng C, Toole BP, Kinney SD, Kuo JW, Stamenkovic I: Inhibition of tumor growth in vivo by hyaluronan oligomers. Int. J. Cancer, 77,396-401, 1998
- Peterson RM, Yu Q, Stamenkovic I, Toole BP: Perturbation of hyaluronan interactions by soluble CD44 inhibits growth of murine mammary carcinoma cells in ascites. Am. J. Pathol., 156, 159-2167, 2000
- Ghatak S, Misra S, Toole BP: Hyaluronan oligosaccharides inhibit anchorage-independent growth of tumor cells by suppressing the phosphoinositide 3-kinase/Akt cell survival pathway. J. Biol. Chem., 277, 38013-38020, 2002
- Misra S, Ghatak S, Zoltan-Jones A, Toole BP: Regulation of multidrug resistance in cancer cells by hyaluronan. J. Biol. Chem., 278, 25285-25288, 2003
- McNeil JD, Webkin OW, Betts WH, Cleland LG. Depolymerisation products of hyaluronic acid after exposure to oxygen-derived free radicals. Ann. Rheum. Dis., 44, 780-789, 1985
- Hawkins CL, Davies M J: Direct detection and identification of radicals generated during the hydroxyl radical-induced degradation of hyaluronic acid and related materials. Free Radic. Biol.Med., 21, 275-290, 1996
- Moseley R, Waddington RJ, Embery G: Degradation of glycosaminoglycans by reactive oxygen species derived from stimulated polymorphonuclear leukocytes. Biochim. Biophys. Acta., 1362, 221-231, 1997
- Filion MC, Phillips NC: Pro-inflammatory activity of contaminating DNA in hyaluronic acid preparations. J. Pharm. Pharmacol., 53, 555-561, 2001
- Afify AM, Stern M, Guntenhoener M, Stern R: Purification and characterization of human serum hyaluronidase. Arch. Biochem. Biophys., 305, 434-441, 1993
- Mio K, Carrette O, Maibach HI, Stern R: Evidence that the serum inhibitor of hyaluronidase may be a member of the inter-alphan-inhibitor family. J. Biol. Chem., 275, 32413-32421, 2000
- Mio K, Stern R: Inhibitors of the hyaluronidases. Matrix Biol., 21, 31-37, 2002


