May. 17, 2006
ガングリオシドGM3と2型糖尿病(2006 Vol.10, A2)
井ノ口 仁一
氏名:井ノ口 仁一
1953年福岡県に生まれる。福岡大学薬学部薬学科を卒業。同大学院、生化学教室助手を経て、1985年ミシガン大学医学部神経化学研究所博士研究員(Norman Radin教授、フルブライト上級研究員)。スフィンゴ糖脂質生合成阻害剤(PDMP)について研究。1991年生化学工業株式会社東京研究所主任研究員を経て、1998年北海道大学大学院薬学研究科助教授。この間、スフィンゴ糖脂質の生合成阻害剤および促進剤の開発と病態生理学的意義の解明に関する研究に従事し、最近はマイクロドメインの機能解明に注力している。2003年より戦略的創造研究推進事業CREST(糖鎖の生物機能の解明と利用技術)研究代表者。研究課題「マイクロドメイン機能異常にもとづく2型糖尿病の病態解明」。2006年より、東北薬科大学分子生体膜研究所教授。
1. 要旨
細胞膜マイクロドメイン(lipid raft)は、多様なインスリンシグナル伝達の適正な仕分けに重要な役割を果たしており、特に2型糖尿病とインスリン抵抗性の病態における役割が注目されている。炎症性サイトカインTNFαはインスリン抵抗性を誘導するが、その発現機構は十分には解明されていない。5年前に我々は、TNFαで刺激した脂肪細胞や典型的な肥満糖尿病モデル動物の脂肪組織では、ガングリオシドGM3およびその合成酵素遺伝子の発現が著しく増加している事を見いだした。その後の様々な検討の中で、インスリン代謝性シグナルの欠損はGM3の過剰蓄積によるインスリン受容体のマイクロドメインからの解離によるものであることが判りつつある。我々の発見は、2型糖尿病などの生活習慣病の新たな病態像の解明に繋がるものと期待している。
2. はじめに
世界の糖尿病患者数は1985年3000万人、1995年1億7700万人、2025年には3億人になると予測され増加の一途をたどっている。国内でも今日、糖尿病が強く疑われる人は700万人を超えており、緊急の対策が必要である。特に、2型糖尿病は糖尿病全人口の90〜95%を占めている。
インスリン抵抗性は、「インスリン感受性の細胞または臓器が生理的レベルのインスリンに対する反応性が低下している状態」と定義され、2型糖尿病の病態生理の最も上流に位置する1(図1)。
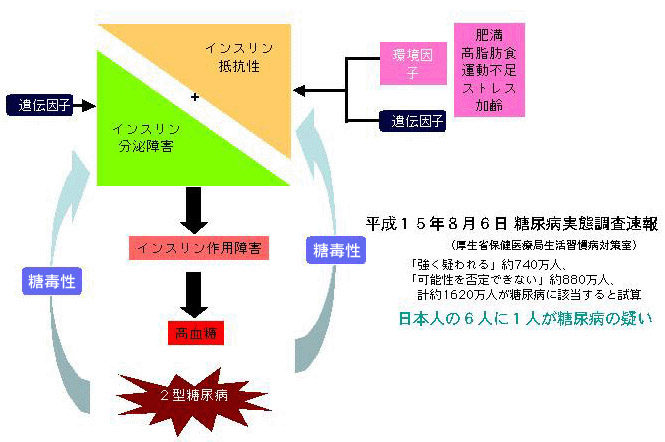
図 1 21世紀はインスリン抵抗性との戦い
近年の脂肪細胞に関する研究の進歩は著しい。これまで、単なるエネルギー貯蔵臓器としてしか捉えられてこなかった脂肪組織は、実はアディポサイトカインと総称される多彩な生理活性物質を産生する生体最大の内分泌臓器であることが知られるようになった。特に、肥満における内蔵脂肪の過剰蓄積に伴う脂肪細胞の機能異常、すなわちアディポサイトカインの分泌異常(例えば、炎症性サイトカインTNFαの過剰分泌やアディポネクチンの分泌低下など)が、インスリン抵抗性を惹起し2型糖尿病や動脈硬化性疾患の多彩な病態の成因として重要な役割を果たしていることが明らかにされている。最近、白色脂肪組織においてマクロファージがリクルートされ脂肪組織中に侵入し炎症性サイトカインを分泌し、その結果インスリン抵抗性を惹起することが見いだされ、脂肪組織に潜在する骨髄系細胞の病態生理が注目されている(図2)。
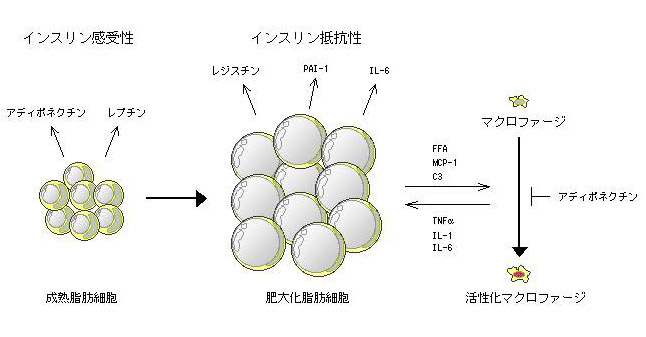
図 2 脂肪細胞におけるインスリン抵抗性の病態
培養脂肪細胞や動物モデル用いた多くの研究によりTNFαのインスリン抵抗性状態への関与が示されている2-4。遺伝的な肥満モデルであるdb/dbマウス、ob/obマウス、およびZuckerラットや肥満2型糖尿病患者の脂肪組織では、TNFα mRNA 発現レベルの有意な上昇が認められている2,3。例えば、可溶性のTNFα受容体-IgG キメラ蛋白をZuckerラットに投与してTNFαを中和すると、インスリン抵抗性状態が軽減したり、TNFα遺伝子ノックアウトマウスはインスリン抵抗性が起こらない4。これらの知見より、中性脂肪を過剰に蓄積して肥大化した脂肪組織がTNFαを過剰に産生することがインスリン抵抗性の原因として中心的な位置を占める。
ガングリオシドGM3は、ラット、マウス、ヒトの種を超えて脂肪組織の主要なガングリオシドである5。外因性に添加したGM3はEGF受容体6やインスリン受容体7のリガンド依存性の自己リン酸化を抑制することが示されていた。また、ガングリオシド(スフィンゴ糖脂質)、スフィンゴミエリン、コレステロールなどの相転移温度が高い脂質群が集積して形成される細胞膜カベオラマイクロドメインにインスリン受容体が存在していることから8、細胞膜におけるインスリンシグナル伝達においてもGM3が影響を与えている可能性がある。本稿では、TNFα刺激によるGM3合成亢進がマイクロドメインの機能異常を引き起こし、インスリンの代謝性シグナルを選択的に抑制している可能性について、我々の最近の結果を中心に紹介する。
3. ガングリオシドGM3はインスリン抵抗性を惹起する
インスリンは多様な生物活性を発揮するが、大別すると代謝性活性と増殖性活性に区別される(GlycoWord GD-B03参照)。インスリン受容体 (IR) にインスリンが結合するとIRのチロシン自己リン酸化、それに続いてアダプター蛋白であるinsulin receptor substrate (IRS) のチロシンリン酸化が起こる。リン酸化されたIRSは、PI3キナーゼを活性化し、glucose transporter 4 (GLUT-4)の細胞膜へ移行させる結果、糖の取り込みを促進する。このIR-IRS-PI3キナーゼ経路は、インスリンの代謝経路の中心的位置を占める。一方、インスリン増殖性シグナルは活性化したIRによるShcのリン酸化に始まり、Ras-MAPK 経路の活性化に繋がる。
我々は、マウスの3T3-L1脂肪細胞をIRS-1およびGLUT4の発現が抑制されない100pMのTNFαで4日間培養すると、インスリン刺激によるIRのチロシン自己リン酸化の中等度の抑制とIRS-1のチロシンリン酸化の著しい抑制が起こることを確認した9。この濃度レベルのTNFαで脂肪細胞にインスリン抵抗性状態を誘導するには3日間以上の慢性的な刺激が必要なことから、TNFαによってインスリンシグナルの未知の阻害物質の発現が増加する可能性が推定された。そこで、TNFα刺激による3T3-L1脂肪細胞のGM3の発現を経時的に検討したところ、TNFα処理時間に依存したGM3含量の増加が認められ、このGM3の発現増加はSAT-I遺伝子の発現およびSAT-IのGM3合成酵素活性の上昇とよく相関し、転写レベルでの活性化が起こっていた9。
TNFα刺激3T3-L1脂肪細胞のインスリン抵抗性の獲得に伴って増加したGM3のインスリンシグナルへの影響を明らかにする為に、グルコシルセラミド合成酵素の特異的阻害剤D-PDMP (GlycoWord GL-A06参照) 10,11を用いた検討を行った。D-PDMPによりTNFα刺激で増加したGM3の発現が抑制されるとともに、IRS-1のチロシンリン酸化の抑制がほぼ解除された。この結果から、GM3の増加はIR-IRS-1シグナルを脱共役していることが示された。これらの我々の知見は、GM3合成酵素ノックアウトマウスではインスリンシグナルが亢進していることからも支持される12。
Hotamisligil等は、脂肪細胞のTNFα処理はIRS-1のセリン残基のリン酸化を促進する事を報告し、このセリンリン酸化IRSはIRのチロシンキナーゼ活性を直接阻害する重要な反応であることを明らかにした13。我々は、D-PDMPによってTNFα刺激で誘導されるGM3の発現増加を阻止すること、IRS-1のセリンリン酸化も抑制されることを見いだしことから、GM3の増加はIRS-1のセリンリン酸化を促進する可能性が示唆された9。TNFαで誘導されるIRS-1のセリンリン酸化酵素としてはprotein kinase C、c-Jun NH2-terminal kinase、p44/42 kinase、そしてPI 3-kinaseなどの種々のキナーゼがあることから、内在性GM3の増加によってどのキナーゼが活性化されるかを同定することは今後の重要な課題である。
肥満糖尿病モデルであるdb/db、ob/ob、KK-AyマウスやZucker fa/faラットの脂肪組織では、それらのコントロール動物 (lean) と比較するとTNFαの著しい産生上昇が認められる3。興味あることに、これらの肥満糖尿病モデル動物ではTNFα、IL-1またはIFNγの産生に変化は無い3,14。そこで我々は、Zucker fa/faラットとob/obマウスの副睾丸脂肪組織のGM3合成酵素遺伝子発現を解析したところ、これらの典型的インスリン抵抗性モデルの脂肪組織ではGM3 synthase mRNAおよびGM3レベルの著しい上昇が認められた(図3)9。現在、ヒトの2型糖尿病の脂肪組織および血中GM3レベルを他のモデル動物とともに分析中である。
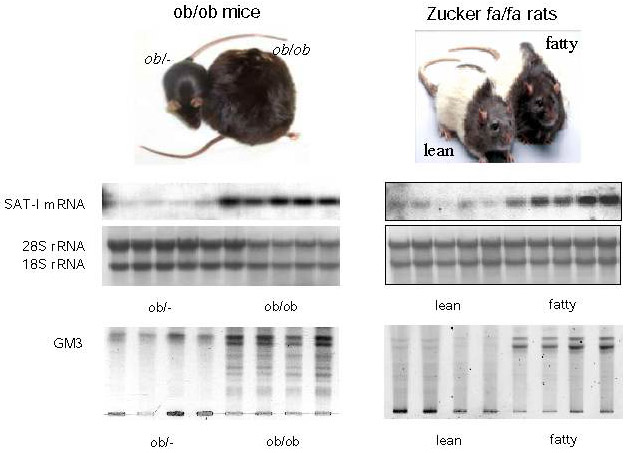
図 3 肥満モデル動物の脂肪組織ではGM3の発現が亢進する
4. カベオラマイクロドメインとインスリンシグナル
細胞膜には、コレステロールとスフィンゴ糖脂質 (GSLs) に富み、リン脂質を欠いた、界面活性剤に不溶性であるdetergent resistant microdomains (DRMs) と呼ばれるサブドメインがある15,16。現在までの10年間に多くの研究室から、この脂質マイクロドメインが多様なインスリンシグナルの正常な仕分けに重要な機能を持っている可能性が特に脂肪細胞を用いて報告されてきた17,18。脂肪細胞には、カベオラと呼ばれるマイクロドメインが豊富に存在し、インスリン代謝性シグナル伝達には必須であることが報告された19,20。β-cyclodextrinによるコレステロールの枯渇によりマイクロドメインを破壊すると、IRS-1のチロシンリン酸化と糖取り込み活性の低下が起こるが、IRの自己リン酸化とMAPキナーゼ活性化は変化しない20。この選択的なインスリン代謝性シグナルの抑制は、実際に糖尿病患者でも認められることからも1、マイクロドメインの機能異常が糖尿病病態に深く関わっている可能性が示唆される。
Couet等は、IRのβサブユニットにはカベオリン結合モチーフ (φXXXXφXXφ) が存在し、カベオリンのスキャフォールドドメインと結合していることを示した21。さらに、IRのこのモチーフの変異によりインスリンシグナルが抑制されることが判った22。事実、IR βサブユニットの変異が糖尿病患者で見つかっている23。最近、Lisanti教授の研究室は、カベオリン-1 KOマウスでは高脂肪食下でインスリン抵抗性を発症することを報告した24。興味あることにこのKOマウスでは、脂肪細胞選択的にIR自己リン酸化とその下流のインスリンシグナルが抑制されていたが筋肉と肝臓では正常であった。カベオリン-1 KOマウス脂肪細胞ではIRのmRNA発現レベルは正常であったが蛋白レベルでの発現が90%低下していることから、カベオリン-1がIR蛋白を安定に保っていることが示された18,24。これらの研究は、脂肪細胞においてインスリンシグナルが正常に行われるためにはカベオリン-1とIRの相互作用が必須であることを明らかにしている。
上記のようにカベオリン-1とIRの相互作用が示されたにもかかわらず、IRのDRMs/カベオラに存在に関しては相反する多くの報告がなされた25-29。Saltielと共同研究者達は、3T3-L1脂肪細胞のインスリン刺激はカベオリン-1のチロシンリン酸化を併発することを見いだした30。しかしながら、1% Triton X-100を用いてDRMを調製したところ痕跡レベルのIRしか存在していなかったことから、IRとカベオリンの間を結ぶ分子の存在を予想した28。Gustavsson等も0.3%と0.1% Triton X-100で調製したカベオリンを含むDRMからIRは解離していることを観察している26。DRMの調製には種々の界面活性剤が用いられ蛋白および脂質組成が大きく異なってくることが報告されている。中でもTriton X-100は、グリセロリン脂質よりスフィンゴ脂質とコレステロールを多く集積させることができ、DRMに特異的な蛋白を集積させることができる最も信頼性のある界面活性剤である31。そこで我々は、マイクロドメインに弱く会合している蛋白を検出するために非常に広いTriton X-100の濃度を使用してDRMを調製することにした。我々は、0.08% 以下の低濃度のTriton X-100でDRMを調製することではじめて正常脂肪細胞のDRMにIRの存在を証明した32。Table 1 にIRがカベオラマイクロドメインに存在することが、インスリンの代謝性シグナルに必須であることを示した現在までの研究をまとめている。
Table 1 Localization of insulin receptor in caveolae microdomains is essential for metabolic signaling of insulin

5. マイクロドメイン病としてのインスリン抵抗性
TNFαで刺激した脂肪細胞のインスリン抵抗性状態の誘導には、GM3合成酵素遺伝子の発現亢進によるGM3合成量の増加が関与し、さらに増加したGM3はインスリンシグナルの阻害剤として機能する可能性を示した9。GM3は脂肪細胞のDRMs/カベオラの重要な構成要素であることから、TNFα刺激した脂肪細胞におけるGM3の増加がマイクロドメインの構造と機能への影響を検討した。その結果、GM3の増加はラフトマーカーであるカベオリンやフローチリンのDRMへの集積には影響を与えず、IRをDRMから解離することを見いだした32。IRのDRMへの集積にはカベオリン-1との会合が重要であることをすでに述べたが、過剰のGM3のDRMへの集積によりIRとカベオリン-1の相互作用が弱まったことが予想される。未発表ではあるが、抗GM3抗体による免疫沈降ではIRは共沈降するが、カベオリン-1はしないことから、IR-GM3およびIR-caveolin-1の独立した複合体の存在が予想される。現在、マイクロドメインにおけるGM3、IRおよびカベオリン-1相互作用機構について新知見が得られつつある。
6. 展望
インスリン抵抗性状態におけるマイクロドメインの構造と機能の変化を図4に描いてみた。我々は「2型糖尿病などの生活習慣病の病態は、スフィンゴ糖脂質の発現異常によってマイクロドメインの構成・構造および機能が変化し、シグナル伝達が異常になったマイクロドメイン病である」という新しい病態概念を提唱している。今後、この作業仮説の証明に向けてさらなる努力を傾注することにより、マイクロドメイン矯正療法ともいうべき、新たな治療戦略を開発したい。
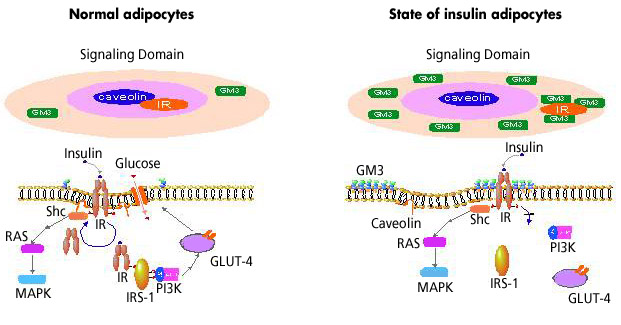
図 4 マイクロドメイン病としてのインスリン抵抗性
References
- Virkamaki A, Ueki K, Kahn CR: Protein-protein interaction in insulin signaling and the molecular mechanisms of insulin resistance. J. Clin. Invest. 103, 931-943, 1999
- Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM: Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance. J. Clin. Invest., 95, 2409-2415, 1995
- Hotamisligil GS, Shargill NS, Spiegelman BM: Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science, 259, 87-91, 1993
- Uysal KT, Wiesbrock SM, Marino MW, Hotamisligil GS: Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function. Nature, 389, 610-614, 1997
- Ohashi M: A comparison of the ganglioside distributions of fat tissues in various animals by two-dimensional thin layer chromatography. Lipids, 14, 52-57, 1979
- Bremer EG, Schlessinger J, Hakomori S: Ganglioside-mediated modulation of cell growth. Specific effects of GM3 on tyrosine phosphorylation of the epidermal growth factor receptor. J. Biol. Chem., 261, 2434-2440, 1986
- Nojiri H, Stroud M, Hakomori S: A specific type of ganglioside as a modulator of insulin-dependent cell growth and insulin receptor tyrosine kinase activity. Possible association of ganglioside-induced inhibition of insulin receptor function and monocytic differentiation induction in HL-60 cells. J. Biol. Chem., 266, 4531-4537, 1991
- Gustavsson J, Parpal S, Karlsson M, Ramsing C, Thorn H, Borg M, Lindroth M, Peterson KH, Magnusson KE, Stralfors P: Localization of the insulin receptor in caveolae of adipocyte plasma membrane. FASEB J., 13, 1961-1971, 1999
- Tagami S, Inokuchi J, Kabayama K, Yoshimura H, Kitamura F, Uemura S, Ogawa C, Ishii A, Saito M, Ohtsuka Y, Sakaue S, Igarashi Y: Ganglioside GM3 participates in the pathological conditions of insulin resistance. J. Biol. Chem., 277, 3085-3092, 2002
- Inokuchi J, Momosaki K, Shimeno H, Nagamatsu A, Radin NS: Effects of D-threo-PDMP, an inhibitor of glucosylceramide synthetase, on expression of cell surface glycolipid antigen and binding to adhesive proteins by B16 melanoma cells. J. Cell Physiol., 141, 573-583, 1989
- Inokuchi J, Radin NS: Preparation of the active isomer of 1-phenyl-2-decanoylamino-3-morpholino-1- propanol, inhibitor of murine glucocerebroside synthetase. J. Lipid Res.,28, 565-571, 1987
- Yamashita T, Hashiramoto A, Haluzik M, Mizukami H, Beck S, Norton A, Kono M, Tsuji S, Daniotti JL, Werth N, Sandhoff R, Sandhoff K, Proia RL: Enhanced insulin sensitivity in mice lacking ganglioside GM3. Proc. Natl. Acad. Sci. USA, 100, 3445-3449, 2003
- Hotamisligil GS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM: IRS-1-mediated inhibition of insulin receptor tyrosine kinase activity in TNF-alpha- and obesity-induced insulin resistance. Science, 271, 665-668, 1996
- Hotamisligil GS, Spiegelman BM: Tumor necrosis factor alpha: a key component of the obesity-diabetes link. Diabetes, 43, 1271-1278, 1994b
- 1Hakomori SI: Cell adhesion/recognition and signal transduction through glycosphingolipid microdomain. Glycoconj J. 17, 143-151, 2000
- Simons K, Toomre D: Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol., 1, 31-39, 2000
- Bickel PE: Lipid rafts and insulin signaling. Am. J. Physiol. Endocrinol. Metab., 282, E1-E10, 2002
- Cohen AW, Combs TP, Scherer PE, Lisanti MP: Role of caveolin and caveolae in insulin signaling and diabetes. Am. J. Physiol. Endocrinol. Metab., 285, E1151-1160, 2003b
- Fan JY, Carpentier JL, van Obberghen E, Grunfeld C, Gorden P, Orci L: Morphological changes of the 3T3-L1 fibroblast plasma membrane upon differentiation to the adipocyte form. J. Cell. Sci., 61, 219-230, 1983
- Parpal S, Karlsson M, Thorn H, Stralfors P: Cholesterol depletion disrupts caveolae and insulin receptor signaling for metabolic control via insulin receptor substrate-1, but not for mitogen-activated protein kinase control. J. Biol. Chem., 276, 9670-9678, 2001
- Couet J, Li S, Okamoto T, Ikezu T, Lisanti MP: Identification of peptide and protein ligands for the caveolin-scaffolding domain. Implications for the interaction of caveolin with caveolae-associated proteins. J. Biol. Chem., 272, 6525-6533, 1997
- Nystrom FH, Chen H, Cong LN, Li Y, Quon MJ: Caveolin-1 interacts with the insulin receptor and can differentially modulate insulin signaling in transfected Cos-7 cells and rat adipose cells. Mol. Endocrinol., 13, 2013-2024, 1999
- Imamura T, Takata Y, Sasaoka T, Takada Y, Morioka H, Haruta T, Sawa T, Iwanishi M, Hu YG, Suzuki Y, et al.: Two naturally occurring mutations in the kinase domain of insulin receptor accelerate degradation of the insulin receptor and impair the kinase activity. J. Biol. Chem., 269, 31019-27, 1994
- Cohen AW, Razani B, Wang XB, Combs TP, Williams TM, Scherer PE, Lisanti MP: Caveolin-1-deficient mice show insulin resistance and defective insulin receptor protein expression in adipose tissue. Am. J. Physiol. Cell Physiol., 285, C222-235, 2003a
- Iwanishi M, Haruta T, Takata Y, Ishibashi O, Sasaoka T, Egawa K, Imamura T, Naitou K, Itazu T, Kobayashi M: A mutation (Trp1193-->Leu1193) in the tyrosine kinase domain of the insulin receptor associated with type A syndrome of insulin resistance. Diabetologia, 36, 414-422, 1993
- Gustavsson J, Parpal S, Karlsson M, Ramsing C, Thorn H, Borg M, Lindroth M, Peterson KH, Magnusson KE, Stralfors P: Localization of the insulin receptor in caveolae of adipocyte plasma membrane. Faseb. J., 13, 1961-1971, 1999
- Kimura A, Mora S, Shigematsu S, Pessin JE, Saltiel AR: The insulin receptor catalyzes the tyrosine phosphorylation of caveolin-1. J. Biol. Chem., 277, 30153-30158, 2002
- Mastick CC, Saltiel AR: Insulin-stimulated tyrosine phosphorylation of caveolin is specific for the differentiated adipocyte phenotype in 3T3-L1 cells. J. Biol. Chem., 272, 20706-20714, 1997
- Muller G, Jung C, Wied S, Welte S, Jordan H, Frick W: Redistribution of glycolipid raft domain components induces insulin-mimetic signaling in rat adipocytes. Mol. Cell Biol., 21, 4553-4567, 2001
- Mastick CC, Brady MJ, Saltiel AR: Insulin stimulates the tyrosine phosphorylation of caveolin. J. Cell Biol., 129, 1523-1531, 1995
- Schuck S, Honsho M, Ekroos K, Shevchenko A, Simons K: Resistance of cell membranes to different detergents. Proc. Natl. Acad. Sci. USA, 100, 5795-5800, 2003
- Kabayama K, Sato T, Kitamura F, Uemura S, Kang, BW, Igarashi Y, Inokuchi J: TNFalpha-induced insulin resistance in adipocytes as a membrane microdomain disorder: involvement of ganglioside GM3. Glycobiology, 15, 21-29, 2005





