氏名:里村 慎二
京都大学農学部農芸化学科卒業
京都大学農学博士
1978-2011 和光純薬工業株式会社
2011-2015 Wako Life Sciences、Inc.
臨床検査薬、臨床検査システムの研究開発、新規検査項目の臨床研究、厚労省/FDA承認、海外マーケティングに従事
2016-present 大阪大学大学院医学研究科 招へい教授
医学研究報告90報
α-Fetoprotein(AFP)は1963年Abelevら1によりマウス血清中から発見され、1971年に肝細胞がんで血清中濃度が上昇することがAlpertら2により報告された。AFPは正常胎児肝臓において生成され、胎児血中に高濃度で存在するが、出産後数週間でアルブミンに置き換えられる。そのため癌胎児性タンパク質と呼ばれている。AFPは代表的な腫瘍マーカーとして、40年以上世界中で肝細胞がんの診療において臨床応用されている。しかし、肝細胞がんの背景疾患として多くの症例で認められる肝炎、肝硬変においてもAFPは上昇し、その特異性の問題を指摘されていた。
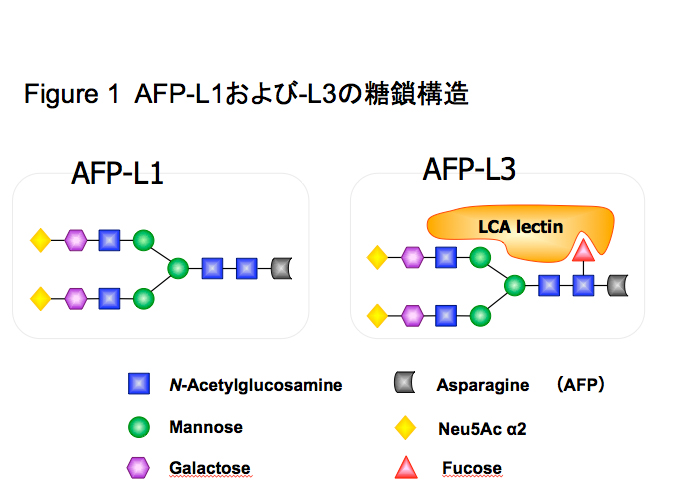
AFPには1分子あたり1本のN-結合型糖鎖が結合しており、代表的な糖鎖構造も決定されている。1973年Bog-Hansenら3、1981年にBreborowiczら4によって、AFP分子に肝細胞がんに特徴的な糖鎖変異があることが報告された。
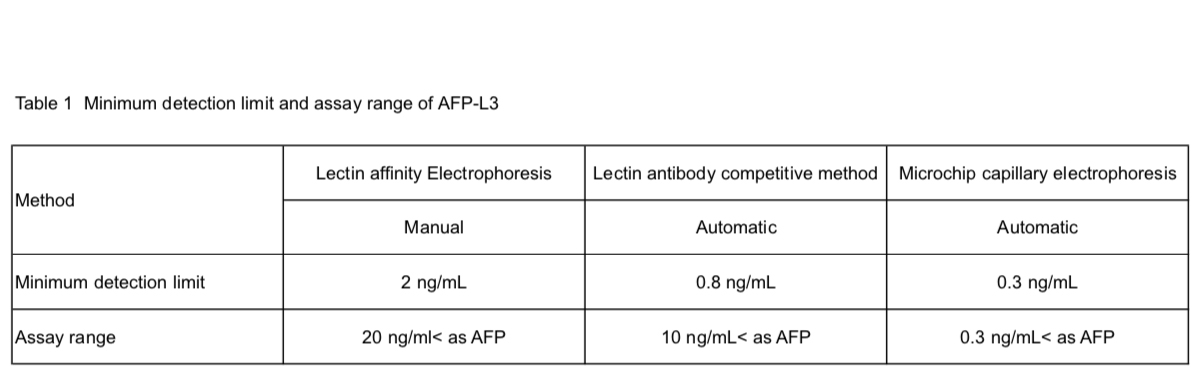
AFPの糖鎖変異の臨床応用は、1988年にAoyagiら5、1990年にTaketaら6が糖鎖特異的レクチンを使用したレクチン親和電気泳動法により報告をしている。AFPの癌性糖鎖変異はComplex2本鎖コアへのα1-6フコースの付加と非還元末端へのモノシアル酸の付加が主であり7,8、前者はレクチン親和電気泳動での分画位置からAFP-L3と命名されている(Fig. 1)。AFP-L3の測定には、α1-6フコースに特異的なレンズマメレクチン(LCA)などを持ちいたレクチンアガロースゲル電気泳動5、レクチン親和電気泳動6,7、LCAレクチン抗体阻害法8、マイクロチップキャピラリー電気泳動11等が用いられている。測定方法により検出感度と精度が異なり、低濃度のAFP値においても測定ができる高感度測定になるほど、臨床的有用性が高くなっている(Table 1)。後者のモノシアル酸変異の測定には、シアル酸に反応するレクチン電気泳動7や等電点電気泳動12が用いられている。AFPの糖鎖変異の中で臨床的な有用性が最も高いのはAFP-L3と考えられ、報告も最も多い。
AFP濃度とAFP-L3%(AFP-L3のAFPに対するパーセント)とは全く相関しない。そのため、AFPと比較したAFP-L3の肝細胞がんの診療上の有用性は、主にAFP低値の時に認められる。腫瘍の進展によりAFP濃度が上昇してくる前の低値の時にAFP-L3が上昇してくることによる早期検出、あるいは肝細胞がんの治療後にAFP濃度が低下した場合の遺残癌の検出等である。
90年代になると日本ではB型、C型肝炎ウイルス陽性の慢性肝炎、肝硬変に対して、超音波検査を主体にしたサーベイランスが推奨されてきた。超音波検査では最大腫瘍径2cm単発の肝細胞がんの検出を目指していたが、なかには超音波検査では検出しにくい肝細胞がんがあり、超音波検査により腫瘍陽性となるよりもAFP-L3の上昇が早期におこる症例があると報告されている13-17。AFP濃度は肝臓の炎症などにより上下することが知られているが、AFP-L3はAFP濃度よりも癌に対する特異性が高いと言われている。2000年代になるとCT/MRIの進歩により、肝細胞がんの確定診断が従来のバイオプシー組織による病理診断から腫瘍の栄養血管の動態に変わっていった。新しいCT/MRIと血管造影剤の組み合わせにより、最大腫瘍径1cm以下でも腫瘍濃染が確認できるようになった。当時、肝細胞がんの腫瘍マーカーとして、AFP(濃度)、AFP-L3%とPIVKAII(欧米ではDCP)が臨床応用されていたが、当時のAFP-L3のAFPが低値での検出感度では最大腫瘍径1cm腫瘍での陽性率は低く限界があった。2010年にマイクロチップキャピラリー電気泳動法によりAFP-L3とDCPの検出感度と精度とが改善され、新たな臨床的有用性が報告されている18-21。
また、AFP-L3は癌の悪性度判定、治療効果判定に有用であるという報告もある。癌の悪性度としては、画像診断と比較した腫瘍の栄養血管の状態、および腫瘍倍加時間との関係が報告されている22。病理診断における悪性度の指標との比較も報告されている23。治療効果判定としては、TACE(Trans Arterial Chemo Embolization)治療24,25、切除26,27、小肝がん28,29、肝移植30でAFP-L3が治療前後で高値を示した場合に生命予後が悪いことが示された。
現在、肝細胞がんの腫瘍マーカーとしてAFP、AFP-L3、およびDCPが各国で使用されている。この3種のマーカーには陽性となる癌が特に早期がんで異なる、いわゆる相補性が認められている31。この相補性を統計的に解析し、肝細胞がんの検出のためのスコアとして新たにGALADスコアが国際共同研究により提唱されている32。GALADスコアは、G: gender、A: age,、L: AFP-L3、 A: AFP、 D: DCPの5つのパラメーターで構成され、GALAD = -10.08 + 1.67 x Gender + 0.09 x Age + 2.34 x log10(AFP) + 0.04 x AFP-L3 + 1.33 x log10(DCP)の式で計算される。GALADスコアのAUROC(Area under the receiver operating characteristic curve)は0.97と、単独の腫瘍マーカー、およびそのカットオフ値の上下によるコンビネーションのAUROC値と比較して有意に高い33。GALADは客観性が高く、測定精度も高いパラメーターのみで構成されているため、主観性がある画像診断と比較して各国での成績でもほぼ同等の有用性をしめしている33-35。また、高価な設備や測定技師を必要とする画像診断と比較して、医療経済上の有用性も高い。
肝細胞癌の予後予測としてBALADスコアも提唱されている。肝細胞がんの予後因子としては肝機能と腫瘍因子の二つがあるため、肝機能としてBilirubinとAlbumin、および腫瘍因子であるAFP-L3、AFP、DCPの5種類のパラメーターで構成される。2006年に発表されたBALADでは5種類のパラメーター各々にカットオフ値を設定し、そのプラスマイナスによりスコア値を計算していた36。従来の腫瘍因子だけで構成されているTNM分類等と比較して、背景肝因子を含むことと、5種類のパラメーターがすべて血清マーカーである客観性と普遍性を特徴とする。2014年に同じ5種類を用いて各数値の重みを考慮した計算式を用いるBALAD2が提唱された37。BALAD2スコアは、BALAD2 = 0.17 x ([BIL]1/2 - 4.50) - 0.09 x ([ALB] - 35.11)0.02 x ([AFP/1000] - 2.57) + 0.012 x ([AFP-L3] - 14.19) + 0.19 x (ln[DCP] - 1.93)の式で計算される。BALAD2はイギリス、ドイツ、日本、香港の国際研究33,37,38により評価されている。
肝細胞がんの診断は超音波、CT、MRI等画像診断技術の進歩により、この30年間で飛躍的に向上した。日本では肝細胞がんのハイリスク(肝硬変)としてB型、C型肝炎ウイルス陽性群を中心とした囲い込みと、超音波と腫瘍マーカーによる定期的なサーベイランスシステムが行われている。各国の肝細胞がんのハイリスク群へのサーベイランスガイドラインとして、主に定期的な超音波の使用が推奨されているが、超音波診断が難しい肥満や強度の肝硬変の症例、あるいは国によっては装置や超音波技術者の不足等の課題も指摘されている。GALADスコアにより単独の腫瘍マーカーでの偽陽性、偽陰性の課題が大きく解消された。超音波診断をさらに補完・強化する目的でサーベイランスガイドラインの見直しも各国で協議されている。