氏名:清水 康博
医師、横浜市立大学大学院医学研究科博士課程。
2017年4月より国立がん研究センター 先端医療開発センター 免疫療法開発分野に研究員として着任。資格:日本外科学会 専門医、日本消化器外科学会 専門医など

氏名:中面 哲也
国立がん研究センター 先端医療開発センター 免疫療法開発分野長。医学博士。
1992年熊本大学医学部卒業。専門は腫瘍免疫学。元外科医の研究者として、手術だけでは治らないがん患者の治療法、がんの予防法の開発を、免疫療法という手段で実現したいと考えている。
がん治療は、これまで手術・化学療法・放射線療法が主流であったが、第4の治療法としてがん免疫療法が注目されている。近年の免疫チェックポイント阻害抗体の飛躍により1, 2、その効果は疑いようのないものとなった。それらの功績を称えられ本庶佑・ジェームズPアリソン両氏が2018年にノーベル生理学賞を受賞したことは記憶に新しい。このようにさらなる注目を集めているがん免疫療法であるが、効果が高く副作用が少ない治療を実現するためには、優秀ながん特異的抗原の同定が必須である。1991年にBoonらが悪性黒色腫に特異的ながん抗原を同定3して以降、世界中の多くの研究者が新たながん抗原の検索を行ってきた。我々は、2001年に肝細胞がんの特異的抗原としてglypican-3(GPC3)を同定した。これほどがん特異的な発現パターンを有する分子はなく、免疫療法の標的として非常に優れている。今回、この肝細胞がん特異的抗原であるGPC3についての概論を述べる。
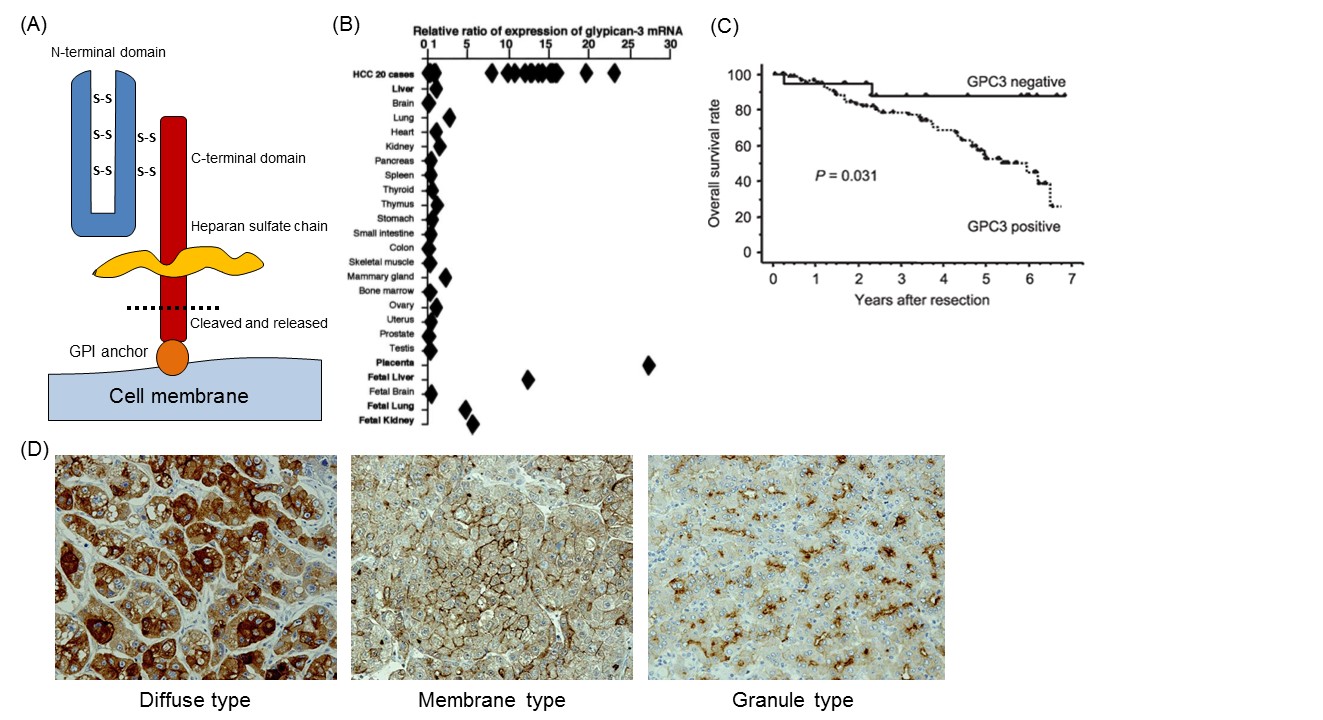
我々は、がん部・非がん部を含めた様々な正常臓器の数万遺伝子のcDNAマイクロアレイのデータの中から、がん特異的に発現しているがん抗原の候補を見出す作業を行い、その中でがん特異的抗原としてGPC3を見出した4。GPC3は全長580アミノ酸からなる65kDaの蛋白であり、GPIアンカーで細胞膜に結合しているヘパラン硫酸鎖プロテオグリカンであるGPCファミリーの1種である(図1A)5。GPC3はWnt、FGF、IGFなどの増殖因子を結合することにより細胞増殖シグナルを調節しており、胎生期の細胞の増殖と分化において重要な役割を担っている。また、その遺伝子は、X染色体(Xq26)に存在しており、ヒトとマウスでは相同性が高く、ノックアウトマウスが奇形を伴って巨大化するのと同様、ヒトでは、この遺伝子の変異や欠失により様々な奇形を伴う巨人症Simpson-Golabi-Behmel syndromeが知られている6。また、GPC3は発達中の多種多様な組織(胎児期の肝臓、肺、腎組織や胎盤)において発現されるが、プロモーター領域内のDNAメチル化による抑制のため出生後の正常組織では発現を認めない。しかし、肝細胞がん、悪性黒色腫、卵巣明細胞腺がん、肺扁平上皮がん、一部の小児がん(肝芽腫、腎芽腫、卵黄嚢腫)などにおいて特異的に高発現し、特に肝細胞癌は全体の約80%以上に発現を認める(図1B)4, 7, 8。これらのがんにおいて、細胞膜上のGPC3がどのような機能をしているのか不明瞭ではあるが、肝細胞がんにおいて悪性形質に関わっていることは間違いなさそうである(図1C)8。また、免疫染色でGPC3が瀰漫性に染色されるタイプ(Diffuse type)、細胞膜が中心に染色されるタイプ(Membrane type)、顆粒状に染色されるタイプ(Granule type)とGPC3に様々な局在がある可能性が示された (図1D)。
また、前述の通りGPC3はGPIアンカーで細胞膜に結合する膜タンパクであるが、同時に血中に分泌される分泌タンパクでもある(図1A)。ホ乳類のGPCファミリーは内因性のGPIホスホリパーゼDによりGPIアンカーレベルで切断される)9。また、これまでNotum(多くの生物種において保存されているWntシグナルの分泌型のフィードバック阻害タンパク質)はホスホリパーゼでありGPCのもつGPIアンカーを切断することによりGPCとWntとの複合体を細胞の表面からひき離すと考えられてきた10が、現在はGPIアンカーを切断せずにWntシグナルを制御すると言われている11。また、GPC3はArg358とSer359の間で切断されN末端領域が可溶性蛋白質としてがん組織から遊離し血中を循環すると考えられている12。それ故に様々なフォームのGPC3タンパクが血中循環していると考えられるが、血中に分泌されたそれらのGPC3タンパクがどのような機能を有するのかは明らかではない。
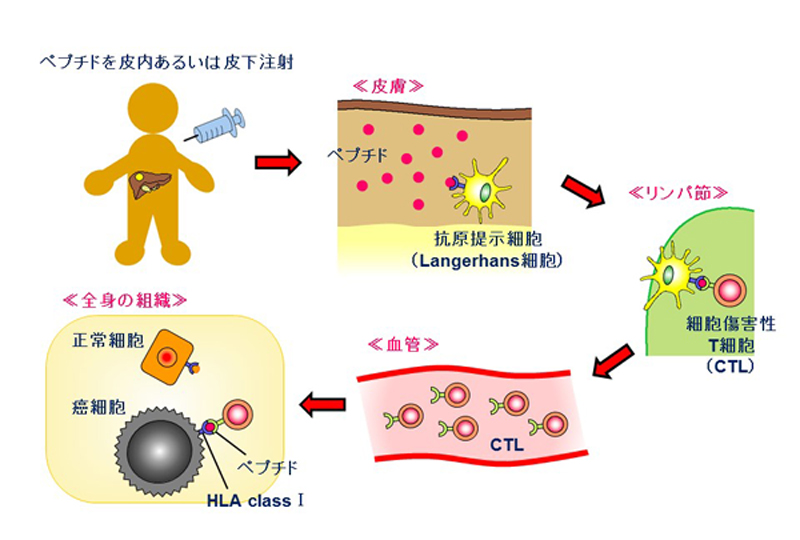
我々は、前述の通り非常にがん特異性の高いがん抗原であるGPC3を標的とした免疫療法の開発を行ってきた。その一つが、がんペプチドワクチン療法である(図2)。我々は、日本人の約60%が陽性であるHLA-A24と日本人の約40%が陽性で欧米人のメジャータイプであるHLA-A2に結合するGPC3由来ペプチドをそれぞれ同定し、ペプチドワクチンとして様々な臨床試験を行ってきた13。それらの臨床試験において、ワクチンの安全性はもちろんのこと、ワクチン投与患者においてペプチド特異的細胞傷害性T細胞(CTL)が血中およびがん組織中に誘導される事、即ち免疫学的有効性が確認された。進行した肝細胞がんや卵巣明細胞腺がん患者において頻度は少ないまでも奏効例も経験され、また肝細胞がんの術後再発予防効果および延命効果が得られる可能性が示唆された。さらには再発寛解を繰り返した難治性の小児の肝芽腫患者において5例全例で4年以上無再発生存が得られている。我々はこれらの臨床試験から得た知見を基に、さらなる効果をもたらし得る新たな免疫療法の開発を行っている13。
前述の通りGPC3は血中に分泌されており、血中GPC3の腫瘍マーカーとしての有用性が幾つかの論文で報告されてきた14, 15。我々は、新たなサンドイッチELISA systemを開発し肝細胞がんの術後再発予測マーカーとしての有用性を見出した16。術後血中GPC3高値の症例で有意に再発が多く、切除検体の免疫染色の結果、glypican-3陽性肝細胞がんの周囲に淡く限局的にglypican-3を発現する非がん細胞を認め、それらの細胞が術後のGPC3分泌および再発に関与している可能性が示唆された16。さらに我々は生理的に最も重要であると考えられる全長型GPC3を特異的に検出する測定系を企業との共同研究により開発した。そして、血中GPC3と既存の腫瘍マーカーであるAFP、PIVKA-IIを組み合わせる事により肝細胞がん術後の早期再発を高性能に予測することに成功した。また、それらを実証するべく前向き試験を行い検証している。さらに、慢性肝炎・肝硬変患者の肝細胞がん発症予測因子としての検討も行っている。今後、診断マーカーとしての有用性、ならびに上述したようなGPC3を標的としたがん免疫療法の治療効果を予測・判定するバイオマーカーとしての有用性も検討していく。
GPC3はがん特異性の非常に高いタンパクであり、世界中でがん免疫療法の標的として広く研究されている。しかしながら、その自然史や機能・動態について不明瞭な点も多いのも事実であり、より効果の高い治療の開発のためにもその解明が望まれる。
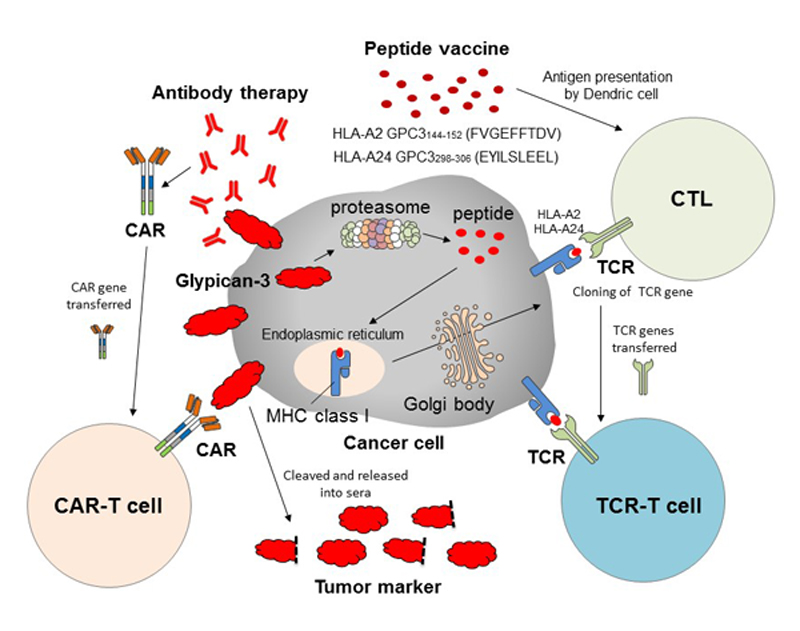
また、GPC3を標的とした免疫療法の開発は次の時代に突入している(図3)。我々の開発したペプチドワクチン療法の他にもGPC3を特異的に認識する抗体療法(GC33)の臨床試験が進行している。また、その抗体を応用したGPC3特異的キメラ抗原受容体遺伝子導入T細胞療法(CAR-T療法)の臨床試験がアメリカや中国で進行している。我々もペプチドワクチン療法の臨床試験から得られたGPC3ペプチド特異的CTLクローンを用いたTCR 遺伝子導入T 細胞療法の開発やCAR-T療法の開発を行っている。今後も悪性のポテンシャルが高いGPC3陽性がんに罹患した人々を救うべく研究を重ねたい。