
氏名:中川 誠人
京都大学iPS細胞研究所講師
高校時代(神奈川県立多摩高等学校)に受けた生物の授業でサイエンスの面白さを知り、上智大学卒業後、1997年に奈良先端科学技術大学院大学(NAIST)へ入学し研究者への道を歩き出す。名古屋大学でのポスドク(2002〜2004)を経て、2004年にNAISTの山中研究室に移り、2005年に京都大学再生医科学研究所に異動後、2006年に世界初のiPS細胞の樹立成功に立ち会う。その後、京都大学iPS細胞研究センターを経て、現在はiPS細胞研究所の一員として日々研究を続けている。メインテーマは「体細胞初期化メカニズムの解明」および「効率的なiPS細胞樹立・培養方法の開発」。

氏名:山中 伸弥
京都大学iPS細胞研究所所長・教授。米国グラッドストーン研究所上席研究員、公益財団法人京都大学iPS細胞研究財団理事長兼務。
1987年神戸大学医学部卒業。1993年大阪市立大学大学院博士課程修了。医学博士。1993年米国グラッドストーン研究所留学。1996年大阪市立大学医学部薬理学教室助手。1999年奈良先端科学技術大学院大学遺伝子教育研究センター助教授、2003年同教授。2004年京都大学再生医科学研究所教授、2010年4月より現職。2012年ジョン・ガードン博士とノーベル生理学・医学賞を共同受賞。iPS細胞研究所所長として、iPS細胞技術の医療応用を実現するために、iPS細胞を用いた病態解明や創薬、再生医療などの革新的研究を推進している。
iPS細胞が誕生してから約15年が経過した。驚くべきことに、この間にiPS細胞の医療応用がいくつも進んでいる。本稿では、iPS細胞が作られてから現在に至るまでの経過と今後について説明したい。
1981年にマウスES細胞(胚性幹細胞、Embryonic Stem cell)の樹立に成功したと欧米の研究グループから発表があった1,2。ES細胞は体のほぼすべての細胞に分化する能力があると考えられており、実際にマウスES細胞からマウス個体を作り出すことが可能である。つまり、ヒトでもES細胞が作り出せれば、さまざまな細胞に分化させて移植等により組織や臓器の失われた機能を再生させる、再生医療に活用することが可能であると考えられた。そして、1998年にヒトES細胞の樹立が報告されたことから、ヒトES細胞の再生医療への応用研究が始まることになる3。マウスES細胞を用いた研究で培った技術・知見をヒトES細胞へ応用することで、さまざまな細胞を作り出すことが可能となった。
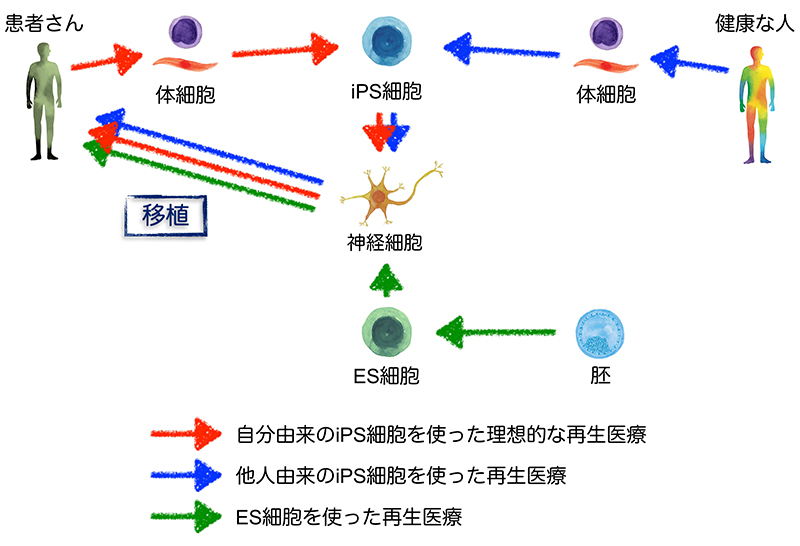
幹細胞を使った再生医療を考えた場合、自分由来の幹細胞を作り出し、その幹細胞を元に移植治療に必要な細胞を準備することが理想的である(図 1)。この理想的な再生医療にES細胞の活用をあてはめた場合、いくつかの課題が考えられた。まず一つは、ソースとなる細胞による課題である。日本では、体外受精による不妊治療において母体に戻されなかった凍結保存されている胚(受精卵から少し発生が進んだもの)のうち、破棄されることが決定した余剰胚の利用に限ってヒトES細胞の作製が認められている。つまり、自分自身のES細胞を容易に作り出すことはできない。他には、免疫拒絶の課題がある。他人(非自己)のES細胞から作った細胞を体に入れると、ほとんどの場合拒絶反応が起こり、移植が成立しないと考えられる(図 1)。実際の医療の現場では、臓器移植の際、拒絶反応を抑えるために免疫抑制剤が使われているが、副作用が強く出る場合が多々ある。また、免疫抑制剤を生涯服用しないとならないことも負担となる。このような課題を解決するためにも、自分由来の幹細胞を持つことが、理想的な再生医療を達成させるのに必要なことと考えられた。
それまでの研究成果から、体の細胞から幹細胞を作り出すことは可能なのではないか?と考えられていた。一つは、ジョン・ガードン博士によるアフリカツメガエルを使った核移植による細胞の初期化研究である4。当時、受精卵だけが生体を作り出すために必要な遺伝情報のすべてを持っていると考えられていたが、ガードン博士の研究により、体細胞も同様にすべての遺伝情報を持っていることが示された。さらに、分化した状態の核は初期化され、成体のカエルにまで発生した。つまり、分化した細胞が初期化されて幹細胞のような性質を持つことができる可能性が示されたことになる。また、別の研究グループより、転写因子と呼ばれる遺伝子の発現制御を行う因子を細胞に導入することで、その細胞の性質が変化することが示された。MyoDという筋分化制御因子を筋肉細胞ではない線維芽細胞に導入すると、線維芽細胞が筋芽細胞に変化するという報告であった5。この研究から、体細胞に目的の細胞に関わる因子(遺伝子)を導入することで目的の細胞に変化させられることが分かった。これら二つの研究成果から、体から採取した何らかの細胞に幹細胞で働く遺伝子を導入することで幹細胞に変化させることができるのではないか?という可能性が湧き上がってきた。
一番の問題は、何の因子を体の細胞に導入するかであった。無作為に遺伝子を導入するにしても数万個ある遺伝子のすべてを検討することは難しい。ちょうどその頃、理化学研究所の林崎良英先生のグループによりES細胞で高発現する遺伝子のデータベースが公開され(http://fantom.gsc.riken.go.jp/)、我々はそのデータベースを活用し導入遺伝子の選定を進めた。そして我々の研究で同定していた、ES細胞の未分化維持に働く遺伝子も含め、24個の遺伝子を初期化候補遺伝子として選定した。
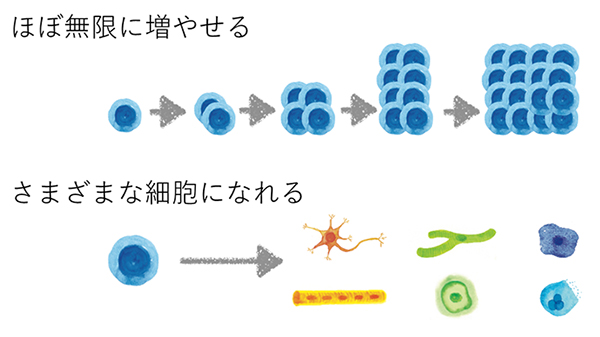
まず、24個の初期化候補遺伝子をマウス胎児由来線維芽細胞に一つずつ導入した。しかし、ES細胞の様な細胞を得ることはできなかった。次に、24個の遺伝子を同時に細胞に導入するとES細胞の様な細胞を得ることに成功し、この中に初期化遺伝子が存在することを確認した。さらに、24個の遺伝子の中のどれが重要なのかを確かめるために24個の中から一つずつ除いた23個の遺伝子を導入し、ES細胞様の細胞が得られるかどうか検討した。その結果、4つの遺伝子(Oct3/4, Sox2, c-Myc, Klf4)だけで初期化を起こすことが可能であることを突き止めた。2006年に世界で初めて、マウスの体細胞に上記4つの遺伝子を導入することで幹細胞を作り出せることを報告し、この幹細胞をiPS細胞(人工多能性幹細胞、induced Pluripotent Stem cell)と名付けた6。いろいろな解析からiPS細胞はES細胞とほぼ同じく、ほぼ無限に増殖でき、さまざまな体の細胞に変化する能力を持つことが確認された(図 2)。
iPS細胞を再生医療に応用するためには、ヒトのiPS細胞を作ることが必須であった。最近ではある程度認知されているが、ヒトとマウスのES細胞の性質は少し違っており、マウスES細胞の方がより未分化性が高い状態にある。細胞の性質が違うということは、細胞を培養する条件も異なってくる。2005年から我々は京都大学再生医科学研究所(現 ウイルス・再生医科学研究所)に研究室を移して研究を進めた。京都大学では中辻憲夫先生のグループによりヒトES細胞の樹立・維持培養がすでに行われており7、我々はその技術をヒトiPS細胞の作製に活用することで、2007年に世界で初めてヒトiPS細胞の作製を報告した8。
iPS細胞と糖鎖は切っても切れない関係にある。これは、iPS細胞に限らずES細胞にもあてはまる。 実際、研究対象の細胞がヒト多能性幹細胞(ES/iPS細胞)であることを確認するために、細胞表面マーカーとして糖鎖を認識する抗体を使用し、中でもTRA-1-60抗体がよく用いられる9,10。
TRA-1-60抗体は細胞表面タンパク質であるポドカリキシン上の糖鎖修飾(ケラタン硫酸)を認識する。もともとはEC細胞(胚性がん腫細胞、Embryonic Carcinoma cell)の表面抗原を認識する抗体として報告され、その後ヒト多能性幹細胞のマーカーとしても使われるようになった。ヒト多能性幹細胞が未分化性を失い分化すると、その細胞はTRA-1-60抗体では認識されなくなる。
前述の通りTRA-1-60抗体はがん細胞を認識する抗体である。ヒト多能性幹細胞は自己複製能力を持つ正常な細胞である(遺伝子異常による不死化ではない)が、がん細胞と同じような増殖能力を有している。そのため、TRA-1-60抗体ではヒト多能性幹細胞とがん細胞を識別することはできない。近年、この問題を解決できるR-10G抗体が、立命館大学の川嵜敏祐先生のグループによって報告された11。R-10G抗体はTRA-1-60抗体と同様にポドカリキシン上の糖鎖修飾(ケラタン硫酸)を認識するが、より硫酸化度の低いケラタン硫酸を認識することが分かっている。R-10G抗体はヒト多能性幹細胞を認識するが、ヒトEC細胞をほとんど認識しないことから、ヒト多能性幹細胞の表面マーカーとして、より有用であると考えられる。しかしながら、ポドカリキシンの糖鎖修飾がヒト多能性幹細胞の性質にどのような影響があるかは未だに分からないことが多く、今後の研究の発展が期待される。
世界で初めてiPS細胞を利用した臨床研究(細胞移植)が行われたのは、神戸市である。理化学研究所の髙橋政代先生のグループは、加齢黄斑変性という目の病気をもつ患者さん自身の体細胞からiPS細胞を作り出し、そのiPS細胞から網膜色素上皮細胞を作製した。そしてそのiPS細胞由来網膜色素上皮細胞は、2014年に患者さんの目に移植された。これは、冒頭で説明した自分由来の幹細胞を使った理想的な再生医療の例である(図 1)。なお現在のところ、この臨床研究において有害事象は報告されていない12。
ヒトiPS細胞の培養法はヒトES細胞のものと同じで、ヒトiPS/ES細胞の他にフィーダー細胞(支持細胞)を使う必要があった。詳細なメカニズムは未だ不明な点が多いが、フィーダー細胞とヒト多能性幹細胞を共培養することでヒト多能性幹細胞の成育が安定し、正常な細胞のまま培養を続けることが可能である。
しかし、この方法で培養したiPS細胞を臨床応用するには、いくつかの課題があった。細胞を臨床応用する場合には、培養に関係する培地や試薬の安全性を担保することが必要不可欠であり、それはその細胞が安全であることを証明することに繋がる。この時に適用されるガイドラインが厚生労働省管轄の「生物由来原料基準」である。フィーダー細胞を使った培養法(フィーダー法)では、生物由来原料基準を満たすために多くの課題を克服する必要があることが分かった。その中でも大きな課題として、培地(培養液)とフィーダー細胞の二つが挙げられる。培地中には動物由来の血清成分(ウシ)や酵素(ブタ)が含まれており、これらの安全性を担保するには、動物が飼育されている施設の確認や血清などの安全性の確認(ウイルス試験など)を行わなければならなかった。また、我々が使っていたフィーダー細胞はマウス胎児由来線維芽細胞の株化細胞であることから、血清などと同様に生物由来原料基準に適合させる必要があり、多大な労力とコストが必要であると考えられた。また、フィーダー細胞そのものの品質を管理する必要もあった。これらの課題を克服することは不可能ではなかったが、将来の医療応用を見据え、より安全で簡単な培養法が必要になると判断し、我々はフィーダー細胞を用いずにヒトiPS細胞を培養するという、臨床応用可能な新たな培養法の開発を2010年頃に開始した。
その頃海外のグループによって、培養皿に組換えタンパク質であるlaminin-511をコーティングすることでヒト多能性幹細胞の長期安定培養が可能であることが報告された13。我々もlaminin-511を利用することを考えたが、海外からの輸入製品であること、コストが高いことなどの理由から、使うことを断念した。他の良いコーティング剤を探していたところ、大阪大学蛋白質研究所の関口清俊先生のグループがlaminin-511の活性化断片(結合に必要な部分のみ、laminin-511E8)を組換えタンパク質として生産する方法を開発している14ことを知り、すぐに連絡を取り共同研究を始めた。そして、laminin-511E8を用いることでフィーダー細胞を使わずともiPS細胞の樹立・維持培養が可能であることが確認できた。また、京都大学再生医科学研究所(現 ウイルス・再生医科学研究所)の川瀬栄八郎先生のグループも同様の知見を得て論文を発表15していたことからも、laminin-511E8がヒト多能性幹細胞を培養する際のコーティング剤として有用であることが分かった。なお、laminin-511E8は大阪大学、株式会社ニッピとの共同開発によりiMatrix-511として製品化され、現在は株式会社マトリクソームより販売されている。
もう一つの大きな課題は培地である。培地には多くの成分が含まれており、それらが協調して細胞の成育に重要な働きをすると考えられている。一般的に良く使われる培地には、栄養が豊富なウシ血清(FBS)が含まれている。FBS中の成分の詳細は不明であるが、細胞培養においては古くから使われている。しかし、動物由来成分は未知のリスク(感染症など)を含むことから、臨床応用する際にはできるだけ使わないことが理想的である。我々は培地の製造ノウハウを持っていた味の素株式会社と共同研究を開始し、ヒト多能性幹細胞に最適な培地の検討を進めた。その結果、動物由来成分を含まない(生物由来原料基準を適用する原料を含まない)培地としてStemFit®の開発に成功した。StemFit®培地と前述のiMatrix-511を組み合わせることで、非常に効率良く、かつ簡単にヒト多能性幹細胞を培養できる、フィーダーフリー培養法の開発に成功した16。この培養法は京都大学iPS細胞研究財団(2020年に京都大学iPS細胞研究所から移管)が進めている再生医療用iPS細胞ストックプロジェクトで採用されており、さらに、国内でiPS細胞を活用した臨床応用を進めている多くの施設でも使われている。
国内でのiPS細胞を活用した臨床応用(臨床研究および治験)は着実に進んでいる。神戸市でのiPS細胞由来網膜色素上皮細胞を用いた加齢黄斑変性に対する臨床研究を皮切りに、iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病に対する治験(京都大学、実施中)17、iPS細胞由来心筋細胞を用いた重症心不全に対する治験(大阪大学、実施中)18、iPS細胞由来血小板を用いた血小板減少症に対する自己輸血に関する臨床研究(京都大学、実施中)19など、他にもiPS細胞由来体細胞を用いた臨床研究や治験の準備が進められている。
国内ではヒトES細胞を用いた臨床応用も始まっており、今後のさらなる再生医療の発展が期待される。
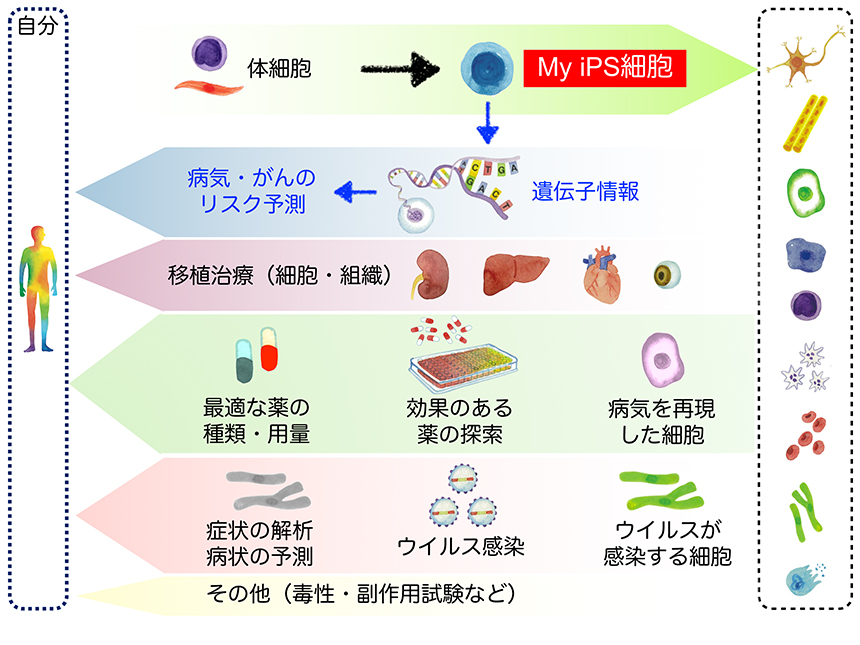
前項の細胞移植の多くは、他人由来のiPS細胞を用いて行われている(図 1)。その理由はiPS細胞の作製や品質評価に多くの時間と費用がかかるからである。しかし、iPS細胞の最大の特徴は自分由来の幹細胞により治療などを行えるようになるという点にある。自分由来のiPS細胞のことをMy iPS細胞(マイ アイピーエス細胞)と呼ぶことにする(図 3)。国内では京都大学iPS細胞研究財団を含めて数社がMy iPS細胞を受注製造するサービスの開発を推進しており、中にはすでに受注を開始している会社もある。最も進んでいるのはアイ・ピース株式会社で、個人向けに医療用iPS細胞作製・バンキングサービスを始めている。価格は200万円程度と報道されており20、決して個人で依頼できない金額ではない。今後は同様のサービスが充実してくると考えられる。
My iPS細胞のメリットは、病気やけがで失われた細胞を自身の細胞により補えることである(図 3)。自分自身の細胞を使うことで拒絶反応を回避し、効率的に移植治療を行えると考えられる。ただし、iPS細胞から移植に必要な細胞を作るにはある程度の期間を要するため、急な病気やけがには対応できない。また、個人用の移植細胞を準備するには、かなりのコストが必要になる。しかしながら、将来的にはさまざまな細胞から心臓のような臓器を作り出せる可能性もあり、My iPS細胞が移植治療に広く使われるようになることも想像される。
My iPS細胞の他の使い道は、個別化医療である。先述の移植もその中に入るが、ここで言う個別化医療は創薬への応用を意味する。例えば、肝臓の病気になった場合に、My iPS細胞から肝臓の細胞を作り出し、培養皿の上で病態を再現できたとする。その細胞を使って薬のスクリーニングをすれば、その患者さんにとって一番良い薬、さらには処方量なども検討することが可能になるかもしれない(図 3)。人の体は千差万別で、同じ薬を同じ量だけ飲んでも効果には個人差があり、My iPS細胞を使うことで治療の最適化が行えるのではないかと考える。同様に薬の毒性や副作用などを検討できることもメリットだろう。
また、がんの多くは遺伝子異常に起因することが分かっており、個人の遺伝子をもつMy iPS細胞を利用することでがん化予測ができるのではないかと考える。昨今のゲノム情報処理技術の発展に伴い、簡単に全ゲノム配列を調べることができ、がんに関係する遺伝子異常のデータベースも日々更新されている。それらの情報とあわせ、My iPS細胞から作製した体細胞ががん化するかどうかを培養皿の上で実際に検討することで、がん化をある程度予測できると考えられる。また、実際にがんになった人とならなかった人のMy iPS細胞のデータを比較することで、既知の遺伝子異常以外のSNP(一塩基多型、Single Nucleotide Polymorphism)を要因とするがん化の予測が可能になるかもしれない(図 3)。さらに、My iPS細胞は、予測に基づいたがん治療にも貢献できる可能性がある。
現在、当研究所では新型コロナウイルスに感染・発症し、回復した患者さんの細胞(回復後にPCRで陰性を確認してからサンプルを採取)からiPS細胞(CoV2-iPS細胞)を作製している。具体的には重症・中等症・軽症の患者さんから各々のiPS細胞を作り出し、研究材料として配布する準備を進めている。これにより、CoV2-iPS細胞から感染に関わる細胞を作製し、発症のメカニズムを解析することが可能となり、これまで分からなかった重症化のメカニズムの一端を明らかにできると期待される(図 3)。
また、新型コロナウイルス感染症に関する知見が蓄積されることで、My iPS細胞の利用の可能性も広がると考えられる。My iPS細胞から感染に関わる細胞を作り出し、新型コロナウイルスあるいはそれと同様の作用を持つものを感染させて重症化のリスク判定を行えるかもしれない。さらに効果のある薬を予め知ることができれば、重症化する前に治療を行うことが可能となるだろう。
このようなMy iPS細胞を用いた病態予測や薬効判定など、いわゆる先制医療の実現にはビックデータの活用が必要である。My iPS細胞サービスにさまざまな情報を紐付けすることができ、さらにそれを共有できるようなシステムが構築できれば、今では考えられないような医療システムを確立できるのではないだろうか。例えば、ビッグデータの情報処理には現在世界1位の性能を誇る富岳のようなスーパーコンピューターを活用し、それらのデータ解析には人工知能(AI)を用いることで、我々が簡単に認識できないような病気の原因などを発見できる可能性がある。My iPS細胞が普及すればするほどこの解析システムの精度が上がり、よりよい先制医療が実現できると期待する。
iPS細胞は理想的な再生医療を実現させるために生み出され、実際に医療の現場で治療法確立に向けて着実に使われ始めている。今後はMy iPS細胞という新しい材料と情報、そしてAIを組み合わせた次世代医療へと発展することを期待したい。