
氏名:笠井 献一
東京⼤学理学部⽣物化学科卒業。⽣物物理化学研究所(パリ、フランス)研究員、北海道⼤学薬学部助⼿・助教授、帝京⼤学薬学部教授を経て、現在は帝京⼤学名誉教授。
ヌクレアーゼ、プロテアーゼの研究から脱線して、レクチンに⼿を出したら、糖鎖⽣物学にトラップされてしまいました。そのおかげで⽬からうろこが落ちる経験をたくさんさせてもらいました。
さまざまな⽣命のプロセスが、レクチンによる糖コードの認識により取り仕切られていますが、そのメカニズムの解明は容易ではありません。なぜならあいまいな特異性と、弱い結合が基盤になっているからです。このような相互作⽤系を解析できる⼿段はきわめて乏しいが現状です。フロンタルアフィニティクロマトグラフィー(FAC)は、このような系をもっとも得意とする稀有な研究⼿段です。どんどん使ってもらいたいものです。
糖鎖は第三の生命情報分子ですが、核酸やたんぱく質とはあまりにも異質なところが多く、「なぜ?どうして?」が満載です1。それらをすべて納得できる日が到来して、はじめて生命が本当にわかったといえるでしょう。ところがこれがとんでもない難題です。糖鎖の構造に織り込まれた情報(糖コード)の解読は、レクチンなどが担当しますが、この情報処理のメカニズムを正確に把握するのは至難の業です。結合力が弱いこと、多様な糖鎖を相手にすることなど、つかみどころに欠けているうえに、精密に解析できる手段がごく少ないからです。
でもこの壁を克服できるユニークな研究法が存在し、それがフロンタルアフィニティクロマトグラフィー(FAC)です2-4。弱い相互作用解析のスペシャリストで、情報糖鎖関係に限らず、生命科学においてまだ手がけられていない諸課題の解明に広く役立つ可能性を秘めています。でもその実力はまだあまり知られていません。大いに利用してもらいたいので、この場を借りて紹介します。
生体分子間相互作用の特徴といえば、まず頭に浮かぶのが、厳格な特異性と、強い結合性でしょう。たとえば酵素、抗体、受容体などは、ただ一つのパートナーを認識するのが普通です。そして生成した複合体は簡単には解離しません。この特質が生体反応の確実性や再現性を保証しています。
しかし情報糖鎖を研究していると、こうした常識にとらわれてはいけないと悟らされます。厳しくて強い相互作用だけでは生命は立ちゆかない。あいまいで弱い相互作用も必要不可欠なのです。
糖鎖を結合するたんぱく質は、全般的に特異性が甘く、結合力もあまり強くありません。たとえばレクチンのほとんどは、何十種類もの糖鎖と付き合う浮気者です。そのうえ結合力は弱めで(解離定数が10-4M~10-6M程度)、飽きっぽくてすぐに離れます。でもこれをもってレクチンを下劣なたんぱく質とみなすのは浅薄でしょう。レクチンのそのようなふるまいには、深遠な意味(たとえば、生命の柔軟性・多様性・持続性に寄与するなど)があるに違いありません。深く詳しく追求するべきです。
またレクチン以外にも、多岐にわたるたんぱく質(酵素阻害たんぱく質、成長因子、接着たんぱく質、消化酵素、アネキシン、シャペロンなど)が、本来の機能に加えて、糖鎖結合能も持っています。これも単なる余技を越えた大事な役割を秘めているはずです。ここでも弱くて甘い相互作用が多用されているでしょう。さらに糖鎖認識以外にも、弱い相互作用系は広く利用されていると思われます。
弱い相互作用は、地味で注目されにくいうえ、適切な研究手段が乏しいこともあり、研究は遅れっぱなしです。強い相互作用なら、いろいろな優れた手段が開発されていますが(分光学的方法、エバネッセント光技術, カロリメトリーなど)、残念ながらどれも弱い相互作用は不得手です。特に糖鎖関係では、利用できる場面がひじょうに限られます。その理由は測定原理にあります。
どの方法も、結合力を正確に知るための基礎データとして、複合体形成の割合を知る必要があります。強い相互作用なら、反応分子が低濃度でも複合体が高い割合で生成するので問題ないのですが、弱い相互作用ではその割合がごく低いので、正確な測定が難しくなるのです。
複合体の生成率は、解離定数(Kd)と反応分子の濃度とで決まります。たとえばレクチンと糖鎖の系の場合を考えてみましょう。もしも糖鎖の濃度がKdに等しければ、レクチンの50%に糖鎖が結合します(半飽和)。Kdの正確な測定には、この付近の糖鎖濃度で実験する必要がありますが、生体由来の糖鎖のほとんどは超がつく貴重品なので、10-4M~10-6Mの溶液を使う実験など、あまりにも現実離れしています。しかも一つのレクチンに対して何十種類もの糖鎖を用意しなければなりません。この二重苦は現時点では解消不能で、挑戦はあきらめろと言われるのに等しいです。
ところがFAC(溶出前端測定アフィニティクロマトグラフィー)は、この難題を克服でき、極微量の糖鎖で弱い相互作用を精密に解析できます。なぜなら測定原理がユニークで、生成する複合体の量に頼らないからです。だから弱い相互作用であっても、糖鎖の濃度を高める必要がありません。適切なテクノロジーを開発できれば、原理的には糖鎖1分子でも結合力を測定できるでしょう。こんなことを可能にしたのは逆転の発想です2。
アフィニティクロマトグラフィーは、生命科学における最強の分離精製手段です。でもその特技を生かすことを放棄して、わざと使いものにならないような弱い親和性吸着体を作りました。すると素晴らしい分析手段が生まれました。
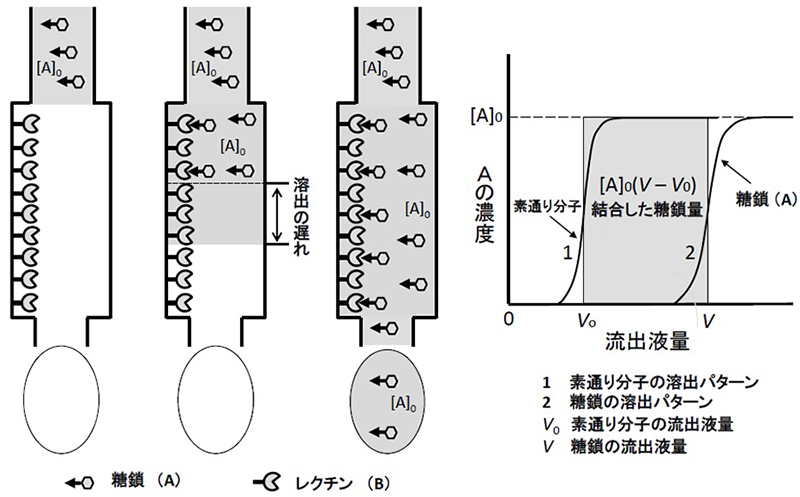
レクチンと糖鎖の相互作用を調べる場合ならば、わざとレクチンを少なめに固定化します。そのカラムに低濃度の糖鎖(アナライト)溶液を連続的に注いでゆくと、やがて糖鎖が漏れて出てきます(図 1)。先頭部分は額形(フロント)で出現し、最高値に達した後はプラトーが続きます(図 1の曲線2)。溶出前端の液量(V)は、簡単な計算で精密に決定できます5。対照としてレクチンとまったく相互作用せずにカラムを素通りする物質の溶出曲線も測定します(図 1の曲線1。溶出前端液量V0)。
カラム内を糖鎖溶液が移動するとき、糖鎖分子は固定化レクチンと相互作用するたびに立ち止まりますが、結合力が弱ければまた離れて移動を再開します。こうした道草の頻度は2つの要素、つまりKdと、カラム内の固定化レクチンの密度(濃度:[B]0)で決まります。そこで[B]0をあらかじめ測定しておいた固定化レクチンカラムを用意して、糖鎖の溶出の遅れ(V – V0)を測定すればKdを求められます。複合体量を調べる必要がないし、弱い糖鎖だからといって濃度を高くしなくてもよいのです(むしろ糖鎖濃度は低い方がよい)。
理論的根拠は5項で説明しますが、あっけないほど簡単です。こうして弱い相互作用を最も得意とする解析法が生まれました(ちなみにこの方法は強い相互作用の解析には向いていません。アナライトがしっかり吸着されてしまい移動できないからです)。
FACではアナライト溶液の溶出前端を測定します。分析手段という観点から、このやり方にはひじょうに多くのメリットがあり、現存で最強の手段を誕生させました。たとえば①理論が簡単、②実験系が簡単、③操作が簡単、④連続測定が可能で、効率的に多種類のアナライトに対するKdを決定できる、など。その他まだいくつもあります。
これらのメリットのおかげで、レクチンを固定化したカラムを1本作れば、多種類の糖鎖に対するKdのリストを効率よく作れます。こうしてレクチンの糖コード認識能プロファイルが得られ、レクチンの選り好みの癖がさらけ出されます。それも「好きか、嫌いか」といった定性的情報に止まるのではなく、「何倍の強さ、何分の一の弱さ」という定量的で高品質なデータとしてです。
揺籃期のFACは、手間暇も試料量もかなり必要な方法でした。しかしさまざまな技術革新(HPLCの機材の進歩、パソコンによるデータ解析の高速化など)、および蛍光ラベルした多種類の生体由来のオリゴ糖(PA-オリゴ糖)の供給のおかげで、飛躍的に高性能化できました5。
この結果、極小容積の固定化レクチンカラム(100 µlオーダー)に、10 nM程度のPAオリゴ糖溶液を1ml前後添加し、蛍光モニターで溶出曲線を測定すればすむほどに微量化できました。試料溶液と洗浄溶液を流路切り替えで交互にカラムに導入すれば、1試料10分程度のスピードで連続分析ができます。手動でも操作は簡単ですが、自動装置も作られており、1日で数10種類の糖鎖を処理できるまでになっています6。
すでに100種類以上のレクチンについて、約100種類のPAオリゴ糖鎖に対する親和性プロファイルが得られています。それぞれのレクチンがどんな糖コードを、どれだけの結合力で見分けているのかが詳しくわかってきました。かなりのものについてすでにデータベースで(Lectin Frontier Database: LfDB)公開されています7。レクチンが関係する現象や実験を解釈・評価する際に、かけがえのない拠り所になります。
どんな役に立っているのか例を少し挙げましょう。
ガレクチンの多様性
ガレクチンは代表的な動物レクチングループで、人体では10種類以上が働いています。しかし構造や糖結合特性(定性的レベルでの)が似かよっており、どのように使い分けされているのかよくわかりません。FACによって各ガレクチンの糖コード認識のくせが細かくわかってきました8。それらが働く現場の糖鎖の特徴と照合することで、謎の解明が進むでしょう。
たんぱく質の品質管理にかかわるレクチン
N結合型糖鎖上に提示される糖コードは、たんぱく質の品質管理に深く関わっており、小胞体内でいくつものレクチンに認識されます。これらのレクチンの親和性プロファイルは、各レクチンの機能の理解を深めるのに役立っています9。
研究ツールとしてのレクチンの性能判定
レクチンは糖鎖研究のツールとして重用されています。親和性プロファイルが得られているレクチンを利用すれば、実験結果をより深く解釈できます。たとえば組織化学への利用では、糖構造について一段高い情報が得られるでしょう。またレクチンの意外な結合特性もいろいろ見つかります。
さてFACの理論を解説しましょう。前端分析モードのおかげで、ひじょうに簡単です。
図 1に示すように、素通り分子の溶出液量はV0です。これからカラム内の空隙の容積がわかります(アガロースゲルを基材とする親和性吸着体では、カラムの容積とほぼ等しいとみなせます)。アナライト(A)の溶出液量はVです。A溶液の初濃度を[A]0、固定化リガンド(B)の濃度を[B]0とします。灰色の四角形は、カラム内に足止めされたAの量に相当します。その面積 [A]0(V – V0)がBに結合しているAの量です。カラムにはAが常に補給されているので、遊離Aの濃度[A]は[A]0に等しくなります。Aを結合していないBの濃度を[B]、AB結合物の濃度を[AB]とすれば、解離定数KdとAの溶出状況を式1の形で結びつけられます。
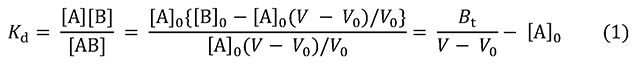
Btはカラム内に存在するBの総量、つまりV0[B]0です。この式から2式を誘導できます。
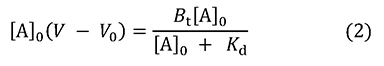
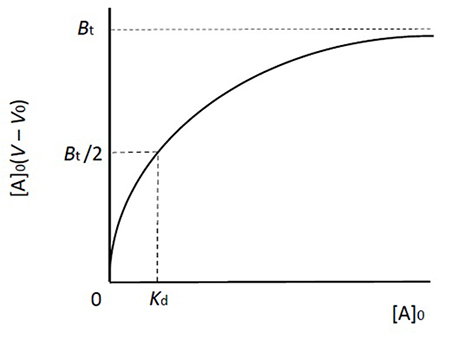
この式は吸着平衡現象における飽和曲線を示しており、酵素反応のミカエリスーメンテン式と同じ形をしています(図 2)。Aを結合しているBの量(左辺)と、[A]0との関係は直角双曲線となり、2つの定数KdとBt(酵素反応におけるKmとVmaxに相当)で形が決まります。これらの定数は酵素反応速度論の場合と同じやり方(Lineweaver-Burk plotやWoolf-Hofstee plotなど)で求められます。それはさておき、1式からは3式も誘導できます。
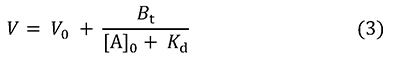
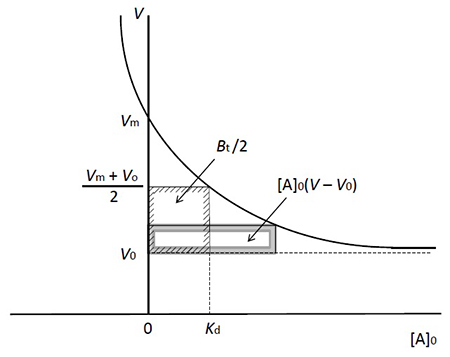
この式は、[A]0を変えた場合、Vがどう変るかを教えてくれます(図 3)。[A]0上昇にともないAの溶出が早まり、最終的にV0に達します(固定化リガンドが完全に飽和された状態)。一方、[A]0が低下するにつれてVは大きくなり、[A]0が0に近づくと最大値Vmに近づきます。そこで4式が得られます。

これを変形すればKdを求める式5が得られます。
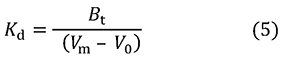
この式には[A]0が含まれていません。[A]0が十分に小さければ(実験する際の目安としてはKdの1%以下)、結合力の測定に際して、アナライト濃度を考慮する必要がないことを示しています。なぜそうなるのでしょうか。それを理解するために式4から式6を誘導します。
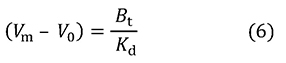
この式から、溶出の遅れがKdに反比例し(結合定数Kaに比例し)、比例定数がBtだとわかります。さらにBtに [B]0V0を代入し、両辺をV0で割ります。アナライトがごく低濃度のときは、カラム内の固定化リガンドのほとんどはアナライトを結合していないので、 [B]0を[B]とみなすことができ、式7が導かれます。
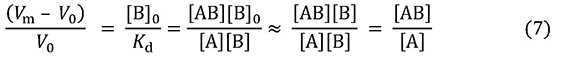
左辺はAがカラム容積の何倍遅れるかを表しています。これは[B]0と Kdの比で決まります。さらに最右辺を見ると、それは固定化リガンドに捕われているAの濃度と、遊離状態のAの濃度の比に等しいことがわかります。この項はアナライト1分子に着目すれば、固定化リガンドに捕えられている状態と、自由に動ける状態の比でもあります。
Aは自由なときにだけ、溶離液に乗ってカラム内を移動できます。もしも[AB]/[A] =1ならば、1歩進んだら1回立ち止まらねばならない。つまり移動のチャンスが半分になるので、溶出するまでに2倍の液量が必要になります。もし[AB]/[A] = 0.1なら、10歩進むためには1回立ち止まらねばならないので、V0の10%に相当する遅れが生じます。
以上のように、[A]0をKdよりも十分に低く設定すれば、溶出の遅れ方を測定するだけで結合力を求められます。ただし、あらかじめカラムのBt値は式2に基づく実験(飽和度と[A]0の関係)で求めておく必要があります。この実験だけはKd付近の濃度のアナライトで行わねばならないので、安価で入手しやすい糖誘導体(たとえばp-ニトロフェニル化糖など)を使って測定します。いったんBtを確定できれば、糖鎖が何十種類あろうとも、その一本のカラムで効率よく連続的にKdを決定できます。
以上の考察で、FACには2つの姿があることがわかりました。①アナライトが過剰な場合と、②固定化リガンドが過剰な場合です。①では、アナライト同士が固定化リガンドに結合しようと競合し、結合し損ねたアナライトが速く移動するので、[A]0が大きくなるほどVが小さくなります。それを式2で解析すると、KdとBtを求められます。②では、固定化リガンドにくらべてアナライトがはるかに少ないので、アナライト同士は競合せず、移動の遅れが結合定数(Kdの逆数)に比例するという単純な関係が出現します。これがFACの比類なき解析能力の源泉です。
分子の移動を利用したいろいろな分析法、たとえばゲルクロマトグラフィー、SDS-PAGE、アガロースゲル電気泳動などは、今日の生命科学に欠かせない分析手段になっています。しかしいずれも土台は経験則で、完璧な理論では裏付けされていません。そのため標準分子の移動度との比較が必須ですし、信頼性(特にたんぱく質の分子量)にも問題があります。それに対し、FACは分子間相互作用の遅延解析(Retardation Analysis of Molecular Interaction)という新しい概念に基づく、理論で裏付けされた生化学的解析手段だといえます。
FACの利用はレクチン以外ではまだ限られています(たんぱく質と薬物の相互作用、たんぱく質に結合する化合物のスクリーニング、ポリシアル酸と神経伝達物質との相互作用など)。その主な理由は、研究者が活用すべき対象をまだ見つけていないからでしょう。そこでどんな対象がありそうか、少し想像してみましょう。
グリコサミノグリカン結合たんぱく質の糖コード認識能プロファイル
グリコサミノグリカン上の糖コードを認識するたんぱく質が広範に存在しますが、認識する糖コードはアンチトロンビン、FGFなど、ごく少数についてしか判明していません(それも特別に結合力が強いものだけ)。グリコサミノグリカン由来のオリゴ糖ライブラリーを使えるようになれば、これら多数の隠れレクチンの糖コード親和性プロファイルを集積できます。このような情報はグリコサミノグリカン研究を大きく飛躍させることになるでしょう。
糖脂質間の相互作用解析
糖脂質の糖鎖間のひじょうに弱い相互作用の解明にFACを利用できるかもしれません。糖脂質またはその糖鎖を高密度に固定化したカラムを作れば、実現する可能性があります。
嗅覚レセプターと匂い物質との相互作用
嗅覚は限られた数の嗅覚レセプター(人では400種ほど)で、森羅万象の匂いを識別しています。この場合、複数のレセプターが1種類の匂い分子を結合し、脳がそれらのシグナルを総合(多次元解析)することにより、高い分解能を実現します。レセプターの特異性がゆるく(かつ結合力も弱く)、複数の匂い分子と反応できることがその基盤にあります。レクチンと状況が似ており、FACの出番があるかもしれません。