
氏名:黒谷 賢一
名古屋大学生物機能開発利用研究センター特任講師
2002年に京都大学大学院農学研究科にて博士号を取得。奈良先端大、京都大、名古屋大のポスドクなどを経て2019年より現職。研究テーマは植物の環境応答、シグナル伝達など。現在はRNA-seqデータ解析等、バイオインフォマティクスを主軸にドライ・ウェット両面より植物科学へのアプローチを続けている。

氏名:野田口 理孝
名古屋大学生物機能開発利用研究センター准教授
2009年京都大学大学院理学研究科にて博士号を取得。同年よりカリフォルニア大学デービス校留学、日本学術振興会海外特別研究員。2012年名古屋大学大学院理学研究科研究員及びJST ERATO東山ライブホロニクスプロジェクト研究員。2015年名古屋大学大学院理学研究科特任助教、JSTさきがけ研究員。2016年名古屋大学大学院生命農学研究科助教、名古屋大学トランスフォーマティブ生命分子研究所連携研究者、文科省卓越研究員。2019年より現職。植物の接木のメカニズム、全身性情報伝達などについて取り組んでいる。
接木(接ぎ木)は2つの果樹等をつなぎ合わせて、それぞれの種の利点をあわせもった植物を栽培する技術であり、古来より農業の技法として利用されてきた。植物細胞を取り囲む細胞壁は複数種の多糖類からなる細胞外マトリックスをなし、植物の種類によってその構成は異なる。接木は、接ぎ合わせた二種類の植物の細胞壁が、その境界部において再構成されることで細胞・組織が接着することで起こると考えられる。本稿では我々が最近明らかにした、人為的な植物の接木が成立するメカニズムと、自然界でも起こる植物同士の癒合との共通性について細胞壁の主成分であるセルロースの消化酵素の機能に注目して紹介したい。
現在、農作物生産の現場において、土壌の特性にフィットした地下部(台木)と、生産性の良い地上部(穂木)を組み合わせる接木技法は様々な作物で実施されている。接木は二千年以上の歴史を持ち、リンゴ、ナシ、モモ、ブドウ、ミカンなど果樹のほとんどが接木によって生産されている1。果物の生産性や土壌病害への耐病性、良質な作型、経済年数の確保のために必要不可欠な技術である。また、近年はトマト、キュウリ、ナスなどの野菜類でも接木は活用され、日本の食卓に並ぶこれらの野菜は大半が接木苗から収穫されている。しかしながら、接木には大きな制約が存在し、接木を農業的に利用する上で障害となっている。それは、一般に接木は遺伝的背景が近縁な植物の間でしか成立しないということである。例えばバラとキクのように別々の科に属する植物同士を接木しても、接合部の組織が接着せず、穂木が枯死したり、脱落してしまったりすることから、「異科接木」は不可能であるとこれまで考えられてきた2。
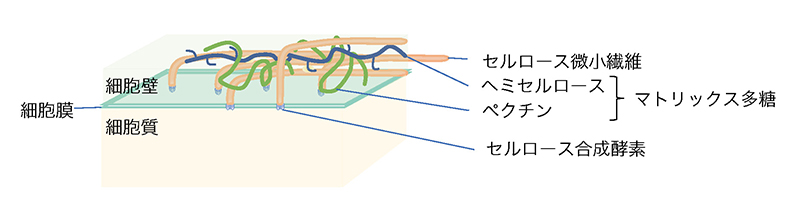
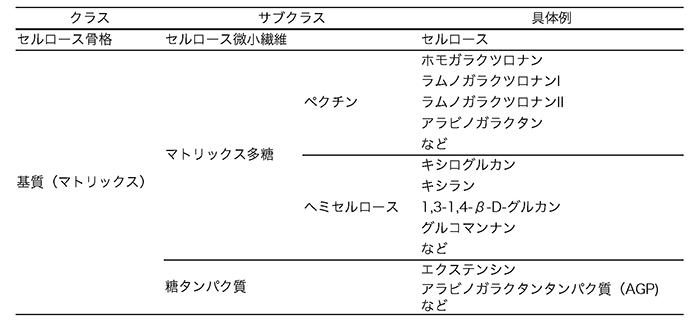
接木のプロセスは、傷ついた茎の表面で細胞が増殖し、二つの植物の互いの細胞・組織が癒着し、組織が再構成されることで果たされる。この初期の細胞・組織の癒着には、互いの植物の細胞壁が再構成されることが必要であると考えられる。動物細胞と比較して、植物の細胞に見られる大きな特徴の一つに細胞壁の存在が挙げられる(図 1)。陸上植物の細胞壁は植物の形態の形成に大きく関わっている3。陸上植物の細胞壁は、セルロースの骨格と基質からなり、基質にはペクチンやヘミセルロースに分類される多糖類にくわえてタンパク質などが含まれる。セルロースはβ-D-グルコースが数千から数万のオーダーで重合した直鎖状糖鎖である。このセルロース分子が数10本平行に配列して束となったものが基本繊維となり、さらに10本程度まとまったセルロース微小繊維となって細胞壁の骨格を形作っている。一方、基質を構成する多糖はマトリックス多糖と称されるが、ホモガラクツロナン、ラムノガラクツロナンI、II、キシログルカン、β-グルカン、キシラン、グルコマンナンなど多種多様な多糖成分からなり、その構成成分の種類、割合は植物種によって異なることが知られる4(表 1)。遠縁な植物では、細胞壁の成分が異なるために再構成が難しく、接木の初期のイベントである細胞・組織の癒着が果たされない可能性がある。実際にほとんどの異科接木の場合、接木後に組織が癒着することはなく、接木した茎の表面が壊死している様子が観察されている。
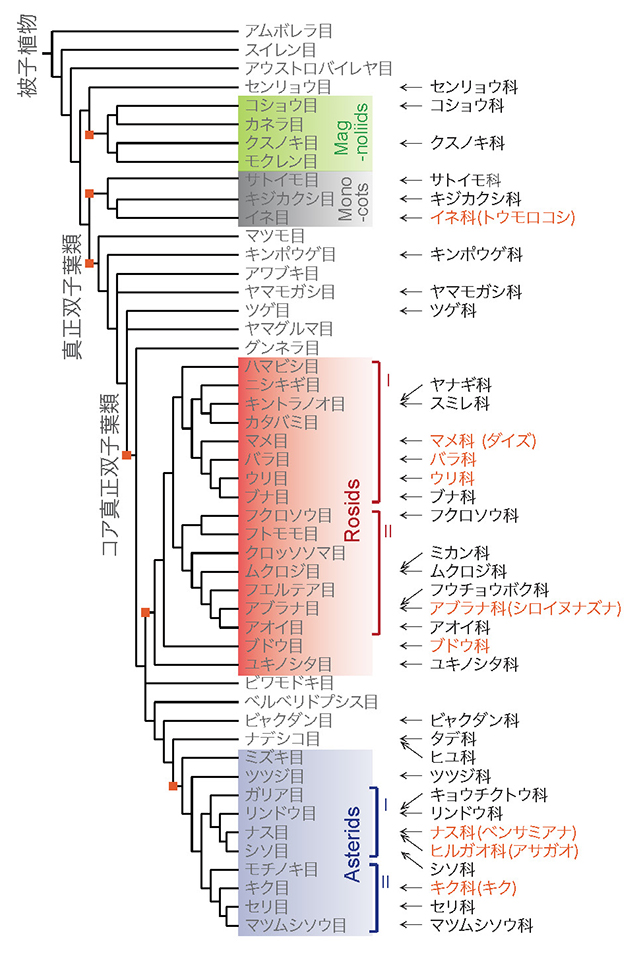
我々のグループでは、以前より植物内の遠距離シグナル伝達機構について研究を行っており、シロイヌナズナ等のモデル植物を使用して、シグナル物質の輸送、移動の検証のための実験手法として接木を用いていた。その中で、ナス科タバコ属のモデル植物であるNicotiana benthamiana(以下ベンサミアナと表記する)と分子遺伝学研究のモデル植物であるアブラナ科のシロイヌナズナを接木すると、科が異なるにも関わらず、接続部位がしっかりと接着し、穂木が長期に渡り生存しうることを偶然発見した5。異科接木の組み合わせを拡張して被子植物の多様な植物種を対象に接着性を調べたところ、ベンサミアナを含む7種のタバコ属植物を用いた42種類の科の84種類の植物種との接木試験において、実に38科73種の植物との接木が成立することが確認された(図 2,3)。長きにわたる接木の歴史の中で、このような万能な接木能力が見出されたことは一度もなく、植物の持つ驚くべき異科接木能力がタバコ属植物に見出されたのであった。

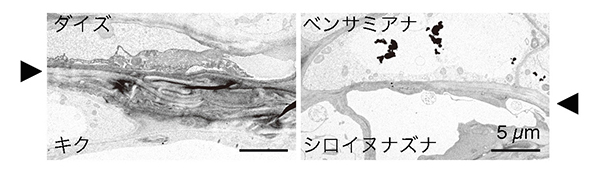
それでは異科接木が成立するタバコ属植物と成立しない他の植物では何が違っているのか。その手がかりを得るために、まず、我々は接木した植物の接続部分を形態学的に観察した。組織切片を作製して顕微鏡観察すると、ベンサミアナの接木部位からカルスと呼ばれる植物の柔組織が細胞分裂によって増殖している様子が観察された。それらの柔組織は、接木した相手の植物組織とよく癒着しており、他の異科接木で接木が失敗する際に頻繁に認められた組織の壊死層が軽微にしか認められなかった。透過型電子顕微鏡でさらに詳細に細胞の様子を観察すると、接木が成立しないダイズとキクの場合には、接合面の間に細胞壁等の壊れた細胞の残骸が挟まって、壊死層を形成しているのに対し、接木が成立するベンサミアナとシロイヌナズナでは細胞同士が近接し、両者の生きた細胞の細胞壁が密着している様子が観察された(図 4)。このことから2つの植物間に生じた細胞残渣の分解、細胞の接着癒合が接木成立に重要なファクターである可能性が示唆された。
次に、我々は異科接木成立の分子メカニズムを探るために、次世代シークエンサーを用いたRNA-seq解析により、ベンサミアナとシロイヌナズナの接木サンプルの時系列トランスクリプトーム解析を実施した。接木後3日目には2つの植物の細胞同士の癒合が開始していることが先程の顕微鏡観察の結果から示唆されていたため、接木後1日目、3日目、7日目と発現上昇が維持される遺伝子の抽出を行ったところ、189個の遺伝子が同定された。これら遺伝子群の遺伝子オントロジー(GO)解析を行ったところ、細胞外分泌、細胞壁、アポプラスト及び原形質連絡に関連のある遺伝子群のエンリッチが認められた。一方、異科接木が成立しないダイズとシロイヌナズナの接木部分の植物サンプルについても、比較のため同様の時系列トランスクリプトーム解析を実施した。ベンサミアナで同定した189個の遺伝子のダイズにおける相同遺伝子をゲノム解析で抽出して、ダイズを異科接木した場合におけるそれらの遺伝子発現パターンを調べた。異科接木を成立させることを可能にしているタバコ属植物に特異的な遺伝子を抽出すべく、異科接木が成立しないダイズでは遺伝子の発現上昇が起こらない遺伝子群に候補を絞り込んだのである。実際に189遺伝子から絞り込まれた遺伝子は79遺伝子となった。我々はこれらの候補遺伝子群の中で植物のGH9B3サブファミリーに属するβ-1,4-グルカナーゼに注目してさらなる解析を行った。β-1,4-グルカナーゼは細胞外に分泌され、細胞壁形成に関与することが示唆される酵素タンパク質であり、セルラーゼとも呼ばれる(図 5)。セルラーゼはエンド型の分解酵素であり、セルロースやキシログルカン、β-グルカン、グルコマンナンなどの糖鎖を切断する活性を持つと考えられている。同定されたセルラーゼ遺伝子の発現を一過的に抑制したべンサミアナをシロイヌナズナに接木すると、未処理のベンサミアナに比べて接木成功率の低下が認められた。これらの結果より、タバコ属植物の異科接木能力の発揮には、GH9B3サブファミリーに属するセルラーゼ遺伝子の働きが重要であることが示唆された。
接木は異科であれ同科であれ、人為的な操作であり、本来自然に生じるものではないと考えられる。ではGH9B3セルラーゼ遺伝子の本来の機能は何であろうか。我々は、同科(自家)接木が自然界において偶発的に生じる茎の損傷や切断の修復に近い現象ではないかと考えており、これらの組織の癒合にセルラーゼが働いているのではないかという仮説を立てた。そこで、我々は同科接木におけるGH9B3セルラーゼ遺伝子の機能を解析することにした。GH9B3セルラーゼ遺伝子はベンサミアナの同科接木時にも発現が上昇することがわかったので、CRISPR-CAS9を用いて当該遺伝子を破壊したべンサミアナを作出し、同科接木を実施した。その結果、GH9B3セルラーゼ遺伝子を破壊したベンサミアナ同士で接木した場合は、野生型同士の場合に比べ、接木の成功率が有意に低下することが示された。また、ダイズ、アサガオ、トウモロコシ、シロイヌナズナについてもそれぞれの同科接木を実施し、β-1,4-グルカナーゼ遺伝子群の発現パターンを経時的に調べた。すると、GH9B3サブファミリーに属するセルラーゼ遺伝子はダイズ、アサガオ及びシロイヌナズナにおいても同科接木時に発現が上昇することが示された。β-1,4-グルカナーゼは高度に発達した遺伝子ファミリーを形成しているが、この発現上昇はGH9B3サブファミリーに属するセルラーゼ遺伝子に特徴的なものであった。さらに、シロイヌナズナにおいて、GH9B3セルラーゼ遺伝子の変異体であるcel3変異体の接木を実施したところ、接木後の生育が不良となり、逆に、GH9B3セルラーゼ遺伝子を接木部位で人為的に過剰発現させると接木の成功率が上昇した。これらのことから、同科接木においては広範な植物で普遍的に、GH9B3セルラーゼが接合した組織の癒合に機能している可能性が支持された。一方、ダイズ、アサガオ、トウモロコシについてシロイヌナズナを台木とした異科接木を行ったところ、ダイズ、アサガオでも一過的には発現上昇するものの、一定以上には発現の上昇が継続しないことがわかった。我々は以上の結果より、1)植物を接木するとGH9B3セルラーゼ遺伝子の発現が上昇し、接合面の組織の癒合が促進される、2)一般的な植物の場合、接木相手が自身もしくは同科の植物でないときにはGH9B3セルラーゼ遺伝子の発現が維持されず、癒合できない、3)タバコ属植物では相手が異科の植物であってもGH9B3セルラーゼ遺伝子の発現上昇が例外的に維持されるために、異科接木が成立する、という結論に至った。なお、単子葉植物のトウモロコシで発現が認められなかった点については、単子葉植物はそもそも茎に傷をおっても修復が起こらないことから、この修復機構を失ったと考えられた。
セルラーゼは細胞壁の癒合を直接触媒するわけではないが、植物の細胞壁の主要な成分であるセルロースを切断することで、台木―穂木間で、セルロース微小繊維の再構成、融合のための材料供給をしている可能性がある。また別の仮説として、分解された細胞壁由来の糖鎖分解物がトリガーとなって何らかの遺伝子の発現をコントロールし、組織の癒合を促進しているという可能性もあり、今後の研究で明らかにしていきたい。
ここで関連するもう一つの研究として、寄生に注目した研究での発見について紹介する。接木が人為的な植物の接合であるのに対し、寄生は寄生植物が獲得した異種植物組織との自然の結合様式である。異種結合という点において、寄生とタバコ属の異科接木には共通するメカニズムが存在するのではないかと考え、この仮説を検証することとした。我々はまず、寄生植物の研究でモデル植物として使われているコシオガマを対象に寄生部位の形態学的な観察を行った。コシオガマは根に吸器を形成して、宿主植物の根に寄生する。寄生の接合面を電子顕微鏡によって観察すると、宿主植物の組織と接した細胞壁が局所的に薄く消化されており、ベンサミアナの異科接木の接合面とよく似た形態を示していた。また、共通したメカニズムがあるならば、寄生植物も異科接木が可能ではないかと考え、シロイヌナズナ台木に対してコシオガマの異科接木を実施した。その結果、タバコ属植物同様に寄生植物であるコシオガマも異科接木が可能であることがわかった6(図 6)。これらのことから、寄生と異科接木にはやはり、共通する分子メカニズムの存在が示唆されたため、我々はシロイヌナズナに寄生させたコシオガマの吸器と、シロイヌナズナにコシオガマを接木したときの接合部位において、時系列トランスクリプトームの比較解析を実施した。寄生が成立するタイミングに発現が上昇する遺伝子クラスターと異科接木により組織の癒合が起こるタイミングに発現上昇する遺伝子クラスターを自己組織化マップを用いたクラスタリングによりそれぞれ抽出し、両者に共通する遺伝子群を同定したところ、そこにGH9B3セルラーゼ遺伝子が含まれていることを見出した。さらに、コシオガマの吸器において一過的にGH9B3セルラーゼ遺伝子の発現を抑制すると、寄生に必要な構造形成に異常が起こる確率が上昇することから、寄生にもやはりGH9B3サブファミリーに属するβ-1,4-グルカナーゼが機能していることが強く示唆された。

接木は人為的な操作であるが、自然界においては偶発的に生じる傷害の修復に相当するものではないかと考えられる。損傷した組織の修復にあたり、接合する相手が自身の組織であれば癒合し、他者であれば拒絶するという自他認識機構がそこにはあるのではないか。タバコ属植物では何らかの理由によってその自他認識がゆるくなる方向へ進化し、寄生植物では他者との接合を可能とするようにあえて進化したのではないだろうか。
2つの植物の特性を融合させる接木技術だが、その適用範囲を異なる科の植物間に拡張するポテンシャルがタバコ属植物にはある。今回の発見を受けて、我々はタバコ属植物を中間台木として利用すれば、本来は接木することのできない遠縁な植物の異科接木を間接的に行うことができるのではないかと考えた。陸上で最も繁栄しているキク科植物を台木として、その上に世界中でも最も食べられている野菜類のトマトを接木することにした。タバコ属植物をこれら二つの植物の間に挟んで、キク・タバコ属植物・トマトの接木を行ったところ接木は成立し、3ヶ月以上その苗を育ててトマト果実を実らすことにも成功した(図 7)。キク科植物は様々なストレス土壌に強く繁殖力が高い。将来、そんな頑強な植物資源を異科接木法という手法で活用できたらと願っている。
異科接木法は、単純に作物生産に利用するだけではなく、接木を介した植物ホルモンやタンパク質、RNAなどの生体分子を物質送達する技術としても利用が期待される。これまでに異科接木を介して接木した相手の植物で遺伝子サイレンシングやタンパク質発現を誘導することに成功しており、遺伝子組換え技術を直接利用するのではなく接木で間接的に利用する手段となりえるのではないかと考えている。
現在のところ、同科接木にくらべて異科接木は組織の結合がまだ不完全で、穂木の生育に十分ではない。今回のGH9B3セルラーゼ遺伝子の発見を受けて、より強固な組織結合を作る技術展開があればと思う。実際にセルラーゼの外的投与による効果を調べたところ、接木部位の組織の物理的な接着力が向上することが実験的に示された7。もちろん組織の結合に関してだけでなく、タバコ属植物の異科接木能力に着目することで、細胞増殖や自他認識、通道組織の再組織化といった接木の成立に関わるプロセスについてさらなる理解を得たい。植物科学にとっても重要なそれらの課題に取り組んでいくことで、接木技術や植物資源の活用技術を向上させ、近年の世界的な人口増とそれに伴う人類活動に起因した地球規模の環境問題に一助できればと願う。

謝 辞
本稿で紹介した研究成果は、多くの研究者、関係者各位のご尽力によって得られたものであり、JST (START 15657559、PRESTO 15665754)、キヤノン財団 (R17-0070)、文部科学省 科研費(18KT0040, 18H03950, 19H05361)、農研機構 イノベーション創出強化研究推進事業 (28001A、28001AB) のご支援の下で実施してきた。ここに心より御礼申し上げるとともに、さらなる接木研究の推進と技術の普及に向け、これからも多くの方々のご指導、ご支援を賜れれば幸いである。