
氏名:夏目 敦至
名古屋大学未来社会創造機構 特任教授、河村病院 脳神経外科部長
1995年名古屋大学医学部卒業、1999年 米国ペンシルバニア州ピッツバーグ大学生化学・分子遺伝学教室 研究員、2000年名古屋大学大学院医学系研究科 医学博士。脳腫瘍のゲノム・エピゲノム研究、ゲノム診断・治療、細胞医療の開発に従事している。
悪性脳腫瘍の新たな治療法を開発すべく、ポドプラニン(Podoplanin; PDPN)という分子に注目している。PDPNとは、がん細胞の表面に多く出てくることが多いとされるタンパク質であり、特にがんの悪性化に関係があることがわかっている。PDPNが現れているがん細胞を標的(ターゲット)にし、がん細胞だけを攻撃することができれば、患者の負担が少ない状態で治療をすることが可能になる。
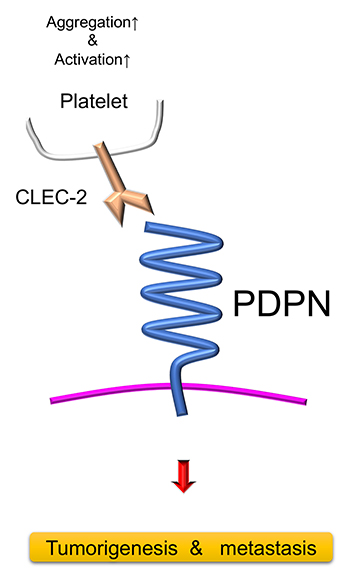
PDPNは、約130個のアミノ酸からなる細胞外ドメインと約25個のアミノ酸からなる膜貫通ドメイン、そしてわずか10あまりのアミノ酸で構成される細胞内ドメインで形成される(図 1)。細胞外ドメインは高度に糖鎖が結合しているため、糖鎖研究の分野でも注目されている。また、細胞内ドメインが非常に短いため、PDPN自体には機能ドメインや酵素活性は含まれていなく、他の分子と結合することで機能を発揮する。例えば、C-type lectin-like receptor-2 (CLEC-2)、 heat shock protein A9 (HSPA9)、 CD44, galectin 8、chemokine (C-C motif) ligand 21 (CCL21)、ezrin, moesin, protein kinase A (PKA)、 cyclin dependent kinase 5 (CDK5)などと結合し、細胞の挙動を変化させ、癌細胞においては遊走、浸潤あるいは転移を促進する1-4。
PDPNは頭頚部、食道、肺、子宮頚部の扁平上皮癌、精巣セミノーマ、悪性中皮腫など多くの悪性腫瘍に発現しており1,3、特に、口腔内扁平上皮癌の腫瘍マーカーとして用いられる。PDPNの発現は、5年生存率と逆相関し、また、口腔内扁平上皮癌の「前がん」病変である白板症にPDPNが発現すると、3倍ほど悪性化する可能性が高くなる5。
また、PDPNが発現するのは腫瘍細胞そのものだけではない。例えば、癌関連線維芽細胞(cancer-associated fibroblast; CAF)1,3,5や腫瘍周囲の基底膜にあるケラチノサイト6にPDPNの発現が増加すると、腫瘍細胞の遊走や転移が促進される。その分子機構は解明中である。しかし、血小板のCLEC-2は、細胞接着分子のE-Cadherinと作用し腫瘍周囲のケラチノサイトやCAFを基底膜上に留めるが、PDPNが豊富に存在すると、CLEC-2と競合的に結合し、ケラチノサイトやCAF、ひいては腫瘍細胞が動きやすくなる環境になると考えられている7。
PDPNの細胞外ドメインを小分子化合物、レクチン、抗体、さらにはキメラ抗原受容体T細胞(Chimeric antigen receptor T cells;CART)によって阻害する研究開発が進んでいる。
PDPNは、血液中の血小板上のCLEC-2と結合して、腫瘍塞栓と血行性転移を促進する8,9(図 1)。4-O-benzoyl-3-methoxy-beta-nitrostyrene(BMNS)の合成派生物である “2CP” はPDPNを介する血小板凝集や癌が引き起こす異常な血小板の活性化を抑制する9。レクチンは糖鎖と結合するが、天然レクチンであるMaackia amurensis seed lectin(MASL)は悪性黒色種や口腔癌に発現するPDPNと結合し、癌細胞の遊走や転移を抑制する効果が前臨床試験で明らかになった10。これを受けて現在、口腔癌に対して米国で臨床試験中である(NCT04188665、https://clinicaltrials.gov/ct2/show/NCT04188665)。
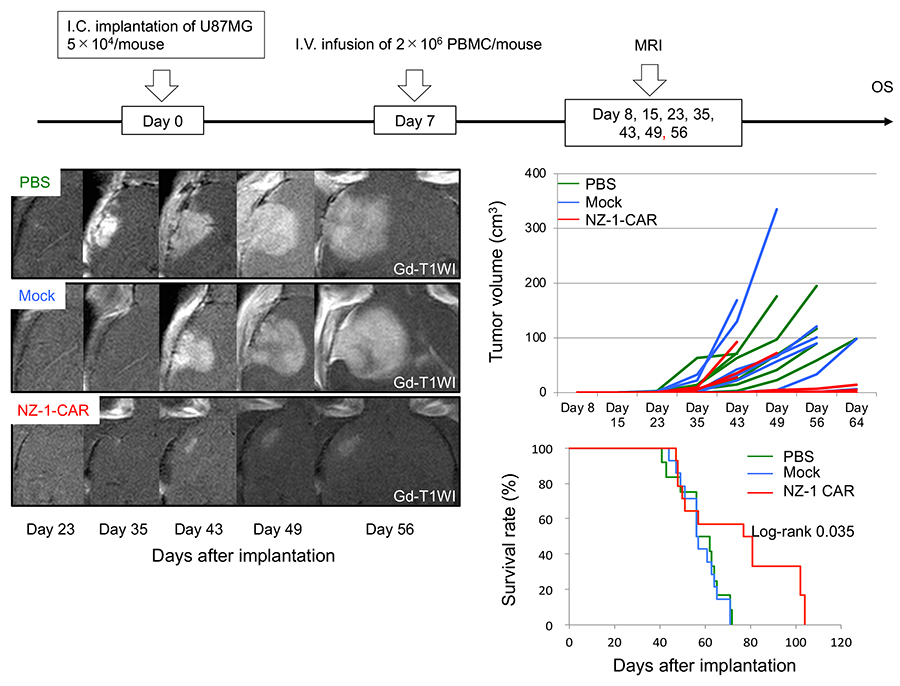
膠芽腫は最も予後の悪い成人の原発性脳腫瘍である。最大限の手術及び放射線化学療法を行っても、5年生存率が10%以下であり、新たな治療法の開発が望まれている。近年、種々の悪性腫瘍において免疫療法が注目されており、膠芽腫に対してもその効果が期待されている。免疫療法の一つにキメラ抗原受容体(CAR)T細胞療法があり(図 2)、CARをT細胞に発現させることにより、主要組織適合遺伝子複合体(MHC)に依存しない腫瘍特異的細胞障害性T細胞を大量に作製することが可能である。膠芽腫に発現するEGFRvⅢ11-13、HER214、IL13Rα215といった種々の腫瘍抗原に対するCARの報告があるが、膠芽腫は様々な表現型を持っており、新たな腫瘍抗原に対するCARの作製は治療上有利となりうる。PDPNは、膠芽腫を含む星細胞系腫瘍においては、悪性度に応じて発現が上昇しているため16、膠芽腫の標的として適している。そこで、我々の研究グループはPDPNに対するモノクローナル抗体NZ-117を基に、CAR遺伝子を人工合成し(NZ-1-CAR)、T細胞に遺伝子導入した(NZ-1-CAR T細胞)18。NZ-1-CAR T細胞の細胞傷害性をカルセインアッセイにて、評価したところ、PDPN陽性膠芽腫細胞株であるLN319やU87MGに対して、E/T比に従って、有意に細胞傷害性が認められた。一方、PDPNをノックアウトしたLN319、U87MGでは有意差は認められなかった。NZ-1-CAR T細胞とPDPN陽性膠芽腫細胞株であるLN319やU87MGを共培養することにより、モックCAR T細胞に比し、癌細胞がT細胞によって傷害されるときに放出されるサイトカインであるIFNγの産生量が有意に多く、NZ-1-CAR T細胞がPDPNを特異的に認識していることが示された。マウスの脳内にPDPN陽性膠芽腫細胞株を移植後、CAR T細胞をマウスに全身投与し、非治療群、モックCAR T(対照CAR T)細胞群、NZ-1-CAR T細胞群において、腫瘍サイズと生存期間の評価を行ったところ、NZ-1-CAR T細胞群では腫瘍の増大が抑制され、約60%のマウスで生存期間の延長が認められた(図 3)。
しかし、PDPNをターゲットとするCAR T細胞療法は膠芽腫治療に有望だが、PDPNはリンパ管内皮細胞や肺胞上皮細胞などの正常細胞にも発現しており19,20、NZ-1-CAR T細胞が正常細胞も攻撃してしまうという欠点がありえる。
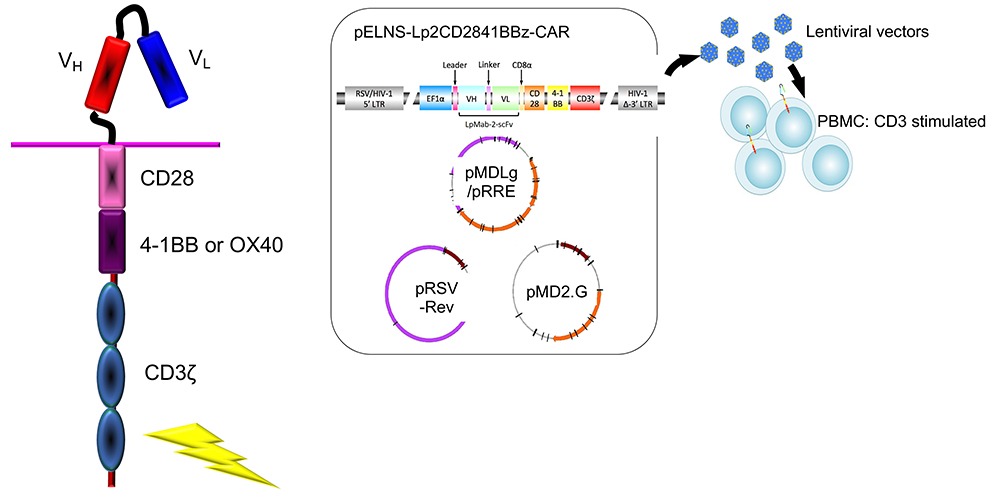
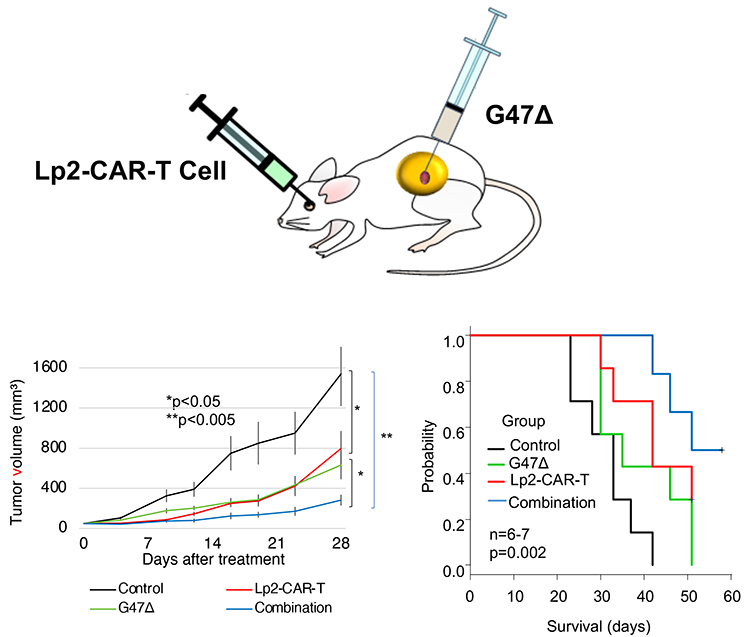
PDPNを標的とするCAR-T療法の開発のうえで課題となるのが、PDPNは、肺、腎臓、リンパ管にある正常な細胞の表面にも出ているということである。この課題を解決するために、共同研究グループは、がん細胞のPDPNが、正常細胞のPDPNに比べて異常な糖鎖が多く、構造が少し異なることを発見し、がん細胞のPDPNを見分ける抗体(がん特異的抗体、Lp-Mab2)を作製した21,22。これを元に、われわれのグループは、この抗体の遺伝子配列の一部とがん細胞を攻撃するT細胞がもつT細胞受容体の遺伝子の一部をハイブリッドさせたCAR-T 細胞を作製した23。このCAR-T細胞を実験マウスの全身に注入することによって、膠芽腫の細胞だけを正確に攻撃することが確認できた(図 4)。
次に注目したのは、ヒトの体に比較的身近なヘルペスウイルスである。私たちにとって悪者であるはずのウイルスが、実はがん細胞に感染し死滅させることがわかっている。実験では、口唇ヘルペスや角膜ヘルペスの原因となるウイルスを、共同研究グループが人工的に改変してつくられたヘルペスウイルスG47Δを用いた24。この改変したG47Δはテセルパツレブ(一般名)として2021年に世界で初めて保険承認された新しい脳腫瘍治療薬である25。この改変されたウイルスもまた、脳腫瘍のがん細胞だけに感染し、腫瘍細胞を破壊する。その結果、G47Δを併せて投与すると、CAR-T細胞療法を単独で行うよりも、飛躍的に腫瘍の成長を抑制し、実験マウスの生存期間を延長させることが明らかになった(図 4)23。
本研究により、悪性脳腫瘍の治療にもキメラ抗原受容体 (CAR) -T細胞療法が期待できる可能性が明らかになった。マウスの実験では、副作用は確認されず高い安全性が確認されたが、今後の臨床試験での応用を目標に、ヒトへの安全性を十分に検討しなければいけない。また、CAR-T細胞療法とウイルス療法の併用療法がCAR-T細胞療法の効果を強めるという結果が得られたことから、悪性脳腫瘍である膠芽腫の新規治療法が期待される。また、この併用療法の実現に向けて更なる免疫学的メカニズムの解明が必要である。