
氏名:内野 裕一
ケイシン五反田アイクリニック 副院長
慶應義塾大学医学部眼科学教室 特任講師(角膜ドライアイ外来担当)
2001年3月 慶應義塾大学医学部卒業
2001年4月 慶應義塾大学医学部眼科学教室入局 助手
2004年6月 東京歯科大学市川総合病院眼科 院内助手 (角膜フェロー)
2009年9月 東京電力病院 眼科医長
2012年4月 Harvard Medical School, Massachusetts Eye and Ear, Schepens Eye Research Institute, Postdoctoral Fellow
2016年4月 慶應義塾大学医学部眼科学教室 専任講師 (角膜/ドライアイ外来担当)
2022年4月 現職
ドライアイは全日本人の約20%、PC作業を長時間行うオフィスワーカーでは約65%の罹有病率が確認されている1、一般市民にとっても非常に身近な疾患である。ドライアイには日本における定義(表 1)と診断基準2(表 2)があり、アジア周辺国もAsia Dry Eye Societyを通じて専門家が意見交換をした結果、同じ定義と診断基準下で治療している。すなわち眼表面における涙液層の不安定化こそがドライアイの病態生理を考える上で最も重要といえる。この涙液の不安定化には眼表面にあるグライコカリックスの破綻が関与しており、グライコカリックスを構成するタンパクの一つであるガレクチン3の役割が注目されるようになってきた。この解説では眼表面における涙液の挙動を簡単にレビューし、涙液層の不安定化の病態生理に触れながら眼表面におけるガレクチン3について、正常眼とドライアイでどのような違いが生じているか、現在までに分かっている臨床と基礎研究の両方から本項で触れていきたい。
| ドライアイは、さまざまな要因により涙液層の安定性が低下する疾患であり、眼不快感や視機能異常を生じ、眼表面の障害を伴うことがある。 |
| ① 眼不快感、視機能異常などのドライアイ自覚症状 | ② 涙液層破壊時間(BUT)が5秒以下 |
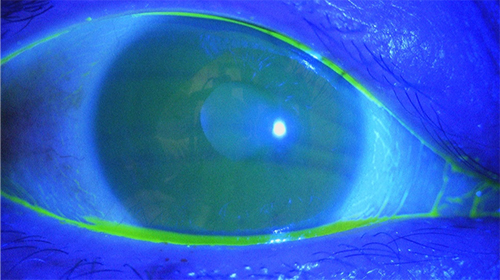
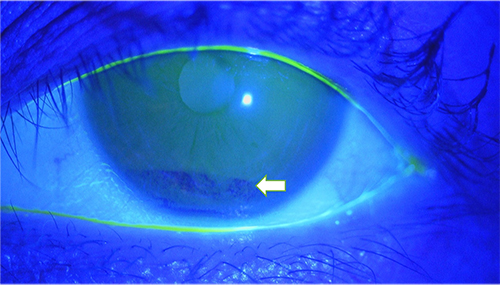
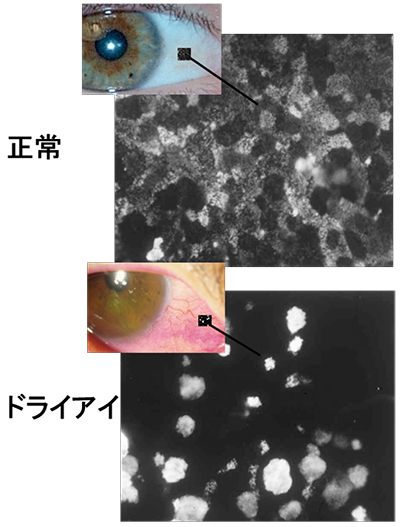
まず涙液層の不安定化を見抜く上で、臨床現場で簡便かつ重要な検査が涙液層を可視化するフルオレセイン染色試験である。正常眼では眼表面における涙液層は、約5~10 µmの厚さで薄膜として存在する(図 1)。開瞼直後は涙液層が安定していても、ドライアイでは涙液層が数秒で不安定化し、涙液層の厚みが極端に薄くなった場所(dark area)が確認されるようになる(図 2)。このように開瞼してから涙液層が破綻するまでの時間を涙液層破壊時間(Tear Break Up Time(BUT))という。BUTが10秒以上あれば正常であり、5秒以下であればドライアイ所見とする。5~10秒の場合は環境因子や眼表面のわずかな変化でも容易に5秒以下に変動するため注意する。
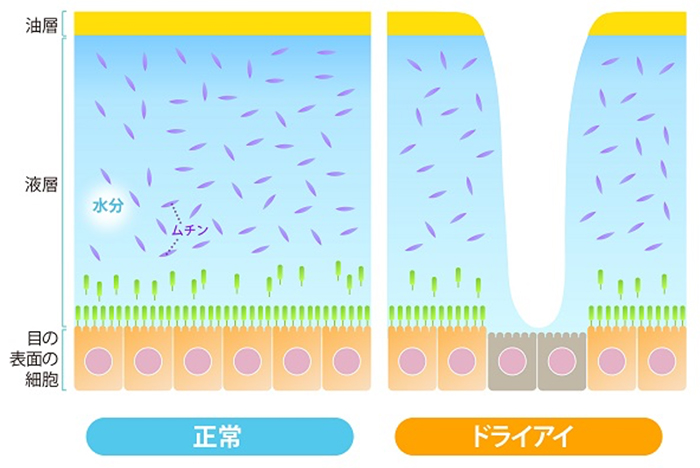
この涙液層が短時間で破綻するメカニズムを説明する前に、正常な眼表面の涙液層について解説する。涙液層は表面側から油層と液層の二層構造を形成している(図 3)。古い教科書をみると三層構造として角膜上皮の表面、涙液層の最も深層の部分をムチン層と記しているものもある。しかしムチン層は液層中の分泌型ムチンと上皮側に発現している膜型ムチンに分けられることが判明したため、現在ではムチン層を涙液の層構造の一つとしては扱っていない。涙液層の中で特に重要なのは、液層である。何より涙液層の厚みのほとんどを担い、電解質、抗菌物質(ラクトフェリン、リゾチームなど)、免疫グロブリン(分泌型IgA、IgGなど)、成長因子(EGF、TGF-βなど)、分化誘導因子(Vitamin Aなど)というあらゆるタンパク質が含まれて、角結膜上皮細胞に必要な栄養や酸素を運んでいる。また結膜内に存在する杯細胞(goblet cell)から分泌型ムチンが放出し、液層内に溶解している。特に結膜杯細胞内に貯留し、適宜涙液中に放出されている分泌型ムチンはMUC5ACで、ムチン特有の大量の糖鎖と架橋構造の構築により、液層における保水効果をもたらしている。また分泌型ムチンは涙液自体の表面張力を低下させることで、眼表面における水濡れ性を改善させている3。これは眼表面で涙液層が容易に破綻せず安定化するためにはとても重要なことである。
一方で油層は涙液全体の厚みの安定化や涙液中水分の蒸発抑制などに貢献している。油層を構成する脂質は非極性脂質(コレステロールエステル)と極性脂質に分けられ、油層は表層側を非極性脂質が覆い、一方で液層の水分とバランスをとるために油層の下側は極性脂質が存在している。非極性脂質は眼瞼内のマイボーム腺から分泌されているが、極性脂質の多くは涙腺から分泌されており、油層は非常に薄い膜であるものの、その構成成分や層構造のバランスは絶妙である。
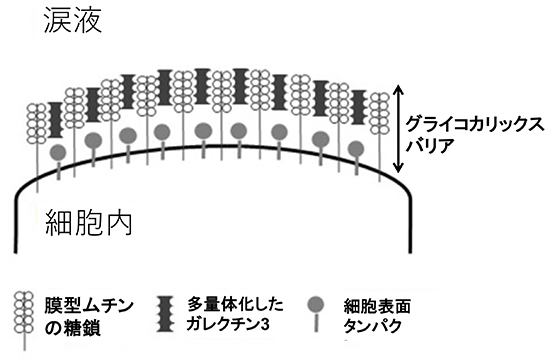
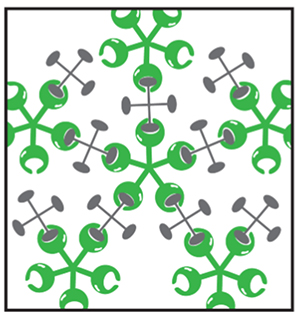
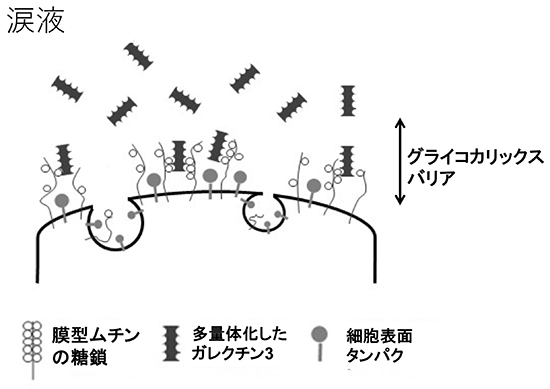
角結膜上皮の表面は微絨毛(microplicae)といわれる突起物の構造があり、微絨毛の先端に膜型ムチンが芝生の芝目のように大量に発現している(図 4)。膜型ムチンは疎水性の膜貫通型ドメインを持ち、上皮細胞の細胞膜で固定されている。細胞内のドメインは短く、細胞外のドメインが圧倒的な長さを持ち、約200~500 nmにおよぶ。角膜上皮細胞は膜型ムチンとしてMUC1、MUC4、MUC16を発現しており、特にMUC16はコアタンパクがとても長く、糖鎖も多く抱えていることから分子量も非常に大きい。膜型ムチンの糖鎖も分泌型ムチンと同様に架橋構造を取りながら保水効果を有し、そのスケールメリットを生かしてバリア機能にも大きく関与している。しかし眼表面の膜型ムチンだけでは涙液中にぼんやりと漂うのみで、これでは浅い海底で海流に漂う昆布のようなものであり、バリア機能を有するとは言いがたい。実はこの膜型ムチン同士をつなぎ合わせているのが、膜型ムチンの糖鎖に結合するガレクチン3(Galectin-3)というタンパク質があり、微絨毛に大量に発現しているMUC1やMUC16の糖鎖と結合してバリア機能を形成している(図 5)。ガレクチン3は糖鎖と結合する糖鎖認識部位とガレクチン同士を結びつける多量体形成部位があり、膜型ムチンと多量体化したガレクチン3が連続的に結合してgalectin-glycan lattice formation(図 6)といわれる格子状構造を形成する5。前述の通り膜型ムチンは200~500 nmに及ぶ長さがあり、大量のO型糖鎖を持っているため、この膜型ムチンとガレクチン3の格子構造によるバリアは一定の厚みで形成され、眼表面のおけるグライコカリックスを形成している6(図 7)。グライコカリックスは細胞表面のクッションとなり、化学物質や物理的傷害からの細胞の保護や、細胞間同士をつなげることで組織としての安定を増強しバリア機能を発揮している。特に眼表面は眼瞼結膜と常に触れ合い摩擦が生じていることから、このグライコカリックスが摩擦軽減に貢献している。このように膜型ムチンは大量の糖鎖による細胞表面の保水機能と、グライコカリックスバリアという物理的/化学的防御、さらには眼表面における摩擦の軽減といった保護機能により、外界との最前線で涙液とともに我々の眼球を守っている。

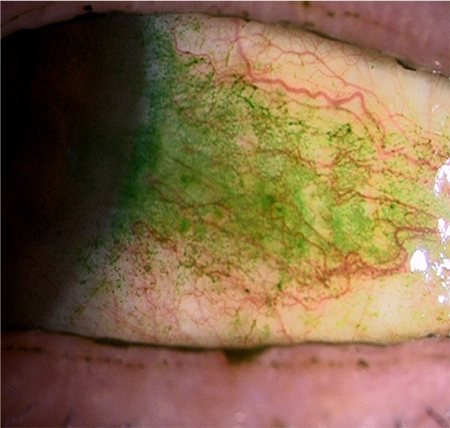
グライコカリックスバリアが破綻すると眼表面はローズベンガルやリサミングリーンなどの色素で染色されるようになり(図 8)、この染色方法はドライアイにおける臨床診断にも用いられる方法である。眼表面のグライコカリックスバリアの破綻が生じているときには、膜型ムチンとともにグライコカリックスを形成するはずであるガレクチン3の所在も不安定になる。ガレクチン3は角結膜上皮細胞から産生され、外部すなわち涙液中に放出される。正常な眼表面であれば、膜型ムチンが微絨毛上に大量に発現し、大量の糖鎖をかかえてガレクチン3を待ち構えているため、ガレクチン3が涙液中にフリーの状態で漂うことはあまりない(図 5)。しかしながら、ドライアイでは眼表面における膜型ムチン、特に最もサイズの大きいMUC16のタンパク発現が低下しており(図 9)、上皮細胞から産生されたガレクチン3をグライコカリックスの一部として保持できず、そのまま涙液中にフリーの状態で放出される8(図 10)。このことから、ドライアイなどグライコカリックスバリアが破綻した疾患では、正常群と比較して有意に涙液中ガレクチン3が増加することがわかってきた。一方上皮細胞によるガレクチン3の産生量について、Realtime PCRを用いてドライアイ患者と正常者で比較しても、特に差がないことも明らかとなり、ドライアイ患者で上皮細胞によるガレクチン3産生量が有意に増えているのではなく、グライコカリックスバリアの破綻により涙液中のガレクチン3が増えていることがわかった9。
ドライアイは眼表面の上皮障害をスコア化することで重症度分類が可能である。我々の研究チームはドライアイ患者と正常者から涙液を回収し、ガレクチン3の涙液中タンパク濃度を測定、ドライアイ重症度で3群に分けて比較したところ、高い重症度のドライアイ患者ほど、涙液中のガレクチン3が高いことを見出した。また上皮障害スコアのみならず、涙液分泌量や自覚症状の強さとも有意な相関関係を示すことがわかり、涙液中のガレクチン3濃度はドライアイの重症度判定に有用であることが証明されている10。
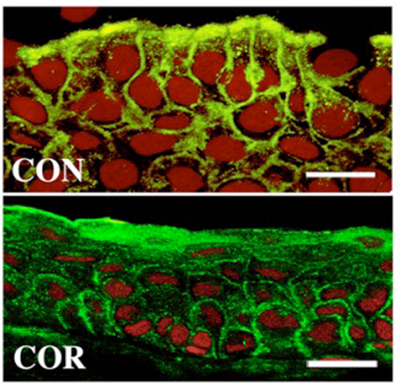
グライコカリックスを構成するガレクチン3が上記のように重要であることがわかると、多くの研究者たちがドライアイ治療薬としてガレクチン3が有用であると考え、活発な研究が行われるようになった。実際にドライアイ治療をターゲットとして特許を取得した研究者や、上市に向けて臨床応用に入った製薬会社もあったと聞いている。私も米国留学中にガレクチン3を濃度別に培養角膜上皮細胞に投与してグライコカリックスバリア機能が強化されることを期待した実験を行った。角膜上皮細胞はIL-1βを入れると炎症反応が起きるのだが、ガレクチン3がグライコカリックスバリアを強化できれば、IL-1β投与後の炎症反応も弱くなると考えたのである。しかし結果は全くの逆で外から加えたガレクチン3濃度が高いほどIL-1βで惹起される炎症反応は強くなったのである11。ガレクチン3は細胞表面受容体を凝集し、受容体を介した反応を長期化させる可能性もあったが、自分の実験ではそれを証明することはできなかった。ただタグをつけたガレクチン3を培養角膜上皮細胞に投与すると、細胞内に取り込まれていることがわかった。そのことが炎症反応の促進に何かしら影響していると思われたが、未だにその詳細は分かっていない。
上記の研究を海外の学会で講演した際に、ドライアイ治療薬としてガレクチン3の特許を持っていた私の尊敬する先生からコメントをいただいた。「今日のあなたの発表は素晴らしかったわよ。でも私の特許は一つ無くなったわね。残念だわ。」そういったときの笑顔はいまでも忘れられない。ガレクチン3が炎症を悪化させることは、実は眼表面では合目的と考えられる。ガレクチン3が涙液中に大量に存在する場合では、上皮細胞がダメージを受けて、膜型ムチンの発現も著しく低下している可能性が高い。新しい重層上皮化した上皮細胞が眼表面を覆うには、新陳代謝が必要で、細胞の脱落や移動を考えると、細胞同士のつながりであるtight junctionなどの細胞間接着分子は一時的であれ不要である。細胞間接着分子を含めて上皮の可動性を上げる上で重要な環境がまさに炎症である。一過性に炎症を促進させて、上皮細胞がまた正常に落ち着けば、その促進作用は不要である。この促進作用こそが、グライコカリックス破綻時のガレクチン3が担っている、もう一つの大事な役割なのではないかと予想している。
グライコカリックスバリアを構築する上でガレクチン3と同様に重要なのは膜型ムチンのMUC16である。実はドライアイ点眼薬として上市された点眼薬で、このMUC16タンパク発現を角膜上皮細胞で高く維持できる薬剤がある。一般名レバミピドは、1990年に胃潰瘍の内服薬として上市されてから粘膜保護を主体とした治療薬として数多くの患者へ処方されてきた。眼表面も粘膜であり、ドライアイでは上皮障害を伴うことも多いため、2012年に点眼薬として開発されたという経緯がある。レバミピドを濃度別に重層化させた培養角膜上皮細胞に添加し、膜型ムチンであるMUC1/MUC4/MUC16のタンパク発現レベルを投与したレバミピド濃度別に比較したところ、レバミピドはMUC16のタンパク発現レベルを高めることが証明されている12。レバミピド点眼液が上市されて臨床研究がすすめられたときに、レバミピド点眼を使用したドライアイ患者の自覚症状の中で、特に改善されていたのが、痛みや異物感であり、これは既存のドライアイ点眼薬では改善が難しい自覚症状であった13。このように痛みや異物感といった症状が改善した要因は、おそらくMUC16タンパク発現が整うことで、グライコカリックスバリアが再構築されて、眼瞼との摩擦が軽減されたためと考えられる。
眼表面におけるグライコカリックスは膜型ムチンMUC16と多量体化したガレクチン3による格子状構造により形成されている。ドライアイ患者ではMUC16タンパク発現が低下し、このバリアは破壊され、本来グライコカリックスを構成すべきガレクチン3は涙液中に放出されて増加していた。またバリア破綻が強い重症ドライアイでは、涙液中のガレクチン3が有意に増加していた。破綻したグライコカリックスは膜型ムチンMUC16の発現回復に寄与するレバミピド点眼液を使用することで、痛みや異物感などの自覚症状改善とともに回復することが確認されている。