
氏名:北岸 宏亮
同志社大学理工学部機能分子・生命化学科 教授
2001年同志社大学工学部機能分子工学科卒業、同志社大学大学院にて加納航治教授の指導の元でhemoCDの最初の合成研究に従事し、2006年に博士(工学)取得。2006年から大阪大学大学院工学研究科林 高史教授の研究室で博士研究員としてヘムタンパク質に関する研究を行い、2008年から同志社大学理工学部助教に就任。2009年から1年間、在外研究員として米国スクリプス研究所(M. G. Finn教授)に留学。2014年同志社大学理工学部准教授、2020年同大学同学部教授。
環状オリゴ糖であるシクロデキストリン(CD)は、水中でさまざまな物質を内包するホスト分子として、基礎研究だけでなく食品添加物などにも一般的に広く利用される物質である。ブドウ糖が環状に連なった構造をもつCDは、そのもの自体でも大変興味深い物性を示すが、有機化学的な手法を用いて、水酸基にさまざまに化学修飾を施すことが可能である。筆者らはCDをO-メチル化および二量体化することで、水中でヘム鉄のモデルとなるポルフィリン誘導体を包接させ、水中および生体内で機能する人工ヘモグロビンhemoCDを創成した。本稿では、このhemoCDの分子デザイン指針および特性から医療応用への挑戦について述べる。
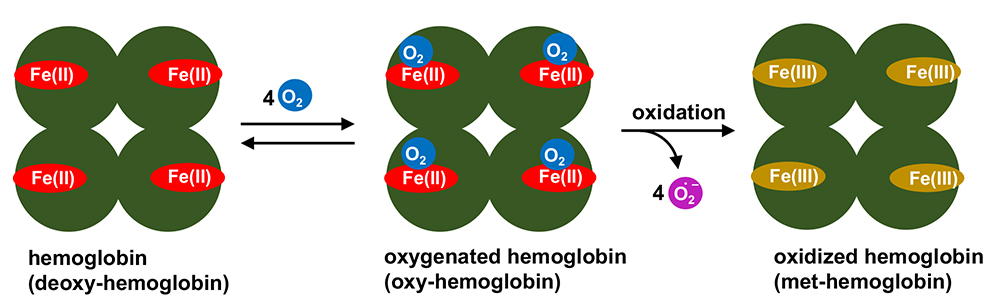
我々の体内にはおよそ4-5 Lほどの血液が存在する。血液にはさまざまな成分が含まれるが、代表的なのは酸素運搬を担う赤血球であろう。赤血球は核を持たない細胞で、細胞膜の内部には高濃度でヘモグロビンが内包されている。ヘモグロビンはヘム鉄と呼ばれる補酵素を4つ含むタンパク質である(図 1)。ヘム鉄の中心に含まれる鉄イオンは、通常は鉄二価(FeII)の状態で保たれており、まわりの酸素(O2)分圧に応じてO2を結合したり離したりする。酸素分圧が高い肺でO2を受け取り、酸素分圧の低い末端組織においてO2を放出することがヘモグロビンの重要な役割である。ここで大切なことは、鉄二価のヘム鉄は、通常は不安定ですぐに鉄三価に酸化されてしまうことである。鉄三価に酸化されてしまったヘモグロビンは、O2を結合することができず、そのため生物学的には不活性状態ということになる。グロビンタンパク質が提供する疎水ポケット(ヘムポケット)によって、ヘム鉄は酸化反応から保護されているのである1。
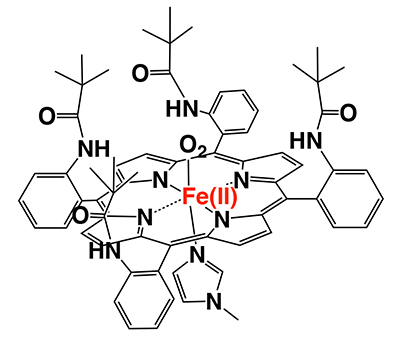
ヘモグロビンのO2結合機能を人工的に模倣しようとする試みが、1970年代から盛んに行われてきた。その分子設計の基本は、ヘム鉄の代わりに合成ポルフィリン鉄錯体を用いることである。酸素錯体を形成するためのポイントは、いかにして鉄二価から鉄三価への酸化反応を防ぐかである。Stanford大学のJ. P. Collmanらは、ポルフィリンの周りに立体障害となる置換基を付与した「ピケットフェンスポルフィリン」(図 2)を合成した2,3。この化合物は、無水トルエン中で酸素をつかまえると、鉄三価に酸化されることなく安定に存在し続けた。これが人工ヘモグロビン研究の幕開けとなった。
ピケットフェンスポルフィリンの開発以降、ヘモグロビンのようにポルフィリン鉄二価錯体を安定につくるためには「立体障害が重要である」という認識が研究者の間で広まった。これにならって数多くのユニークなモデル化合物が合成されてきた3。これらの化合物は、確かに鉄二価錯体が酸化されることなくO2を結合する。しかしながら、酸素を結合した状態を観測するためには厳密に脱水された有機溶媒の環境が必要不可欠であった。少しでも水分が混入すると、O2結合体は分解するのである。これでは水を媒体とする生体で機能するヘモグロビンとは、性質が大きく剥離しているといわざるを得ない。
では、水の存在はどのようにしてO2結合体を不安定かするのであろうか。このことについては、東北大学の四釜教授らによるヘモグロビンおよびミオグロビン(筋肉中に存在するヘモグロビンの単量体ユニット)のO2結合体の自動酸化反応に関する詳細な研究によりメカニズムが推測できる1。ヘムのO2結合体は、水やアニオンのような求核剤によって、有機化学におけるSN2反応と類似のメカニズムで、自動酸化が促進される(図 3)。まわりのタンパク質がない状態では、この反応が瞬時に起こる。一方、グロビンタンパク質がヘム鉄周辺を疎水場で覆うことにとよって、アニオン種が近づけなくなり、この求核攻撃が抑制される。ピケットフェンスポルフィリンに代表される合成人工ヘモグロビン錯体は、立体障害の付与によって自己会合により促進される酸化反応を防いでいるが、水やアニオン種などの小分子により促進される酸化反応を防ぐには至らなかった。この分子設計指針における誤解が水中および生体内で機能する人工ヘモグロビンの構築研究を大きく遅らせていた。

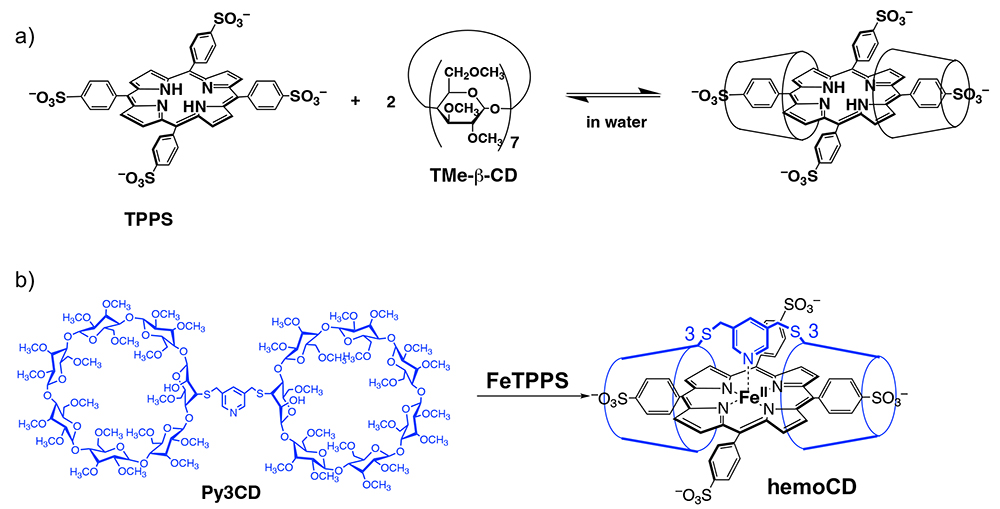
シクロデキストリンの全ての水酸基をO-メチル化した2,3,6-tri-O-methyl-β-cyclodextrin(TMe-β-CD)は、水中でテトラフェニルポルフィリン類を特異的に包接する。KanoらはTMe-β-CDによって包接されたポルフィリンがナノレベルの疎水場に隔離されることを報告し、これがヘモグロビンにおいてヘム鉄が置かれている環境と共通していることを見出した(図 4a)4,5。
その後Kanoおよび筆者(Kitagishi)らは、ふたつのTMe-β-CDをピリジン環によって連結したPy3CDを開発し、これが水中で水溶性ポルフィリン鉄錯体(FeTPPS)と1:1包接錯体を形成することを見出した(図 4b)6,7。さらにPy3CDが作り出すナノ疎水場の効果によりポルフィリン周辺に水がアクセスせず、その結果として鉄二価に還元した状態で安定に酸素を保持することが明らかとなった。このように水中で安定に酸素を結合した完全合成化合物の例は他になく、筆者らはこの錯体を「hemoCD」と名づけて、生体で機能する人工ヘモグロビンとしての応用研究を開始した。
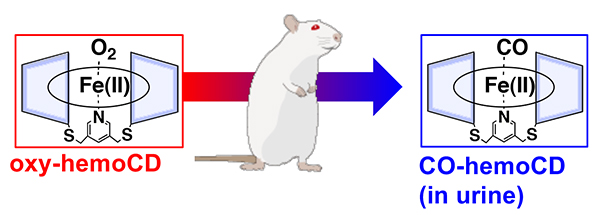
筆者らはhemoCDをヘモグロビンの代わりに酸素を運搬する人工血液の素材として期待し、動物(ラット)への投与実験を開始した。hemoCDの水溶液を静脈から注入した結果、とくに目立った反応などがなく安全性に安心した一方、投与したhemoCDは尿中にすみやかに排泄された。その尿の色からhemoCDは酸化されずに鉄二価状態で排泄されたことがすぐに判別できたが、それにしても鮮やかな赤色だったため、吸収スペクトル等を測定した結果、hemoCDは一酸化炭素(CO)付加体として尿中に排泄されていたことが判明した(図 5)8。
hemoCDの酸素親和性はヘモグロビンと同程度であるが、COに対する親和性はヘモグロビンのガス親和性が高いR状態よりもさらに100倍程度高い。Py3CDが形成するナノ疎水場の影響で、疎水的なガス分子であるCOがキャビティ内に留まりやすくなっていることが原因と考えている。このような高いCO親和性のために、ラット体内に存在する内因性COがhemoCDによって捕捉されて尿中へと除去される現象が見つかった。
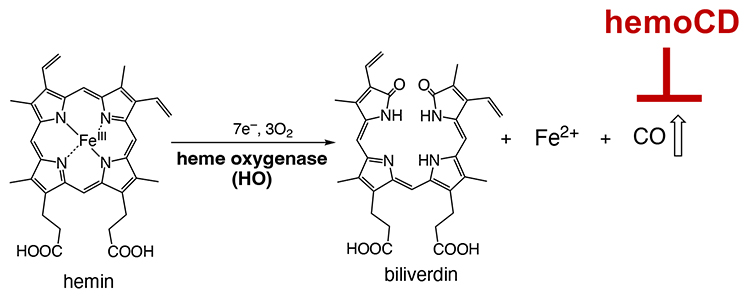
COは有毒ガスとして知られる一方、生体内ではヘム鉄が酵素ヘムオキシゲナーゼによって代謝分解される際に、副生成物として発生する(図 6)。この反応は細胞内で常に起こっているため、COは常に産生され続けていることになる。このような内因性COは生体内シグナル伝達物質として機能することが知られているが、その本質的な機能については未解明な部分が多かった。筆者らはhemoCDを用いれば動物体内のCOを一時的に除去する「擬ノックダウン状態」にできることに着目して、内因性COの生理機能解明を試みた。その結果、(1) 動物体内の内因性COを除去するとすぐに補填するフィードバック機構が存在する9、(2) 細胞内COを除去すると活性酸素(ROS)レベルが上昇する10、(3) 動物体内のCOを除去すると概日リズム調節が一時的に乱れるが20時間後には回復する11など、COの生理機能に関する重要な知見をいくつか発見した。
hemoCDの動物体内への投与は、COを尿中へ追い出すことから、CO中毒の解毒薬として機能することが期待された。このことを確かめるために、筆者らはCO中毒ラットモデルを作成し、体内CO濃度が上昇した状態でhemoCDを投与する実験を開始した。その結果、hemoCD投与群ではCO結合型ヘモグロビンの減少が非投与群と比べて速くなった。さらに脳組織内に残存したCOは酸素換気のみではなかなか除去できないが、hemoCD投与群では有意に低減することがわかった13。hemoCDには脳内送達機能がなく、100%尿中へ排泄されるために、ガス平衡反応により脳内から血液中のhemoCDへと移行したと考えられる。
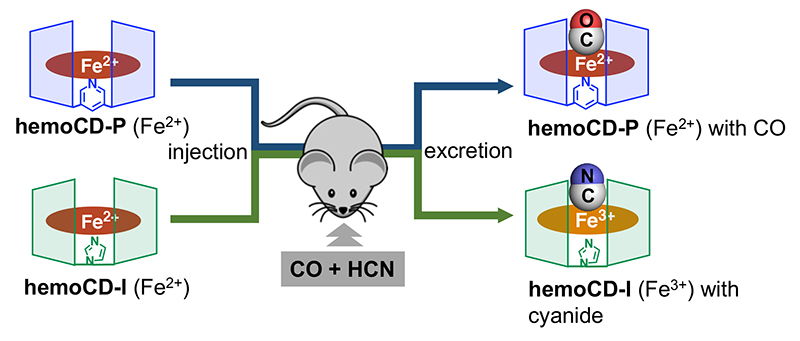
さらにより火災ガス中毒の実態にあわせて、COだけでなくシアン化水素を同時に解毒するシステムhemoCD-Twinsを考案した。このシステムでは、Py3CDをホスト分子とし、従来のCOを強く結合するhemoCD(以下hemoCD-P)だけでなく、イミダゾール基を有するIm3CDをホスト分子にもつhemoCD-Iを同時に投与する。hemoCD-Iは、生体内において自動酸化が速く、鉄二価で投与しても体内で鉄三価に酸化される。COは鉄二価に強く結合する一方で、シアン化物イオンは鉄三価に結合するため、hemoCD-PとhemoCD-Iの同時投与は、COとシアン化水素の同時中毒を快復させる効果がある(図 7)。実際に、COとNaCNを用いて同時中毒としたモデルマウスに対して、hemoCD-Twinsを投与したところコントロール群では全例が1時間以内に死亡(n = 0/18)したのに対し、hemoCD-Twins投与群では生存率85%(n = 11/13)を示した13。またアクリル素材の燃焼により発生した煙を吸わせたマウスに対しても顕著な延命効果および行動回復促進効果が見られ、火災の現場において利用できる救急救命用医薬品としての応用可能性を示すことができた。
筆者らはバイオミメティック化学の観点からシクロデキストリンとポルフィリンを用いて人工ヘモグロビンhemoCDを創成し、その応用研究について取り組んできた。天然のヘモグロビンの機能を真似することを目的でつくられたhemoCDは、ヘモグロビンと同様に水中で酸素を結合した。一方、異なる性質として、COに対する高い親和性や、素早い尿中排泄などの特性を示した。このように天然の機能を真似ることで「似ているけれどもちょっと違う」マテリアルを得ることができ、図らずも内因性COの生理機能解明や火災ガス中毒に対する救急救命用医薬品としての応用が見えてきた。せっかくの研究シーズなので、今後は社会実装を目指して社会に役立つ成果を還元したいと考えている。