
氏名:元内 省
東京理科大学創域理工学部生命生物科学科
2025年3月 東京理科大学創域理工学研究科生命生物科学専攻 博士後期課程修了、博士(理学)取得。2025年~日本学術振興会特別研究員PD (DC2からの資格変更)

氏名:中島 将博
東京理科大学創域理工学部生命生物科学科 准教授
2006年 東京大学 農学生命科学研究科 応用生命工学専攻 博士課程修了、2006年 独立行政法人農業・食品産業技術総合研究機構 食品総合研究所 農研機構特別研究員、2010年 岩手生物工学研究所 研究員、2012年 東京理科大学 理工学部 応用生物科学科 助教、2017年より講師、2020年より准教授(2023年学部学科名称変更)
β-1,2-グルカン関連糖鎖は様々な細菌が宿主免疫回避因子として合成する糖鎖として報告されている。特に根粒菌や植物病原菌が合成するOsmoregulated periplasmic glucans(OPG)は共生や病原性のための必須因子として報告されており、この糖鎖の合成や受容を制御ターゲットとした農薬、医薬品の創生も期待される。しかし、そのような直接のターゲットとなる合成酵素や受容体の多くは未同定であった。筆者らが機能構造解析により発見したOPG合成に関わる新規な酵素ファミリー(GH186)は自然界で報告される主要なOPG3種のうち、2種の合成に関わる鍵酵素群であった。本稿では、これらの解析からユニークな基質認識機構や糖鎖の合成反応、分解反応の新しい分子メカニズムの存在が示されたことを紹介する。
β-1,2-グルカンは自然界において、存在量の点では希少な糖鎖であるが、植物との共生菌や動植物の病原菌との生物間相互作用において様々な重要な機能を担っていることが近年明らかになりつつある1。これらの機能性糖鎖は「Osmoregulated Periplasmic Glucans(OPG)」と総称され、モデル生物である大腸菌をはじめ、様々な細菌によって合成されることが報告されている1。
β-1,2-グルカンに関連するOPGは、構造的に以下の3種類に大別される:
1. 環状β-1,2-グルカン(CβG):β-1,2-グルカンを主鎖とし環状構造を有する
2. OPG1:β-1,6-グルコース側鎖を持つβ-1,2-グルコオリゴ糖
3. OPG2:α-1,6-グリコシド結合を1つ含む環状β-1,2-グルカン
この中で、CβGは歴史的に最も早く研究が始まっており、1940年には植物の根に瘤を形成するアグロバクテリウム(Rhizobium radiobacter)が分泌する多糖としてその存在が示唆され2、後にそれがCβGと同定された3。さらに、CβGの合成酵素として、「cyclic β-1,2-glucan synthase (CGS)」が同定された4。この酵素はこれまでの研究により、glycosyltransferase (GT) family 84、glycoside hydrolase (GH) family 94、GH189 family domainの三つの糖質関連酵素ドメインからなる膜酵素であることが明らかにされている5。
OPG1およびOPG2は、それぞれ大腸菌および植物病原菌 Xanthomonas campestris pv. campestris(Xcc) によって合成される1。前者は、RcsC phosphorelayシステムという細菌の2成分制御系のリガンドとなり、その制御に関わると推察されている1,6。RcsCは鞭毛の構造遺伝子や植物細胞壁分解酵素遺伝子の発現を制御するとされているが、実際これと相関して、OPG1の非合成変異は様々な細菌に、鞭毛形成不全や、植物病原性の喪失(Dickeya dadantiiなど)をもたらすことが報告されている1,6。後者のOPG2も植物に対する病原性に必須の糖鎖であると示されている7。しかし両者ともその合成経路は生化学的にはほとんど不明であった。したがって、そのような合成酵素をターゲットとした創薬の糸口もなかった。筆者らは、OPG関連酵素を標的とする農薬創成などの応用展開や、OPGが宿主に与える影響の理解を深めることを目的とし、未知のOPG合成酵素の同定およびその機能・構造の詳細解明に取り組んだ。
OPG1はOpgHと呼ばれるGT family 2の膜酵素によりβ-1,2-グルカン主鎖の合成が示唆されていたが、β-1,6-グルコース側鎖の付加や主鎖部分の鎖長調節を行うタンパク質については未解明であった1。そこで、遺伝学的知見からOPG1の合成に関わると推定されていた遺伝子opgGおよびそのパラログのopgDの遺伝子産物(それぞれEcOpgG, EcOpgD)に着目し、大腸菌を宿主として生産した組換えタンパク質を用いて機能解析を行った。
多糖に対する基質特異性を調べたところ、両者ともβ-1,2-グルカンを特異的にエンド型で加水分解してβ-1,2-グルコオリゴ糖を生成するβ-1,2-グルカナーゼであることが判明した8。これにより、両者がOPG1の鎖長を調節する新規な酵素群であることが示された。これらは既存のGHファミリーにホモログを持たず、既存のGHとの立体構造の類似性も確認されなかったため、新たにGH186ファミリーとして登録された。また、反応生成物の変旋光を調べる実験により、EcOpgDがアノマー反転型の反応機構にしたがうことを証明した8。
さらにX線結晶構造解析を通じて得られたβ-1,2-グルカンとのミカエリス複合体構造(図 1)に基づき、2個の酸性アミノ酸残基を触媒残基として同定し、以下のようなユニークな反応機構を提唱した(図 2)8:
・一般酸触媒残基がグリコシド結合の切断に必要なプロトンを供与し、一般塩基触媒残基が切断位置のグルコースユニットのアノマー位を求核攻撃する求核水のプロトンを水分子2個と基質のヒドロキシ基1個を介して引き抜くことで加水分解が進行する(図 1右、図 2)。
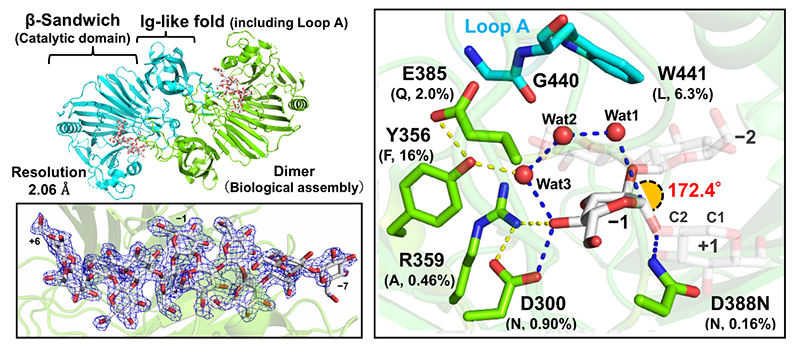
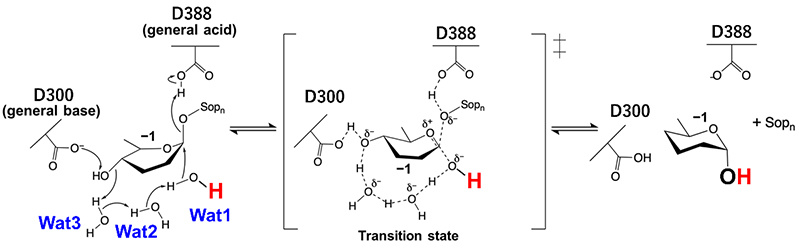
特に、一般塩基触媒残基側では水分子同士のプロトンリレー(Grotthuss型プロトンリレー、GPR)が特徴的である。このGPRは一般的に酵素反応に関係なく水溶媒中でランダムに起こるとされているため、そのランダム性をいかに制御するかが加水分解効率の高さに直結すると考えられる。EcOpgDでは“Loop A”と名付けた構造領域によってGPR経路の溶媒からの隔離が実現されており (図 3左)、これは、EcOpgDが13.9 U/mg(基質濃度、β-1,2-グルカン8 mg/mL)という高い反応効率(比活性)を示すことと合致している8。一方、EcOpgGではGPR経路が部分的に溶媒に開かれており(図 3右)、実際にEcOpgGが同基質濃度でEcOpgDに対して100分の1程度の比活性しか示さない8。
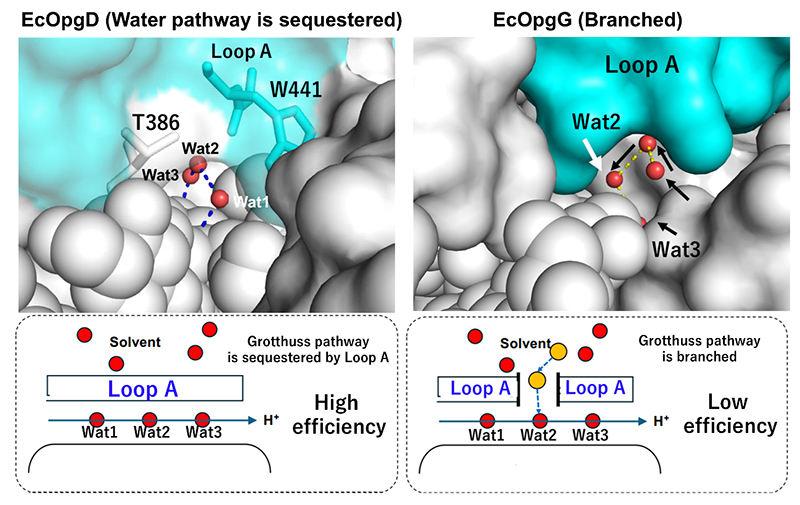
上記ではLoop Aの構造の違いが加水分解効率の違いを生み出していたが、このLoop AはGPR経路だけでなく、求核種の固定にも関与している。しかし、GH186の中でもEcOpgDやEcOpgGのLoop Aのアミノ酸配列の保存範囲は系統樹上では限られている8。大半のホモログはEcOpgDより短いLoop Aを有していたため、反応機構レベルの違いがホモログによっては生じている可能性が推察された。植物病原菌 Xcc のOPG合成に関する情報を見てみると、XccにはOPG1の合成に関する報告がなく、OPG2を合成することが報告されている1。それにも関わらず、XccはGH186ホモログを有していることが分かった。このことから、筆者らはXcc由来の GH186ホモログ(XccOpgD)が環状β-1,2-グルカンを合成する可能性を考え、XccOpgDの機能解析を行うこととした。
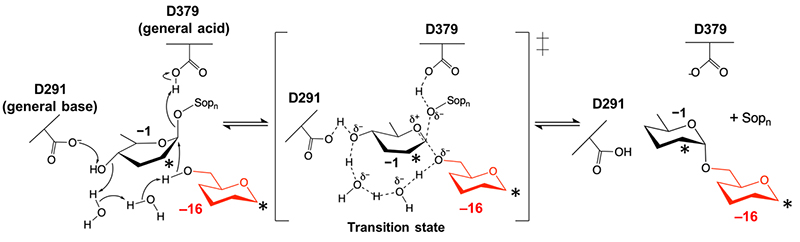
大腸菌を宿主として組換えXccOpgDを生産し、その精製酵素を用いてβ-1,2-グルカンを基質とした反応を行ったところ、特異的な重合度を有すると考えられる生成物が検出された。この産物を質量分析およびNMRで解析して同定を行った結果、XccOpgDは重合度16のOPG2を特異的に合成する酵素と判明した10。すなわち、XccOpgDはβ-1,2-グルカン分子内でβ-1,2-結合を切断してα-1,6-結合で転移するtransglycosylationを触媒すると考えられた。しかし、一般的にtransglycosylationはアノマー保持型GHによる反応であり、XccOgpDで示唆されたアノマー反転型transglycosylationは一部のGH91酵素のみで報告されている特殊な反応である11。しかも、立体構造に基づいてその反応機構が提唱された例はなかった。そこで、筆者らはその反応機構を立体構造に基づいて示すことを目指してX線結晶構造解析を行った。
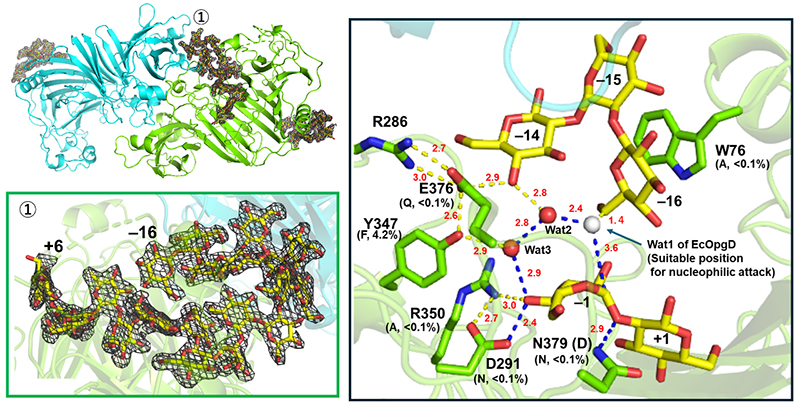
XccOpgDのD379Nを用いて作成したligand-freeの結晶への基質(β-1,2-グルカン)のソーキングにより、2.25 Åの分解能でミカエリス複合体構造の取得に成功した(図 4)。この構造では、EcOpgDで観察された求核水の電子密度が観察されず、代わりにサブサイト−16のグルコースの6位ヒドロキシ基がサブサイト−1のアノマー位近傍に存在していた(図 4右)10。この配置は、両者間でのα-1,6-グリコシド結合の形成を強く支持するものであり、アノマー反転型transglycosylation反応のメカニズムを構造的に示した初の例となった(図 5)10。
本研究で明らかになった合成酵素の存在とその詳細な反応メカニズムは、双方がβ-1,2-グルカンという比較的未開拓の分野の基礎と応用の展開を加速するものとなるだろう。たとえば、筆者らがこの研究の先で以下のような展開を展望している。
新規農薬創成:GH186の阻害剤を今回のミカエリス複合体構造をベースとして設計し、病原性阻害剤を創生する。
OPGの自然界での生理活性メカニズムの解明:合成酵素の発見により酵素法による大量合成が可能になったOPG2を用いて、植物への作用メカニズムあるいは、OPG2を介した細菌同士のコミュニケーションの担い手となるタンパク質を探索することができる。
細菌の表現型に関する推察:将来的にはOPG2の合成酵素遺伝子の分布から、生活環があまり明らかになっていない細菌の生存戦略を微生物学的に解明することができるかもしれない。
このように、重要性が示唆されながらも未知の部分が多いβ-1,2-グルカンという糖鎖は、糖質科学・微生物学・植物病理学・創薬の各分野を横断した研究の展開が期待され、今後の学術と産業のさらなる連携も期待される。