
氏名:Warren Knudson
Warren Knudsonはイリノイ大学Urbana Champaign校のDr. Ed Conradのラボでの博士課程研究で結合組織に興味を持つようになった。彼の学位論文はアグリカンのグリコサミノグリカン鎖にコンドロイチン4硫酸と6硫酸が同一の鎖上に存在することを示すものであった。1981年、彼はボストンTufts大学のDr. Bryan Tooleのラボにポスドクとして移った。そこで、彼はヒアルロン酸に興味を持ち始め、後の妻であるDr. Cheryl B. Anderson に出会うこととなった。そこで彼は癌組織でのヒアルロン酸の蓄積と癌細胞表面に存在するヒアルロン酸と結合するレセプターCD44に焦点を当てた。1985年、彼はシカゴのRush医科大学の生化学講座の部長であるKlaus Kuettner教授の招請により、そこの結合組織グループに参加した。彼の研究は癌結合組織に沿って続けられ、癌細胞のヒアルロン酸レセプターと関節軟骨細胞表面に存在するそれとの間の関連も浮かんできた。現在、生化学教室のAssociate Professorとして彼のラボの関心はヒアルロン酸の細胞内とりこみと分解における軟骨細胞CD44の役割に集中している。

氏名:Cheryl B. Knudson
Cheryl B. Knudsonはカリフォルニア州ClaremontのPomona大学で学士号を、Southern California大学で博士号を授与された。彼女の学位論文研究で故Dr. Stephen Meierとともに頭蓋神経冠細胞の体節移動とその分布から中胚葉パターンへの関与を示した。彼女はまた、神経冠細胞移動におけるヒアルロン酸の役割についても研究し、このことが彼女をボストンTufts大学のDr. Bryan Tooleのラボでポスドクとして研究するきっかけとなった。Toole教授とともに彼女は肢芽発生におけるヒアルロン酸−細胞相互作用の役割に関して研究し、軟骨形成過程で発現されるヒアルロン酸レセプター活性を報告した。1985年、彼女はシカゴのRush医科大学の生化学講座に移り、現在は生化学教室のAssociate Professorである。この教室はKlaus Kuettner教授の指導のもと、結合組織に関するテーマを中心に展開している。彼女は発生過程における細胞−マトリックス相互作用の研究を続けているが、彼女の興味には軟骨の恒常性維持、加齢、疾病におけるヒアルロン酸-細胞相互作用も含まれる。
ヒアルロン酸はほとんどすべての組織の細胞外基質で、細胞の挙動に直接影響するいくつかの機能を含む多岐にわたった機能を有する a。どのように細胞が細胞外マトリックスを構成し、どのようにそのマトリックスがフィードバックし、細胞の代謝に影響するのかは、細胞表面のマトリックスレセプターを介した特異的細胞−マトリックス相互作用が関与している。これまでに細胞膜に局在するいくつかのレセプター(別名、ヒアルロン酸結合タンパク質)、CD44、RHAMM b、IVd4 aそして肝内皮細胞クリアランスレセプター(LEC レセプター)が同定されてきた。多くの研究室の予備的研究から、このリストは将来増えるであろうことが示されている。それにもかかわらず、最も一般的なヒアルロン酸レセプターで、最も今日研究が進んでいるのがCD44である。CD44という現在の名前はInternational Workshop on Human Leucocyte Differentiation Antigensで決められる一般的なリンパ球抗原群(Clusters of Differentiation, CD)またはそのファミリーのひとつと同一分子であることからつけられている。しかしながら、CD44と命名されるまでに、この同じタンパク質にPgp-1 (phagocytic glycoprotein-1)、In [Lu]-related p80、Hermes antigen、HUTCH-1、gp90、gp85、H-CAM、ECMRIII (extracellular matrix receptor type III)などという名前が「ヒアルロン酸レセプター」という一般的な機能的名前と同様につけられてきた。最後の名前はCD44がその構造、名前、一次構造の同一性が決定されるまでの長い間も、細胞膜にあってヒアルロン酸に結合するタンパクとしての活性と特性がある事が知られていたことを物語っている。
a 本シリーズのTooleの総説を参照
b 本シリーズのTurleyの総説を参照
細胞−細胞凝集の多くの初期の研究で、ヒアルロン酸が細胞同士を架橋する仲介をすることが見つかった。このような架橋があることによって膜上にはヒアルロン酸結合部位が存在することが示唆された。個々のヒアルロン酸結合部位を占めるヒアルロン酸の小断片、すなわち細胞間を架橋するには小さすぎるヒアルロン酸を意味するが、このヒアルロン酸小断片は細胞凝集を阻害した。過剰の高分子ヒアルロン酸もまた、レセプターを飽和することにより、この凝集を阻害した。ヒアルロン酸は異種細胞と同様、同種細胞同士の凝集を仲介したが、これは両細胞にヒアルロン酸レセプター活性が発現されていることを示している。たとえば、正常リンパ球細胞の同種間の凝集はリンパ腫細胞とマクロファージ、またはB細胞と骨髄ストローマ細胞の凝集と同様に低濃度のヒアルロン酸によって引き起こされた。
1970年代後半、SV3T3細胞の約85kDaの膜タンパク質が、細胞表面上でヒアルロン酸との結合を介して、隣同士の細胞を架橋(凝集)する最も可能性のある分子として同定された1。この膜タンパク質/レセプターは細胞上でヒアルロン酸に対し、高い結合常数(Kdは10-9 M)を示した。膜を可溶化すると個々のレセプターの結合親和性が明らかに低いことから、この強い結合親和性は複数のレセプターとの多価の相互作用によるものであることが知られた。この同じ細胞は、Bmaxが5-10mg hyaluronan bound 106 cellsのヒアルロン酸(〜1.3x106 Dal)の飽和的結合性を示した。この結合活性には他にもっと特徴的な性質があった。それはカルシウム非依存的で、フォルムアルデヒドやグルタルアルデヒドなどの試薬による穏和な固定に安定で、イオン強度を上げると結合親和性が上昇した1。この85kDaタンパク質へのヒアルロン酸の結合は、最も小さいサイズで6糖のヒアルロン酸オリゴ糖によって効率的に阻害された。生きた細胞では、コンドロイチン硫酸、または、ヘパラン硫酸などの他のグリコサミノグリカンは結合という点ではヒアルロン酸とほとんど拮抗する能力を示さなかった。しかしながら、いったん界面活性剤で可溶化すると、ヒアルロン酸レセプターはその結合特異性を失い、コンドロイチン硫酸はヒアルロン酸結合に拮抗した。面白いことに、コンドロイチン硫酸の非硫酸化体であるコンドロイチンは弱くではあるが、生きた細胞上でのヒアルロン酸結合の拮抗分子として有効に働く2。
これらすべての特性は、当初はSV3T3や内皮細胞などの齧歯類の細胞株を用いて特定された。しかしながら、後にいろいろな組織や種由来の細胞でほとんど同じヒアルロン酸レセプターの性質が示された。これらにはいくつかの高浸潤性ヒト膀胱癌細胞に加え、ニワトリ胚肢芽軟骨細胞、成ウシまたはヒト関節軟骨細胞、ハムスター肺胞マクロファージが含まれる。それにもかかわらず、ヒアルロン酸レセプターの単一分子までの精製への試みは困難を極めた。Underhillら3がついにヒアルロン酸が仲介する細胞−細胞凝集をブロックできる抗体(K-3)を同定し、それは内皮細胞への放射能標識ヒアルロン酸の結合をもブロックした。K-3抗体が85kDaの内皮細胞膜タンパク質と反応したことは驚きではなかった。しかしながら、後の実験により、偶然にもこの同じ抗体が、CD44と名付けられた、すでに特性も一次構造も明確な85kDaのリンパ球ホーミングレセプターと反応することが証明された。こうしてたった1つの実験により身元不明のヒアルロン酸レセプターの実体が明らかとなったのである。それ以降は、説明の必要がないだろう。
実際には、だいたいこれと時期を同じくして他の研究者たちからもCD44がヒアルロン酸レセプターらしいということがすでに明らかになってきていた。一次構造解析からCD44ホーミングレセプターは疎水的膜貫通部と軟骨細胞外基質のヒアルロン酸結合タンパク質であるリンクタンパクに〜40%の相同性をもつ細胞外ドメインをもつ膜貫通糖タンパク質であることが予測された。1989年3月24日号のCellに二つの別々の研究グループがリンクタンパク質、アグリカンとリンパ球ホーミングレセプターのアミノ末端側の細胞外ドメインの間の一構造上の相同性を報告した。このように、この興味深い相関関係はヒアルロン酸−細胞結合の生物学的活性に興味を持つ研究者とCD44をリンパ球ホーミングレセプターとして研究する研究者を結びつけ、そのすべてはCD44が細胞表面の重要なヒアルロン酸レセプターであるという報告に帰着した。
その後の研究でヒアルロン酸結合に関与するタンパク質がCD44であることが確認された。多くの細胞を使ったシステムでヒアルロン酸への結合は抗CD44特異的モノクローン抗体によってブロックされ、リンパ球などの細胞はヒアルロン酸をコートした表面に結合することが示された。
われわれの研究ではCOS-7細胞にヒトpCD44を含むコンストラクトを遺伝子導入すると、細胞はヒアルロン酸に結合する能力を獲得し、外からヒアルロン酸とアグリカンを加えると細胞表層マトリックスまたは"コート"をまとうようになる。さらに、これらの活性は穏和なグルタルアルデヒド固定に安定で、マトリックス形成はヒアルロン酸6糖によって阻害された。われわれが外から加えたヒアルロン酸およびアグリカンによってコートを形成する事ができることを調べた軟骨から癌細胞にいたるまでのすべての細胞も、高いレベルのCD44を発現していた。このように、CD44は観察されるヒアルロン酸結合活性のすべてを担っているのではないかもしれないが、細胞表面でヒアルロン酸を結合する主要な貢献者であることは疑いない。
A. タンパク質ドメイン構造
CD44は1回膜貫通型糖タンパク質で、4つの機能的ドメインからなる。(Fig. 1)外側の細胞外ドメインは主にヒアルロン酸結合に関与する部位である。内側の細胞外ドメインはCD44 mRNAが主に選択的スプライシングを受ける部位で、その結果CD44の多くのアイソフォームが合成される。CD44の膜貫通ドメインはまさしく典型的な1回膜貫通型糖タンパク質の性質を示す。しかしながら、界面活性剤可溶化ヒアルロン酸レセプターを用いた研究や、部位特異的変異導入法による研究から、この部位に相互作用する脂質や修飾膜タンパク質が細胞骨格とCD44の相互作用やヒアルロン酸結合をも調節することが示された。ほとんどのCD44のアイソフォームには70アミノ酸の細胞内ドメイン、または“しっぽ”が存在する。この細胞内ドメインは細胞内シグナル伝達に関わるとともに細胞骨格タンパク質と相互作用する能力があることを示すタンパク質モチーフをもっている。
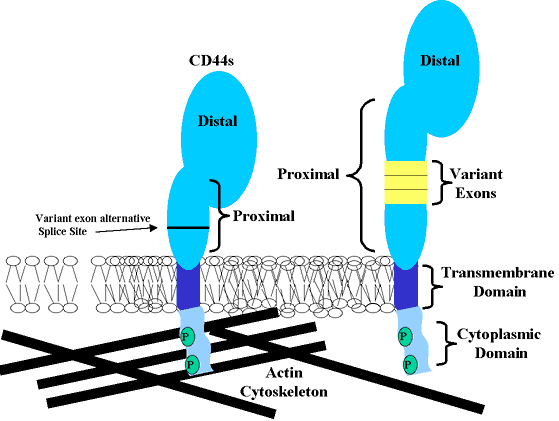
Fig. 1 CD44のタンパク質ドメイン
CD44の基本的な4つのタンパク質ドメインを図に示す。(1)外側の細胞外ドメイン(リンクタンパク質相同ドメイン)、(2)内側の細胞外ドメイン、(3)膜貫通ドメイン、(4)細胞内ドメイン。内側の細胞外ドメインが長くなったCD44のアイソフォームも示した(3エキソン分を黄色で示す)。これらのタンパク質の伸長部分はCD44の最も一般的なアイソフォームであるCD44sには存在しない。
B. CD44遺伝子/mRNA
CD44の遺伝子は20のエキソンからなる(初期の文献には19エキソンであるが、エキソン6aと6bはエキソン6と7に再分類され、全部で20エキソンとなった)(Fig. 2)。ヒト第11染色体の短腕上にCD44をコードする単一遺伝子が存在し、20エキソンのうち12の選択的スプライシングからいくつものmRNA転写産物が同定されている。標準的で最も広範に存在するCD44(CD44sと名付けられている)はエキソン1-5、16-18、と20(Fig.2で濃い青で示されるエキソン)によってコードされるタンパク質からなる。この型はまた造血細胞で主要な型なので、CD44sはまたCD44Hとしても知られている。CD44sは細胞外ドメイン(エキソン1-5と16)、高度に保存された膜貫通ドメイン(エキソン18)と細胞質ドメイン(エキソン20)からなる(Fig.1)。ヒトCD44sのmRNAの1482bpの読み枠は〜37kDaのポリペプチド鎖の翻訳産物となる。N結合型とO結合型糖鎖の翻訳後修飾により最終のCD44タンパク質はSDS-PAGEで見積ると〜85kDaの分子量になる。
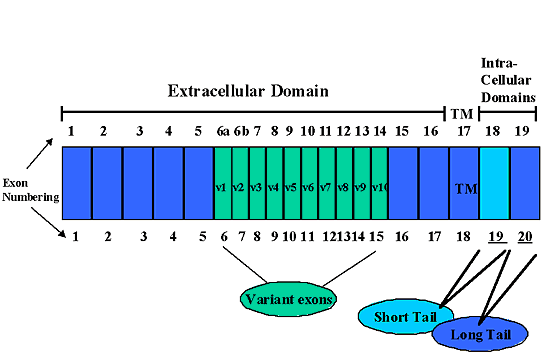
Fig. 2 CD44エキソンの選択的スプライシング
CD44遺伝子をコードするエキソンを番号を付け図に示す。最上段の数字はCD44が19エキソンによりコードされるとする番号表記法に従って示す。下段はCD44が20エキソンよりなるとする現在の番号表記法に従って示す。最も一般的なCD44のアイソフォームであるCD44sをコードするエキソンは濃青で示す。青緑色で示されるエキソンは可変エキソンで選択的スプライシングによって広範にわたる再構成を受けCD44の多数のアイソフォームを生み出す。選択的スプライシングはまた、CD44の細胞内ドメインをコードするエキソンにも起こるらしい。エキソン19(水色)またはエキソン20(濃青)は利用されると細胞内ドメインが短いCD44と完全長のCD44のアイソフォームをそれぞれ生み出す。
CD44のいくつものアイソフォームは、その大きさが80〜250kDaにおよび、それらはCD44の細胞外ドメインのいわゆる"可変"エキソンの選択的スプライシングによりおきる(Fig. 1、Fig. 2)。v1- v10と名付けられた可変エキソンであるエキソン6-15の選択的スプライシングにより、発現されたレセプターは大きくなり、それによって多分、機能のいくつかが調節されるのであろう。たとえば、CD44 v 6+7を発現する遺伝子導入株はヒアルロン酸と同様コンドロイチン硫酸に結合するようになる。これら可変アイソフォームの命名はまだ標準化されていない。このようにある研究の特別な領域では可変アイソフォームはエピカン、記述的な名前であるgp116(内皮細胞で見つかったCD44v10)、可変ナンバーが表記された名前であるCD44vn、この場合、"n"はたとえばCD44v7-9などのように可変エキソンが挿入されていることに相当するが、これらのようにそれぞれの使用者になじんだ名前を持っている。CD44v3(エピカン)のようにCD44の可変アイソフォームのいくつかは、コンドロイチン硫酸またはヘパラン硫酸グリコサミノグリカン鎖を受容するセリン/グリシン配列をもちCD44をプロテオグリカンへと変換する(Fig. 3)。グリコサミノグリカン合成が開始される可能性のあるセリン/グリシン配列は他にもCD44HとCD44v10にもあるが、エキソン8(variantエキソン3)の配列にのみGAG鎖が見つかっている。
CD44のもう一つの選択的スプライシングは細胞内ドメインに存在する。エキソン19または20はともに選択的スプライシングにより異なる発現をし、分子の細胞内の"しっぽ"に2種の変異体を生み出す(Fig. 2)。事実、エキソン19の5’末端はエキソン20と1塩基対のみの違いがあるが、この違いによりポリペプチド鎖合成の終止コドンが出現し、細胞内ドメインが4アミノ酸に切りつめられた分子が発現される(Fig. 3)。このように、エキソン20の代わりにエキソン19を含む選択的スプライシングを受けたmRNAは”しっぽの短い”CD44タンパク質を生み出すのである。このCD44アイソフォームは細胞内シグナル伝達モチーフと細胞内骨格系分子との相互作用に必要なタンパク質ドメインを欠いていることから、その役割に関していろいろなことが考えられる。ほとんどの細胞でエキソン19の発現は比較的まれであるが、われわれは最近CD44exon19のmRNA転写産物がCD44s(CD44exon20)の転写産物も同時にヒト軟骨細胞に発現されていることを見いだした。
CD44遺伝子の発現調節に関しての情報はほとんど得られていない。CD44はEGF、TGFbetaそして骨形成タンパク質-1(BMP-7)といった増殖因子と同様に、IL-1のような炎症サイトカインによっても転写レベルが上昇する。IL-1はCD44のmRNAとタンパク発現のレベルを軟骨細胞と血管平滑筋細胞の両方において上昇させる。軟骨細胞では、CD44の発現上昇はヒアルロン酸の結合、取り込み、分解能力を上昇させる。平滑筋細胞ではIL-1はCD44を増加させ、細胞のヒアルロン酸結合能を増大させた。このCD44の発現の増加は、アテローム性動脈硬化症で見られるヒアルロン酸の増加とあわせて病変の進行に関係しているのかもしれない。c EGFは線維芽細胞、いくつかの癌細胞、折り重なって層構造を作りつつある上皮細胞においてCD44の発現を上昇させる。それゆえに、線維芽細胞のCD44遺伝子のRNA転写開始点から450 bp上流に120-bp EGF 応答要素/転写因子が結合すると予測される部位が同定されたことは興味深い。この応答領域は同様に他の細胞でも見つかるであろう。
c 本シリーズのWight の総説を参照
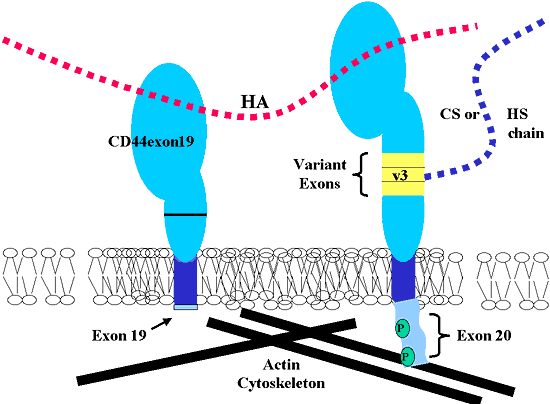
Fig. 3 選択的スプライシングをうけた2種のCD44アイソフォームの例
エキソン19を含むCD44(CD44exon19)を左に示す。エキソン19の中の終止コドンの導入により、細胞質内が4アミノ酸だけの細胞質内ドメインの短縮した分子を生じる。可変エキソン3 (v3)として知られるエキソン8を含む、3つのエキソンの選択的スプライシングにより膜に近い細胞外ドメインの中にタンパク質の伸長があるCD44を右に示す。v3ドメイン付加によりヘパラン硫酸、または、コンドロイチン硫酸側鎖の付加が起こる。
C. 翻訳後修飾
他の膜貫通型糖タンパク質レセプターと同様、リン酸化、グリコシル化、あるCD44アイソフォームではグリコサミノグリカン鎖の付加など、CD44は広範にわたる翻訳後修飾を受ける。これらのすべての修飾はヒアルロン酸結合能、または、他のCD44の機能を"修飾"しているのではないかと活発に研究されている。ここで"修飾"という単語を用いるのは、これらの翻訳後修飾の中でCD44の活性を本当の意味で"媒介または調節"するものがないからである。たとえば、ある研究者はCD44のグリコシル化はヒアルロン酸結合に先立って必要であると主張しているが、他の研究者はグリコシル化されていないリコンビナントCD44でさえヒアルロン酸に結合することを見いだした。CD44の細胞質内末端のセリン/スレオニン残基のリン酸化/脱リン酸化は、CD44の”外から中へ”のシグナル伝達と同様に”中から外へ”CD44の機能を調節する役目があることを示唆するダイナミックな修飾パターンを示す。リン酸化はまた、CD44をアクチン細胞骨格系につなぎ止める過程で、つないだりはなしたりするのに影響を与えることが示された。事実、いくつかの細胞でCD44には2種類のプールがある。1つは穏和な界面活性剤で抽出される画分であり、もう一方は、おそらくCD44が細胞内骨格に堅く結合しているためと思われるが、可溶化により強力な条件を必要とする画分である。リン酸化はこれらの2種のCD44のプールの間の切り替えをコントロールしていて、それがまた、CD44がヒアルロン酸に結合する能力を調整しているのかもしれない。
D. ヒアルロン酸結合に必要な分子相互作用
ヒアルロン酸がCD44に結合するのに関与する正確な部位と分子間相互作用を明らかにするためにいくつかの試みが行われてきた。前述のように、早くからCD44がリンクタンパク質とアグリカンのBループ構造に高い相同性を持つことが知られていた。しかしながら、CD44はリンクタンパク質やアグリカンとは異なり、縦列繰り返し構造を半分しか持たない。また、ヒアルロン酸のCD44への結合はたいてい6糖からなるヒアルロン酸オリゴ糖で十分に阻害がかかり、CD44の活性をもつ結合部位は10糖からなるヒアルロン酸オリゴ糖が結合するリンクタンパク質やアグリカンに比べ小さいことが示唆された。 Peachらは5リンクタンパク質に相同性のある領域の外側の部位と内側の部位にある2カ所の塩基性アミノ酸のクラスターについて詳細に検討した(Fig. 4)。この研究から二つの重要な発見が得られた。ひとつは、予測の通りリンクタンパク質に相同性のある外側の部位の塩基性アミノ酸はCD44のヒアルロン酸の結合に必須のようである。特に41残基目のアルギニンは結合に必須であると見なされた。しかしながら、彼らのデータは一方の内側の塩基性アミノ酸のクラスターもまた、必要であることを示した(Fig. 4)。両ドメインへの変異導入は明らかにCD44のヒアルロン酸への結合を減少させた。外側のリンクタンパク質に相同性を持つドメインのみを持つように欠失させた(すなわち内側のドメインがない)CD44−免疫グロブリン融合タンパク質は、ヒアルロン酸をコートしたプレートへの結合活性は低かった。さらに、クラスターになっている4つのアルギニン残基のどれかに部位特異的変異を導入すると、ヒアルロン酸結合活性は減少した。彼らはこの二つのドメインは何らかの方法で協調的にヒアルロン酸に結合するらしいと主張した。また、彼らの研究によって抗CD44モノクローン抗体、I M7はヒアルロン酸に結合するのに必要な内側のドメインの近傍のエピトープを認識することが示された。この報告は、軟骨細胞に結合したIM7は、CD44のリンクタンパク質相同ドメインの外側に結合するにも関わらず、ヒアルロン酸の相互作用(CD44が除かれることなく)をブロックできるというわれわれの見解と一致する。
さらに最近の研究では、CD44の3次元構造モデルがCD 44とTSG-6(TNF alpha-stimulated glycoprotein-6)の相同性に基づき作成された。TSG-6はCD44のようにリンクタンパク質に相同性をもつスーパーファミリーのもう一つのメンバーである。しかしながら、TSG-6の場合、そのリンクタンパク質ドメインの3次元溶液構造が決定され、ラットのマンノース結合タンパク質にみられるようなカルシウム依存性レクチン折り畳み構造に似ていることが示された。Bajorathら6はArg41を開始点とし、この推測される折り畳み構造の部位をTSGのそれにあてはめ、保存性および非保存性のアミノ酸点変異を作成しその影響を調べた。この研究から、CD44のリンクタンパク質に相同性を持つドメインの大きなタンパク質分子表面領域がヒアルロン酸結合に関与するようであろうことが明らかになった。Fig. 4に示すように特定のアミノ酸クラスター(Tyr-42, Arg-78, Tyr-79)はすでに述べたArg-41とともにヒアルロン酸結合に決定的な領域を形成すると考えられる。この領域の変異はCD44のヒアルロン酸結合能を阻害し、ヒアルロン酸結合をブロックする抗CD44モノクローン抗体がCD44に結合できなくなる。予測モデル構造はこれらの4つのアミノ酸のすべてはCD44タンパク質の表面の縁に沿って存在する。この同じ研究からTyr-42のみがCD44とTSG-6の間で保存されることがわかった。このように、その類似性にも関わらずリンクタンパク質スーパーファミリーのなかのタンパク質−糖の相互作用の詳細は明らかに違いがあると考えられた。この発見から、ヒアルロン酸のCD44への結合とTSG-6、リンクタンパク質、またはアグリカンへの結合の結合親和性、特異性、競争阻害をするオリゴ糖の大きさについての違いが説明できるかもしれない d。
d 1999年にでる本シリーズのDayの総説を参照。
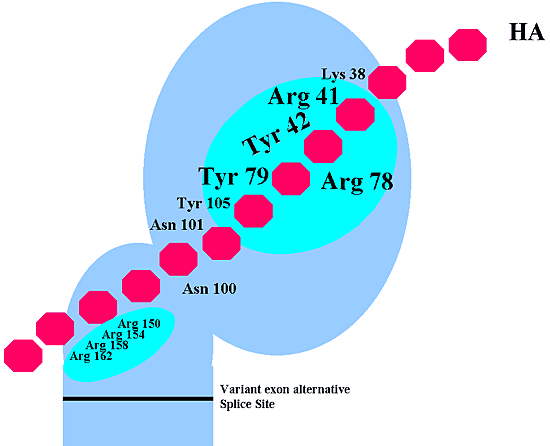
Fig. 4 CD44の予測されるヒアルロン酸結合ドメイン
外側の細胞外ドメイン(リンクタンパク質に相同性を持つ)と内側の細胞外ドメイン(可変エキソンの選択的スプライシングを受ける部位よりは外側)の中の予測される二つのヒアルロン酸結合ドメインを明紫色で示す。ヒアルロン酸との直接の結合に関わると思われるアミノ酸を示す。外側のリンクタンパク質相同ドメインの主要なヒアルロン酸結合部位で4つの重要なアミノ酸 (Arg-41,Tyr-42, Arg-78, Tyr-79)を大活字で強調してある。この図の校閲に関してDr. A. Dayに特に感謝する。
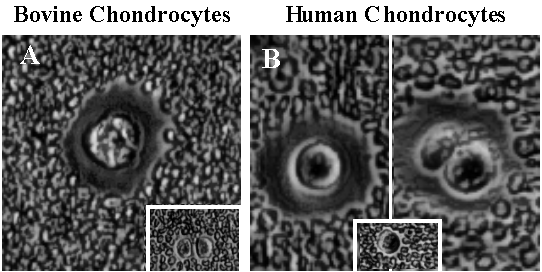
Fig. 5 CD44によってつなぎ止められた軟骨細胞の細胞結合性マトリックス
ウシとヒト正常関節軟骨細胞を軟骨より単離後、アルギン酸ビーズ中で5日間初代培養し、クエン酸ナトリウム処理により単細胞として分散させた。
クエン酸塩はカルシウムイオン依存的なアルギン酸マトリックスの脱重合を引き起こす。細胞は一晩、単層培養し培養皿に接着させた。そして、培養上清を除いた後、固定したウマ赤血球の懸濁液を加えた。粒子を沈殿させるために15分間放置後、Varel光学系を用いた位相差顕微鏡により観察を行った。写真5Aと5Bに示すようにウシ、ヒトどちらの関節軟骨細胞にも大きな細胞表層のマトリックスが示されている。写真5Bの右半分でヒト軟骨細胞に見られるように、固まりを作った細胞は細胞に結合したマトリックスを共有している。ウシとヒト軟骨細胞を粒子排除検定で可視化する前にヒアルロン酸6糖オリゴ糖で2時間処理したものを写真5Aと5Bの挿入図にそれぞれ示す。これらの写真に関しては我々の研究室の西田佳弘博士に特に感謝する。
B. CD44が介する細胞とマトリックスの間の情報伝達
CD44が大きな細胞内ドメインを持つ膜貫通レセプターであるという事実から、自ずと、CD44は細胞−マトリックスの相互作用を細胞内に伝達し(外から内へのシグナル伝達)、細胞内のシグナルに反応してマトリックスを変化させる(内から外へのシグナル伝達)事が考えられる。CD44の細胞内ドメインはリン酸化によって変化を受け、裏打ちしている細胞骨格との相互作用、そして可能性として、隣接するCD44分子との相互作用を変化させる。しかしながら、この領域から得る結果とそれらから発展したモデルは混乱しがちでしばしば矛盾している。ある研究では、細胞質ドメインの70アミノ酸すべての欠失によって、ヒアルロン酸に全く結合できなくなった(
7のLesleyの章を参照)。ところが、別の研究では、細胞内ドメインを欠失したCD44を発現しているリンパ腫細胞はヒアルロン酸に結合し続けた。また別の研究ではCD44の細胞質ドメインにあるアンキリン結合モチーフがヒアルロン酸結合にどれほど必要であるかを詳細に検討した10。他方、アンキリン結合ドメインを欠いた変異CD44分子はヒアルロン酸結合能には変化を示さなかった9。おそらく、いくつかの変異はCD44がヒアルロン酸に結合する能力に直接影響するというよりも、CD44の機能的な使い方に変化を及ぼすのかもしれない。
推測ではあるが、CD44の情報伝達について理解するひとつの手がかりとして、個々のレセプターの事象に対して、多価のCD44の相互作用の機能を考えることがあげられる。インスリンレセプターのような伝統的レセプターでは、単一分子のリガンドが単一のレセプターに結合すると構造変化が起きてシグナルを細胞内に伝達する。CD44でもこのようなことがあるかもしれないし、またないかもしれない。このリガンドはもちろんヒアルロン酸である。ヒアルロン酸のCD44への結合は、その長さに沿っていくつもの結合部位を持ち、レセプターのクラスター化、または、少なくとも、膜でこれらレセプターの構造的配列を作り出すであろう。CD44は裏打ちする細胞内骨格と結合しているので、細胞外でCD44が配列化されると、対になって細胞内も組織化されるはずである。引き続き起こる下流の反応として、細胞内骨格の組織化に変化が起きると、いろいろな第2のシグナル伝達中間体(たとえば、カテニン、FAK、Src、p56、p158、Rho、PKC、IP3)の解離や隔離を起こすことが知られている。そしてそれが細胞の代謝の変化につながるのである。この過程はまた、逆にも働く。すなわち、細胞骨格の組織化の崩壊は細胞膜のCD44を分散させ、それがまた、CD44が細胞外のヒアルロン酸を、結合、または別な方法で組織化する能力を調節するのである。このように、ホルモンレセプターのモデルに比べるとはなはだ厄介ではあるが、このモデルは細胞−マトリックス情報伝達にとって好都合である。このようなモデルに前例があるだろうか?
いくつかの報告からCD44には3種の機能的な分類がみられることが判った。ヒアルロン酸結合に関して、結合しないCD44、活性化されないため結合しないCD44と恒常的に活性化されているCD44である。
何がCD44のこれらの3つのカテゴリを区別しているかは、まったく判っていない。いくつかの増殖性上皮細胞や、結合組織のほとんどの細胞は恒常的に活性化されているCD44を発現している。多くのリンパ球細胞は非結合型のCD44を発現しているが、それは二価の抗CD44抗体を用いることによって活性化される。この場合、考えられるのは、CD44がヒアルロン酸に結合するのに何らかのかたちでクラスター化されるか配列化される事が不可欠であるということである。残念ながら、このような細胞においてCD44の天然の活性化因子はまだ同定されてない。それにも関わらず、これらの結果から、ヒアルロン酸レセプターとして機能するためにはCD44の秩序立った回路網形成が必要であるらしいことが考えられる。
多くの結合組織細胞が恒常的に活性化されているCD44を発現しているという事実から、通常とは異なった型のCD44が発現されているか、CD44が発現されるとき細胞膜の中ですでに配列化されているかのどちらかが示唆される。CD44sがほとんどの細胞で発現される主要なアイソフォームであることから、後者の考えがより可能性がある。免疫電顕によるウシ軟骨細胞の研究で、われわれは軟骨細胞表面に41-45nmの周期で抗CD44抗体の染色が一定の繰り返しパターンを示すことを発見した2。面白いことに、細胞表面近くに局在する抗アグリカン抗体染色もまた、60-70nmと少し長い一定の繰り返しパターンを示した。これらの結果から、細胞外ヒアルロン酸/アグリカンリッチマトリックスの結合に関与するCD44は、それ自体クラスター化したレセプターとしてではなく、細胞表面で高度に配置されていると考えられた。
このモデルの細胞内はどうなっているのであろうか?CD44はその直下にある細胞骨格と会合するのであろうか?そして、この会合は細胞−マトリックス間で情報伝達をおこなえるほど十分ダイナミックさをもつのであろうか?ヒアルロン酸をTリンパ腫細胞に加えると、CD44のクラスターと、その下にアクチン結合タンパク質である細胞質内のアンキリンが直ちに現れる。Tリンパ腫細胞にヒアルロン酸を加えると、キナーゼ(例えば、PKCファミリーに属するキナーゼ)を活性化する細胞内カルシウムレベルが上昇し、CD44の細胞内ドメインに存在するセリン/スレオニン残基のリン酸化が起こる(Fig. 6)。CD44のリン酸化はCD44の細胞質内ドメインへのアンキリンの結合を増加させることが知られている10。さらに、CD44のリン酸化はヒアルロン酸を結合する能力も増加させるように見える。逆にTリンパ腫細胞に発現しているリン酸化を受けられないようにしたCD44の変異分子はヒアルロン酸結合能が低下していた11。
リン酸化の原因が、直接的なCD44の構造への配座効果によるものなのか、間接的な細胞内骨格の安定化効果によるものなのかは、現時点では不明である。しかしながら、別の研究では、リン酸化不能なCD44の変異株は、ヒアルロン酸への結合能や界面活性剤可溶性部分と不溶部分(細胞骨格会合部分)へのヒアルロン酸レセプターの分布に変化を見せなかった8。
逆に、サイトカラシンなどの試薬で細胞内骨格を崩壊させると、内皮細胞ではヒアルロン酸の結合が低下し、軟骨細胞ではヒアルロン酸リッチマトリックスが消失した。このように、いくつかの報告はこのモデルにおいては矛盾するけれども、ある細胞では明らかにヒアルロン酸の結合は何らかの形のCD44の配列化を誘導し、その結果、その下にある細胞内骨格を再構成する。この過程の仲介者であるCD44の特異的なリン酸化により、細胞−マトリックス間の情報伝達に必要なダイナミックな変化が可能性となる。たとえば、マクロファージにはリン酸化に関して2種類のCD44のプールがあるようである。不活性腹腔マクロファージでは、この2種類のプールのリン酸化と非リン酸化型の間の均衡はとれているが、活性化マクロファージではCD44の90%以上がリン酸化されるというようになる。われわれは軟骨細胞において、ヒアルロン酸とヒアルロン酸/プロテオグリカンリッチマトリックスを放線菌ヒアルロニダーゼ処理で取り除くとCD44のリン酸化が減少し、外からヒアルロン酸を添加することによってその減少が回復することを見いだした。
われわれの研究室と他の研究者によって、アクチン細胞内骨格へのCD44の細胞質ドメインの結合に2種のファミリーに属するアクチン結合タンパク質が関与することが報告された(Fig. 6)。ひとつはその構成タンパク質(エズリン、ラディキシン、モエシンとメルリン)から名付けられた" ERM"と呼ばれるファミリーである。他方は、”アンキリン”と呼ばれるファミリーである。前述したように、Tリンパ腫細胞ではCD44sのセリン/スレオニンのリン酸化に関与するキナーゼ活性の上昇はCD44のアンキリンへの結合を促進した。
しかしながら、内皮細胞で発現される140kDaのCD44(CD44v9+v1)はERMタンパク質を介して細胞内骨格と相互作用するが、一方、内皮細胞に発現されるCD44 v 10は細胞内骨格へ結合するのにアンキリンと相互作用する。われわれは、軟骨細胞はアンキリン同様、ERMファミリーの一構成分子であるモエシンを発現していることを見いだした。しかしながら、軟骨細胞を可溶化すると、アンキリンのみCD44sと免疫共沈降した。この結合に関与する両者が、共にまたは選択的(おそらく異なった機能を有するため)に働くのかどうかは現時点では不明であるが、非常に面白い可能性である。
CD44がクラスター化すること、または、しないことは、いくつかの細胞が異なったサイズのヒアルロン酸に違った応答をすることを説明する助けとなるかもしれない。マクロファージを用いた最近の研究で、高分子ではないヒアルロン酸の小断片が、マクロファージによるIL-1、TNF-alpha、IGF-1、iNOSの産生を誘導することが報告されている(7のNobleの章参照)。一酸化窒素と超酸化物の反応によって合成される過亜硝酸イオンがヒアルロン酸を分解し、生じた断片によって炎症の病的サイクルが持続するのであろう。他の研究者は、ある特定のサイズの幅を持つ可溶性のヒアルロン酸オリゴ糖が内皮細胞の細胞移動の応答性のみでなくその方向(例えば、走化性)も決定した。内皮細胞の細胞増殖を促進する低い濃度のヒアルロン酸オリゴ糖(6-20糖)は、尿奬膜アッセイで血管誘導活性を示し、走化性による細胞移動を促進した(7のWestの章を参照)。天然のヒアルロン酸と大きいサイズのヒアルロン酸オリゴ糖はこれらの細胞において走化性の効果を示さなかった。このようなヒアルロン酸オリゴ糖が組織内に存在するのかどうかは推測でしかないが、異なった分子量のヒアルロン酸が本質的に異なる影響をもつことから、ヒアルロン酸オリゴ糖の単価の相互作用はクラスター化したヒアルロン酸と多価のレセプターとの相互作用とは異なったシグナルに関与すると考えられる。
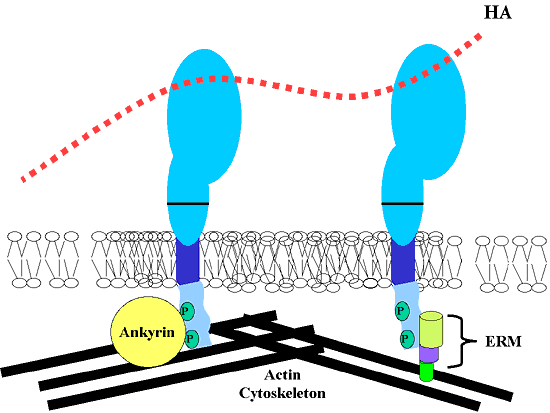
Fig. 6 CD44と相互作用するアクチン結合タンパク質
CD44は特定のアクチン結合タンパク質との相互作用を通してアクチン細胞骨格に結合することが知られているが、その結合タンパク質は、アンキリンファミリー(CD44の左のモデルに示す)またはERMファミリー(CD44の右のモデルに示す)のいずれかと会合している。
C. ヒアルロン酸の分解に至るCD44を介したヒアルロン酸の細胞内取り込み
細胞外マトリックスからヒアルロン酸が代謝し除かれるのは、局所で起こる異化作用と、リンパ系に入って局所リンパ節で分解されることに起因する。リンパ節を流れるリンパ液中ヒアルロン酸の〜10%のみがリンパ節を出て血液循環の中にはいると概算されている。血中からはヒアルロン酸結合LECレセプターを発現している肝臓の類洞細胞によって取り除かれる。表皮などいくつかの組織ではヒアルロン酸の代謝回転が高いが、細胞外に中性pHで活性のあるヒアルロニダーゼがあるという証拠はない。細胞外においてヒアルロン酸がフリーラジカルの機構によって脱重合する可能性を除けば、このように、ヒアルロン酸の局所の代謝は細胞内のリソゾームの中で低いpHで活性なヒアルロニダーゼにより起こるに違いない。さらに、多くの研究から、ヒアルロン酸の細胞内取り込みはCD44を含むマトリックスレセプターを介して行われることが示されている(Fig. 7A)。
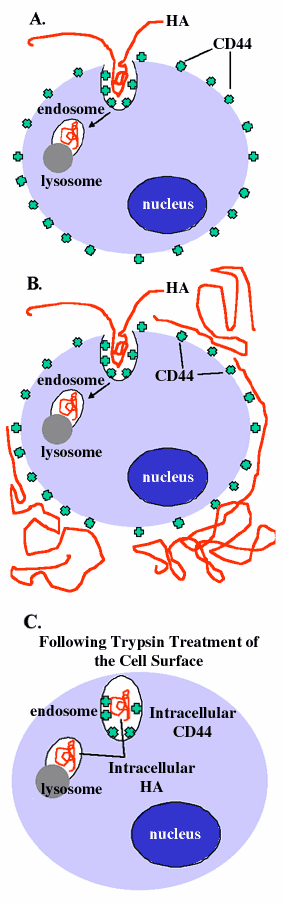
Fig. 7 CD44が介するヒアルロン酸の取り込みと分解
CD44との相互作用を通して細胞表層に結合したヒアルロン酸の一部は、7Aの写真に示すように細胞膜の嵌入により取り込まれるようである。この取り込みのステップの性質は未だ十分には特定されていないが、古典的なクラスリンコート小胞によるものではないことが知られている。嵌入部位はエンドゾームとなり続いてリソゾームと融合し、ヒアルロン酸の分解が終了する。外からフルオレセインで標識ヒアルロン酸を、CD44を発現している細胞とともにインキュベートすると、検出される標識は取り込まれた細胞内のヒアルロン酸と同様細胞外のヒアルロン酸をも反映する(写真7B)。細胞外のヒアルロン酸を放線菌ヒアルロニダーゼ消化することによって取り除いたり、または、トリプシン消化によってマトリックスと膜タンパク質をすべて取り除くと、細胞内のヒアルロン酸が現れてくる(写真7C)。写真7Bで示された実際の細胞はFig. 8A、8Cと8Eに示され、写真7Cで示された細胞はFig. 8B、8D、と8Fで示されている。
CD44を介した顕著なヒアルロン酸結合を示す肺胞マクロファージとSV-3T3細胞は細胞表面に結合したヒアルロン酸を取り込み、完全に分解する(7のFraserの章参照)。このような取り込みの例をFig. 8AとFig. 8Bに示す。フルオレセイン結合標識ヒアルロン酸とともに12-24時間インキュベートすると、SV3T3細胞では強い蛍光が観察される(Fig. 8A)。細胞内に局在するヒアルロン酸の部位を決定するために、細胞をトリプシンまたは放線菌ヒアルロニダーゼで処理した(Fig. 8Bと8C)。Fig. 8Bに見られるように、ほとんどの標識プローブは取り除かれ、残ったのはトリプシン抵抗性のヒアルロン酸の小さなかたまりで、明らかに細胞内の小胞に取り込まれている。われわれは軟骨細胞もまたCD44を介してヒアルロン酸に結合し取り込むことを見いだした。Fig. 8Cと8Dには、トリプシン消化前(Fig. 8C)と消化後(Fig. 8D)の成ウシ関節軟骨細胞に蛍光標識ヒアルロン酸を外から加えてインキュベートした図を示す。SV-3T3細胞のように、細胞内顆粒のようなクラスターまたは斑点状に細胞内にヒアルロン酸が蓄積された。同じような分子量を持つ多糖類である蛍光標識デキストランは、同様の条件下では結合、取り込みも起こらず、これらすべての実験でみられるヒアルロン酸の取り込みは単純な液層のピノサイトーシスによっておきるのではないことを示している。さらに、軟骨細胞によるヒアルロン酸の取り込みは過剰量の非標識ヒアルロン酸、ヒアルロン酸6糖オリゴ糖、または、抗CD44抗体とのインキュベーションによって阻害された。このように、細胞に溶液で加えたヒアルロン酸はCD44との相互作用によって細胞表面に結合し、一部はエンドサイトーシスされる。
より詳細に検討するために、3H標識ヒアルロン酸を取り込み実験に用いた。トリプシンまたはヒアルロニダーゼ処理前後の軟骨細胞と3H標識ヒアルロン酸をインキュベートし、オートラジオグラフィーをとると、Fig. 8Cと8Dに示すのとほぼ同じようなパターンを示した。つまり、トリプシン処理後銀粒子は細胞内の小さなかたまりの中に局在した12。カウントを合計すると、細胞表面に結合した標識ヒアルロン酸プローブの〜5%が24時間のインキュベーションで取り込まれたと試算された。細胞内プールの解析から二つのサイズの標識ヒアルロン酸があることが示された。ひとつはセファロースCL-2Bで排除体積に溶出される画分(すなわち、1 x 106Da以上)で、もう一方はカラムの総体積に溶出される画分(分解産物)である。これらの小さな分解産物の生成はリソゾーム阻害剤のクロロキンの存在下で阻害された。したがって、ヒアルロン酸の細胞内での分解はリソゾーム中のような低いpHの中で起こる。
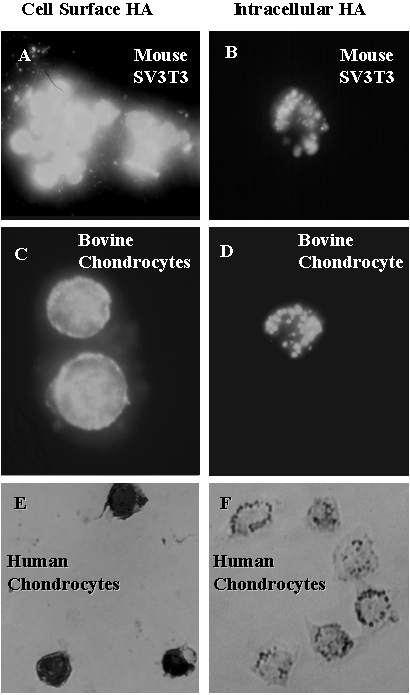
Fig. 8 SV3T3細胞と軟骨細胞におけるCD44を介したヒアルロン酸の取り込み
ウシとヒト正常関節軟骨細胞を軟骨より単離後、アルギン酸ビーズ中で5日間、初代培養しクエン酸ナトリウム処理により単細胞として分散させた。ウシ軟骨細胞は内因性のマトリックスを除去するために、放線菌ヒアルロニダーゼで前処理を行い、SV3T3細胞(直接単層培養で増殖させる)とともに細胞を24時間フルオレセイン標識ヒアルロン酸とインキュベートした(詳細に関しては文献12を参照)。
標識したリガンドとのインキュベーションにつづいて、一部の細胞は洗浄後そのまま蛍光顕微鏡観察を行った。残りの細胞は、細胞外に露出したマトリックスと表面タンパク質を除くため0.25%トリプシンで40分間処理し、洗浄後、同様に検鏡した。
ヒト軟骨細胞はアルギン酸ゲルからはずした後、(1)固定、透過処理後、ビオチン化ヒアルロン酸結合タンパク質で直接染色し発色させた(写真8E)。また、(2)細胞外に露出したすべてのマトリックス/表面タンパク質を取り除くため、0.25%トリプシンで40分間処理し洗浄後、同様に固定し、ビオチン化ヒアルロン酸結合タンパク質で染色し発色させた(写真8F)。写真8Fは細胞内の顆粒を示すためにデジタル処理により過露光し、写真8Eは同等のレベルに過露光した。ウシとヒト軟骨細胞の研究に関しては我々の研究室のYing Dangと西田佳弘博士に特別に感謝する。
細胞外でCD44に結合するヒアルロン酸の少なくとも一部分は、取り込まれリソゾームに運ばれ分解されるということは明らかである。しかし、CD44はすべてのヒアルロン酸の取り込み現象を仲介するのであろうか?いいかえれば、CD44もまた取り込まれるのであろうか?そして、もしそうなら、ヒアルロン酸は取り込みの後もCD44に結合しているのであろうか?われわれの研究室の予備的な結果では、CD44は取り込まれ、CD44とヒアルロン酸は細胞内空胞の中では一緒に存在しうることが示唆されている。ウシ関節軟骨細胞をフィコエリスリン標識抗CD44抗体またはフルオレセイン標識ヒアルロン酸とともにインキュベートした。3時間インキュベーションしてエンドサイトーシスをおこしてから、細胞表面に結合しているすべてのものを取り除くために、軟骨細胞をトリプシンで処理をした。両種の蛍光が細胞質内に斑点状に蓄積されているのが通常の蛍光顕微鏡と共焦点蛍光顕微鏡で観察され、両方の蛍光標識したリガンドが取り込まれたことを示している。他の研究で、細胞外で抗体によって標識したCD44の細胞内局在を確認するため、共焦点蛍光顕微鏡のZ軸方向のスキャンを用いた。トリプシン処理前に標識した全CD44のうち〜20%が取り込まれていた。
以上のすべての研究では、放線菌ヒアルロニダーゼで処理した細胞に外から標識したヒアルロン酸を加えた。ヒアルロニダーゼ処理はCD44に結合するすべての内因性のヒアルロン酸(同様に、軟骨細胞の場合はヒアルロン酸/プロテオグリカン−リッチマトリックス)を除去し、ヒアルロン酸の結合できる空いた部位の数を最大にした。天然の細胞結合性マトリックスにおいても、内因性のCD44に結合したヒアルロン酸の代謝はあるのであろうか?この疑問に答えるために、ヒアルロン酸の特異的なプローブ、ビオチン化ヒアルロン酸結合タンパク質(biotin-HABP)複合体、すなわち、アグリカンのG1ドメインとリンクタンパク質の複合体を用いた。この研究では、成ヒト正常関節軟骨細胞を5日間アルギン酸ビーズ中で培養し、そのビーズをカルシウムキレート剤であるクエン酸ナトリウムで処理することによって細胞を回収した。Fig. 8Eに示すように、細胞結合性マトリックス中に蓄積された細胞外のヒアルロン酸がbiotin-HABPプローブで顕著に染色された。その後、細胞結合性マトリックスを放線菌ヒアルロニダーゼ処理によって取り除き、ヒアルロン酸染色を行った。写真8Eに最適であった露出度と同じ条件下では、ごくわずかな細胞内の染色しか見られなかった。ストレプトアビジン反応産物を増強するためには、未処理の細胞よりも長い露出時間が必要であったが、細胞内小胞が明らかにヒアルロン酸陽性に染色された(Fig. 8F)。
興味深いことに、ケラチノサイトもCD44依存的な機構を使ってヒアルロン酸に結合し、それを取り込むe。このグループはまた、biotin-HABPプローブと共焦点顕微鏡を用いて、この細胞内のヒアルロン酸の蓄積を証明した。これらすべての系において、CD44を介したヒアルロン酸の取り込みがヒアルロン酸代謝の主要な経路なのかどうか、または、それ以上に”廃品回収”経路として存在するのかどうかを決めるにはもっとデータが必要であろう。しかしながら、マウスケラチノサイトにおけるアンチセンス遺伝子導入法でCD44の発現を抑制すると、角膜実質とともに表皮に近い真皮層でヒアルロン酸の異常な蓄積がおきるという注目すべき表現型を示した13。このように、CD44を介したヒアルロン酸の取り込みは多くの組織でヒアルロン酸の代謝及び異化の主要なメカニズムなのかもしれない。
e 本シリーズのR.およびM. Tammiの総説を参照
D. 癌細胞の浸潤と転移におけるヒアルロン酸とCD44の相互作用の役割
この数年の間にCD44の発現と癌細胞の悪性化及び転移の相関が非常に注目されている。悪性の癌細胞の多くがCD44を多量に産生していることは、CD44が癌化する前の多くの細胞で作られているレセプターであることから驚くには当たらない。ところが、 Gunthertらはラット膵癌細胞の高転移と非転移の細胞株の細胞表面に発現する抗原の違いを調べた結果、CD44 v6と名付けたCD44の新規な選択的スプライシングアイソフォームを単離した(7のW. Knudsonの章を参照)。このバリアントCD44 v6はCD44の細胞外ドメインにアミノ酸配列を余分に含んでいた。このDNA塩基配列は選択的スプライシングにより、エキソン11のはいったものに由来する(Fig. 2)。エキソン6〜15の発現は比較的に少なく、正常な細胞ではv6(エキソン11)はほとんど発現していない(例えば、:v6はBリンパ球細胞の活性化の際に一時的に発現される)。実験的にCD44 v6を特異的に認識する抗体を、転移能を持つ膵癌細胞とともに投与すると、転移巣の癌細胞増殖は抑制され、ホストに延命効果をもたらした。そして、転移能のない癌細胞にCD44 v6を導入すると局部リンパ節への転移活性が上昇するという発見で、研究者の興味はピークに達した。これらの現象からはじまり、ヒトの癌細胞でCD44の選択的スプライシングバリアントによる診断や予後判断上の価値についてと同様に、v3、v6、v9アイソフォームを含む選択的スプライシングの組み合わせの発現に関する多くの研究が報告された。また、予測されたように逆の報告もある。たとえば、CD44遺伝子を不活化しても、マウスリンパ腫細胞の浸潤や転移活性には全く影響しなかった。14
当然、次の疑問は、特にこの総説に関わることであるが、癌細胞の浸潤や転移においてCD44のヒアルロン酸への結合が必要なのかどうかである。CD44とヒアルロン酸の結合についてはいくつもの癌細胞、特にヒトの癌組織がヒアルロン酸を多く含んでいることが多いという事実から当然それが重要であると考えられる。しかし、癌組織のヒアルロン酸含量の増加に対して二つの異なる見方があり、それは次の通りである。(1)新しく合成されたヒアルロン酸リッチマトリックスは水和性に富み細胞移動を促す環境をもたらす。(2)ヒアルロン酸リッチマトリックスは細胞移動に対して粘性の高い障壁を作る。
(1)が真実ならCD44HやCD44バリアントの発現上昇は腫瘍部周辺のヒアルロン酸リッチマトリックスを介して、細胞移動の手助けをする。また、癌細胞は細胞移動のために、ヒアルロン酸存在下で発現しているRHAMMbを利用することもあるだろう。もしヒアルロン酸が細胞移動にとって障壁になるとしても、CD44が細胞移動を助けるかもしれない。何人かの研究者によれば、癌細胞のCD44が関与するエンドサイトーシスとヒアルロン酸の分解活性がin vitroで転移能の上昇と相関関係を示している。すなわち、ヒアルロン酸の取り込み分解活性の高い癌細胞が高転移能であることになる。癌細胞が持つヒアルロン酸の障壁はグリコサミノグリカンを結合、取り込みそして分解する能力を持つ細胞によって効率的に除かれるという解釈である。CD44の二つの機能も共同して働く可能性がある。すなわち、細胞移動のメカニズムの一部である、基質への接着と取り込みの作業である。エンドサイトーシス活性とそれによる癌細胞の悪性化の関係についてはまだはっきりした説明はなされていない。この解決のためにはCD44のエンドサイトーシスを特異的に阻害する方法を見つけ、in vivoとin vitroの両方でヒアルロン酸による癌細胞の移動促進活性があるのかどうか明確にする必要がある。
これらの質問により直接的に答えるために、細胞移動を測定するモデル系が開発された。Thomasらはヒトメラノーマ細胞にpCD44遺伝子を導入し、安定に発現しているクローンを作成したところ、その細胞はCD44を発現していない親株の細胞と比べて細胞表面にヒアルロン酸リッチマトリックスを持ち、細胞の移動能が上昇していたと報告した15。この亢進した細胞移動は、抗CD44抗体もしくはCD44リガンドの競合者であるCD44−免疫グロブリン融合タンパク質により阻害された。
このようにヒアルロン酸はCD44を介して癌細胞の移動を支持するように働くと考えることができる。近年、YuらはCD44を発現しているマウス乳ガン細胞(TA3/St) に可溶性CD44のcDNAを導入することでこの疑問に答えようとしたa。導入した癌細胞は一過性に可溶性のCD44を分泌し、細胞表面にあるCD44は競合的に阻害される事になる。シンジェニックマウスの尾静脈にコントロール細胞を注入すると肺に大きい転移巣を形成する。しかしながら、可溶性CD44を導入した株はほとんどゼロにまで転移が減少した。コントロールまたは導入細胞では肺転移が確立されるとヒアルロン酸の蓄積が観察された。これらの結果はin vivoで癌細胞においてCD44に関連した相互作用が、癌転移巣の形成や増大にとって重要であるという意見を支持するものである。CD44のこのような相互作用の相手物質がヒアルロン酸である可能性は非常に高いが、今後明確に見極める必要がある。
上記のような考察は読者にCD44は特に細胞とマトリックスの相互作用に関係する重要な鍵分子であるという概念を抱かせるはずである。従って、CD44欠損マウスが生存して、なんら形態学的異常を示さないことはいささか驚きである16。ノックアウトマウスにおいてCD44の機能を他のタンパク質が代償していることは考えられる。最近、報告されたヒアルロン酸レセプターの候補にLYVE-1がある17。しかしながら、組織特異的プロモーターを用いてケラチノサイトでCD44を選択的アンチセンス導入遺伝子により抑制すると、ノックアウトマウスではみられなかった明らかな症状が皮膚にみられた13。この選択的ケラチノサイト欠陥マウスの皮膚は水分含量が高く裂けやすかった。より詳細な検討により表皮にヒアルロン酸の異常な蓄積がみられたが、それはCD44によるレセプターを介したヒアルロン酸の代謝に必要なエンドサイトーシスが阻害されたことによる可能性が最も高い。CD44の発現の抑制は、ケラチノサイトの増殖も阻害した。CD44の意義と多岐にわたる機能、そしてまた、代償的に働くレセプターの同定には、さらなる研究が必要である。もし、他のレセプターが関与するのであれば、それらはCD44と生理的条件下で協調的に機能するのか、または、それはどのようにして行われるのかを確かめることが必要であろう。
このシリーズのこれまでの論文で議論されてきたように、多くの細胞はヒアルロン酸が豊富な細胞外マトリックスに面している。長い間、細胞外マトリックスの蓄積、特にヒアルロン酸の豊富な場合は、細胞がその役割を果たすための土台であると考えられてきた。この見解は変わった。現在では、細胞とマトリックスは共に相互作用し、お互いを調節し、一体として機能すると考えられている。この新しい視点の重要な点は、マトリックスと細胞の間に相互作用とコミュニケーションの手段を提供する細胞表面のマトリックスレセプターの発見である。このようにレセプターは、インテグリンのように一つのレセプターが時々多くのリガンドと相互作用するのに使われる。CD44の場合、リガンドはヒアルロン酸一つであるが、ヒアルロン酸に関わる多くの機能があると考えられる。CD44を知ることにより、マトリックスレセプターとそれらの細胞−マトリックス相互作用における役割に関する将来のパラダイムが導かれるであろう。