
氏名:谷本 智史
滋賀県立大学工学部材料科学科准教授 博士(工学)
1998年京都大学大学院工学研究科高分子化学専攻博士後期課程修了。1998年〜2002年10月、北陸先端科学技術大学院大学材料科学研究科助手。結晶性ブロック共重合体のミクロ相分離構造に関する研究に従事。2002年11月から滋賀県立大学講師。一貫して環境調和高分子材料に関する研究に取り組む。2010年7月より現職。近年はキトサンの微粒子化と機能化に注力している。
エビやカニなどの外骨格を支える構造多糖であるキチン・キトサンはセルロースに次ぐ産生量の海洋バイオマスであるが、未だ利用の進んでいない天然資源である。これまでに様々なアプローチでキチン・キトサンを高付加価値材料とする取り組みが検討されてきた。材料を高機能化するためには化学的修飾と形状・構造複雑化とが方針として考えられる。本稿では、キトサンに微粒子形状を与え、さらに無機物である炭酸カルシウムと複合化することで新たな機能性材料を調製する方法について紹介する。
近年、環境問題として「マイクロプラスチック」がよく話題になる。それは、主に水圏において検出される高分子材料の微細な固体のことを指している。そのサイズは5ミリメートルから100ナノメートル程度とされており、多くは排出された高分子材料が劣化や分解によって小スケールになった物である。環境中において増え続けている現状から生態系への影響が問題視されており、さまざまな対策が提案されている。それらは「マイクロプラスチックの元となるプラスチックゴミを排出しない」、「生分解性プラスチックを利用する」の二つに大きく分けられる。前者の対策としてはすでに行政を中心にさまざまな取り組みが行われてきている。我々の所属する大学のある滋賀県においても琵琶湖岸のゴミ拾いイベントなどが開催されたりしている。
一方、生分解性プラスチックに関してはマイクロプラスチックの存在が話題に上がるよりも前から環境調和の方策として幅広く検討されてきた。生分解性プラスチックの中ではポリ乳酸を代表例として取り上げることが多い。ポリ乳酸は現時点で農業用フィルムなどへの使用が行われているが、結晶性高分子であるため力学特性に難点があり、ポリスチレンなどの汎用高分子を置き換えるには至っていない。また、環境中でのポリ乳酸の分解が進行する条件は比較的限定的であり、生分解性材料としての利用検討が下火になってきている現状がある。近年は、ポリ乳酸に植物由来の原料が用いられていることを根拠に「カーボンニュートラル材料」としてのポジションを得ており、材料としての利用検討は現在も進められている。その他にも石油原料由来の生分解性高分子が研究対象として存在しているが、こちらは逆にカーボンニュートラルの観点からは不利である。 カーボンニュートラルの視点で生分解性材料を選択するなら、天然高分子の存在を除外するわけにはいかない。材料として古くから用いられている天然高分子の代表的なものとしてセルロースが挙げられる。セルロースは植物の身体を支える構造多糖であり、分子鎖中に多数存在するヒドロキシ基に由来する水素結合によって形状を強固に維持している。セルロースに関しては本稿で述べるまでもなく多数の研究がなされており、これからの活用が期待されている1。
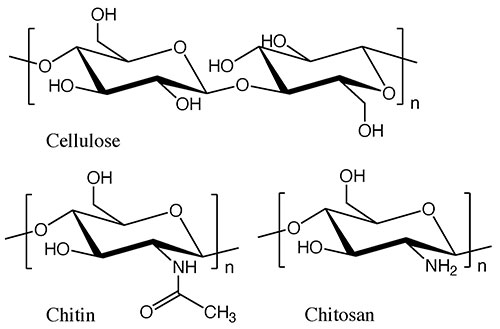
さて、セルロースに代表される構造多糖であるが、自然界においてはセルロースと同等の産生量を持つ物質が存在する。それがエビやカニの外骨格を支えている構造多糖であるキチン・キトサンである。キチンは、セルロースの2位ヒドロキシ基がアセトアミド基に置き換わった構造を有し、キトサンではそこがアミノ基になっている(図 1 参照)。自然界においてキチンとキトサンとはある割合の混合物として存在しているため「キチン・キトサン」と称されることが多い。これらはセルロースに次ぐ産生量を持っていながら、まだあまり利用の進んでいない海洋バイオマスである。木材から取れるセルロースと異なり、海洋小動物のしかも外骨格中に含まれており、大量採取が困難であることが、その原因の一つと言えよう。
今回、我々の研究グループが着目したのがキトサンである。キトサンはエビ・カニから取り出したキチン・キトサンに化学処理を施し、アセトアミド基を脱アセチル化することでキトサン成分のみにしたものである。キトサンの分子構造はセルロースと類似しているがモノマー単位にアミノ基を持っている点が大きく異なる。そして、このアミノ基が様々な有用な性質を生み出している。例えば、キトサンを吸着剤とする際にはこのアミノ基が金属イオンと相互作用することを利用している2。また、アミノ基の反応性の高さを利用して、さまざまな化学修飾が可能であるため機能性高分子の母材としても活用可能である。さらにはアミノ基の持つ抗菌性によって、医療材料としても応用が検討されている。例えば、創傷被覆剤などへの利用が多く検討されている3。
このキトサンを材料として用いる際は、そのままバルク材料として用いる方法もありえるが、何らかの形を与えることで、より高付加価値材料とすることがコストの面でも有利である。そこで我々のグループでは以前より粒子形状を提案している。キトサンの他の多糖との最も大きな差異はアミノ基を有していることであり、その点によりカチオン性多糖材料として活用することができる。そして、その特性をより強く発揮させるには比表面積の大きな形態である「粒子形状」が有効であり、機能性材料として利用する際の広い可能性が期待できる。
さて、物質に粒子形状を与える際には、バルクから粉砕していくトップダウン的手法と分子レベルから集積していくボトムアップ的手法が一般的に考えられる。キトサンに関してはトップダウン的手法が簡便であり多く検討されてきた。しかし、より制御された形状を与えるためにはボトムアップ的手順による方が望ましい。一般にボトムアップ手法を用いる際には物質を分子レベルまで、何らかの溶媒によって溶解・分散してやる必要がある。キトサン自体はセルロースと同じく分子鎖間の水素結合によって水や有機溶媒には溶解しづらいが、酸性の水溶液中でならアミノ基のプロトン化などによって溶解するという特性を有している。この性質を利用して、我々のグループではキトサンを酸性水溶液にし、そこから粒子形状を与えている。
また、キトサンに付加価値をさらに与えるための方策として他物質との複合材料化が考えられる。これまでに検討されている複合化の例としては金属などとの組み合わせがあり、抗菌特性を期待して銀ナノ粒子との組み合わせを検討している例もある4。我々のグループでは炭酸カルシウムとの組み合わせをメインに検討を行なっている。炭酸カルシウムは天然に存在するカルシウム塩であり、甲殻類の外骨格をキチン・キトサンと共に構成する成分である。したがって、得られる複合材料は天然材料に倣った「有機無機ハイブリッド材料」とも言える。有機物質と無機物質との複合材料は多くの場合、混合するだけのものであり、成分の分布を制御していないものが多い。我々の提案では、有機成分と
無機成分とを制御された位置・形状に分布させており、その点が他の研究事例との大きな差である5-7。
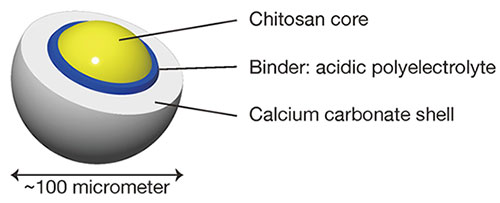
有機成分と無機成分との材料内部での分布を制御できると、そのことから機能を生み出すことができる。本研究での有機成分と無機成分とはそれぞれ、内側と外側に配置されており、粒子形状であることと合わせて、コアシェル型となるように設計されている(図 2)。具体的には内側のコア部分をキトサンで作り、外側のシェル部分を炭酸カルシウムによって作っている。本稿では我々のグループで実施している粒子の作り方と薬物担体としての応用検討について紹介する。
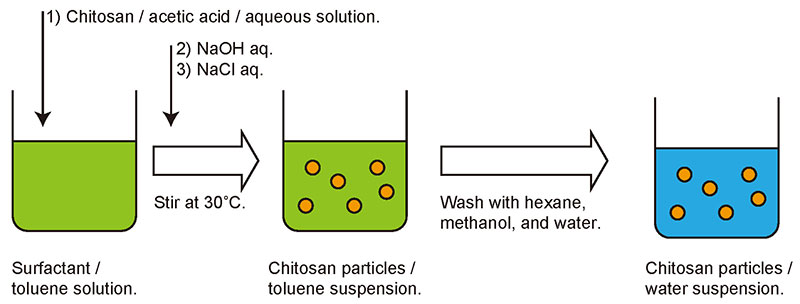
粒子作製の詳細は既報7にあるため、ここでは概略のみ紹介する。キトサン粒子は界面活性剤ソルビタンモノラウレートを溶解しておいた大過剰のトルエン中で調製した。まず、キトサンを酢酸に溶かして酸性水溶液とした。その後、少量のキトサン溶液を先程のトルエンと混合し、激しく撹拌した。トルエン中には十分な量の界面活性剤が存在しているため、キトサン水溶液は微小液滴として分散する。そして、ここに水酸化ナトリウムの水溶液を混合して、引き続き撹拌すると、キトサンを溶解していた酢酸酸性の溶液が中和され、キトサンが固体として液滴時の形状のまま析出した。その後、塩化ナトリウム水溶液を追加して更に撹拌し、キトサン粒子の懸濁液を得た(図 3)。懸濁液は有機溶媒と水によって洗浄され、最終的には凍結乾燥によって粒子を回収した。
得られたキトサン粒子のSEM画像を図 5(a)に示した。キトサン粒子はほぼ球形であり、粒径は40マイクロメートル程度であった。界面活性剤の効果によってトルエン中でw/oエマルションが安定化されており、その水溶液の液滴中のキトサンがそのまま固体として析出し、形状を固定化されて球形粒子になったと考える。
炭酸カルシウムのキトサン粒子表面への付与は「バイオミネラリゼーション」に倣ったプロセスで行なった。生物が体内外で作り出す鉱物をバイオミネラルと呼び、作り出す作用のことをバイオミネラリゼーションという8。バイオミネラルの例としては真珠9・貝殻・骨・甲殻類の外骨格などがあり、海洋性小動物の硬組織に存在するものが多い。このバイオミネラリゼーションは自発的な無機塩の集積・析出現象であり、低環境負荷かつ省エネルギーなプロセスとして近年、注目されている。
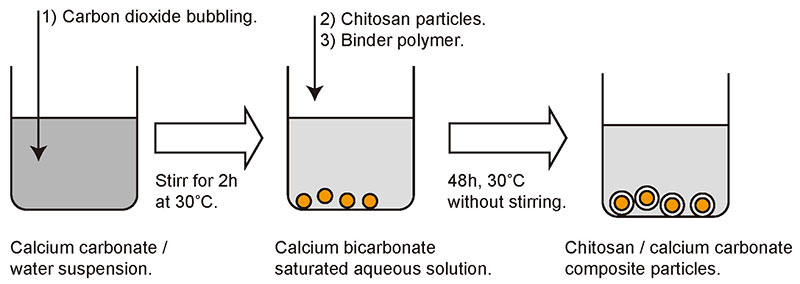
我々のグループでは炭酸カルシウムを中心とし、自発析出によってキトサン粒子表面にシェルとして集積させている。手順を図 4にまとめた。まず炭酸カルシウムの水溶液を調製する。炭酸カルシウムはあまり水に溶解しないため、懸濁液を作ってから二酸化炭素をバブリングすることで炭酸水素カルシウムの形にして溶解させる。そして、その水溶液中にあらかじめ作っておいたキトサン粒子と析出の補助剤として働く高分子電解質を混合し、48時間放置するだけである。高分子電解質はポリアクリル酸やポリグルタミン酸など水溶液中でマイナス電荷を持つものを用いており、プラス電荷を持つキトサン表面とカルシウムイオンの間を仲立ちする役割があるとされている10。液中の撹拌は不要であり、静置しておくだけで進行する点が、この手順の最大の特徴である。
得られた複合粒子のSEM画像を図 5(b)に示した。コアとして用いたキトサン粒子と同じく球形であり、ただ平均粒径のみが増加していた。これらの結果からキトサン粒子表面に均一な厚さで炭酸カルシウム層が析出しているのではないかと予想できた。それを裏付けるものとして図 5(c)に壊れた粒子を撮影した画像を示した。この写真からも、厚みを有するシェルの存在が明らかとなった。
次にシェルが炭酸カルシウムで形成されていることを確認するためにATR-FTIR法によって表面の分析を行なった。ATR法は表面から数マイクロメートルの範囲のみの情報を検出する測定法である。結果、粒子表面近傍においてキトサンがほとんど存在しておらず、粒子表面から少なくとも数マイクロメートルの深さまでが炭酸カルシウムのみで構成されていることがわかった。これはコアシェル構造の存在を意味している。

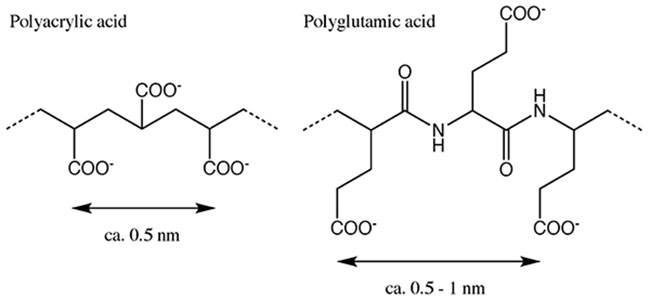
複合粒子の表面が厚みを有する炭酸カルシウムで覆われていることは確認できていたが、その構造が不明であった。そこでXRDを用いて結晶構造の評価を行なった。その結果、炭酸カルシウムの結晶構造はバインダーとしてポリアクリル酸を用いたときにカルサイトとなり、ポリグルタミン酸をバインダーとして添加した際にバテライトとなることが明らかとなった7。炭酸カルシウムの一般的な結晶形はカルサイト、アラゴナイト、バテライトの三種類であることが知られている。そのうち最も安定なものがカルサイトであり、アラゴナイトやバテライトは安定性の低い構造である8。我々の手法では添加したバインダー高分子の種類を変えることで析出した炭酸カルシウムの結晶形をコントロールできたことになる。これはバインダー高分子がキトサン表面のプラス電荷とカルシウムイオンの間をマッチさせる役割を果たしていると考えることで説明がつく。カルサイトを生成する役割を果たしたポリアクリル酸のカルボキシ基の間隔は(ca. 0.5 nm)であり、カルサイト結晶(001)面におけるカルシウムイオンのイオン間距離(0.499 nm)とほぼ一致しており、それを基にした炭酸カルシウムの結晶集積においてカルサイト結晶を誘起したものと考えられる(図 6)11,12。一方、ポリグルタミン酸に関してはカルボキシ基と主鎖との間に存在するアルキル鎖のせいでカルボキシ基間の距離が一定にならず、カルサイト以外の結晶形が生成したのではないかと考えられる。
得られた有機無機複合微粒子は外側に結晶性炭酸カルシウム、内部にキトサンコア微粒子という制御された構造を有していた。この構造を利用して、マイクロカプセルとしての利用を検討することとした。内部が有機相であることから、そこに薬物などの有機化合物を含浸・担持させることができる。また無機結晶からなる外殻(シェル)の存在は内部物質の保護層としての役割が期待できる。そこで本研究では、このコアシェル型複合微粒子の内部にモデル薬物を内包させ、薬物担体としての応用可能性を検討した。
モデル薬物としてはリボフラビン(ビタミンB2)の光分解物であるルミクロムを選択した。リボフラビンは簡単に光分解してしまう性質を持っているため、あらかじめ分解物を用いて実験を行った。キトサンの酢酸溶液調製時にルミクロムを一緒に溶解しておき、これまでと同じ手順で粒子化と炭酸カルシウムシェル付与を行い、ルミクロム内包粒子とした。この方法で得られた粒子の形状やサイズはルミクロムの内包によって変化しなかった。
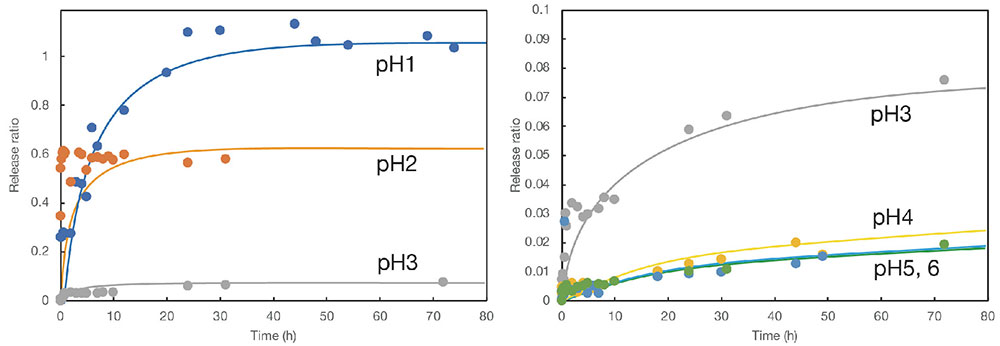
得られたルミクロム内包コアシェル粒子を任意のpHに調製した緩衝液に浸漬し、上澄み水溶液の蛍光測定を経時的に行うことでモデル薬物の放出挙動を評価した。ルミクロムは蛍光物質であるため、微量の放出であっても蛍光光度計によって検出が可能である。その結果の一例を示したものが図 7である。縦軸を粒子からのルミクロムの放出率、横軸を緩衝液への浸漬時間としてプロットしたものである。その結果、時間と共にルミクロムの放出が進行すること、また、pHに応じて放出挙動が変わることが明らかとなった。ただし、グラフにおける初期の勾配は比較的に急であり、徐放とは言えない挙動であった。図 7ではカルサイトシェルを有するコアシェル粒子(ポリアクリル酸をバインダーとして添加して調製したもの)の結果を示した。バテライトシェルの系では、初期の放出が若干速かったが、同様の挙動を示していた。
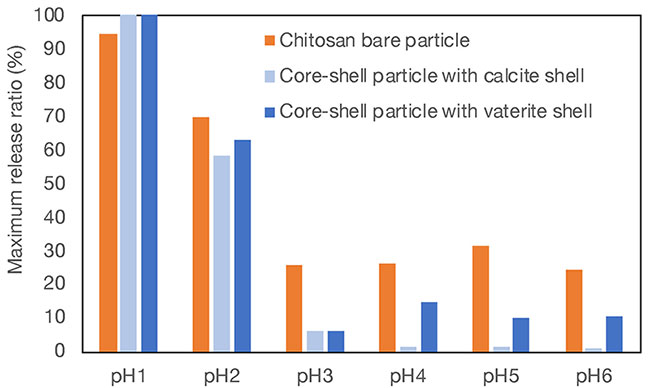
そして、グラフがほぼ平坦となった48時間後の放出率を最大放出率とし、pH依存性を比較した結果が図 8である。グラフにはシェルを付与していないキトサン粒子の結果と結晶構造の異なる二種のコアシェル粒子の結果とをプロットしている。pHが3以上の領域においてシェルを持つ粒子からの薬物放出がシェルを持たない粒子よりも抑制されていることがわかった。これは炭酸カルシウムの存在が弱酸性領域で内部保護に働いたことを示している。一方、pH1とpH2の強酸性領域では、シェルの有無が放出にはあまり影響しなかった。これは炭酸カルシウムが酸性環境下で速やかに溶解することを反映している。また興味深いことにpH4以上の中性に近い領域において、二種の結晶構造の異なるシェルを持つコアシェル粒子からの放出に差が見られた。結晶形がカルサイトであるとバテライトの粒子に比べて放出が抑えられていたことがわかった。バテライトに比べてカルサイトの方が安定な結晶形であることから、弱酸性環境下での内部保護の能力に差が出たのではないかと考えられる。
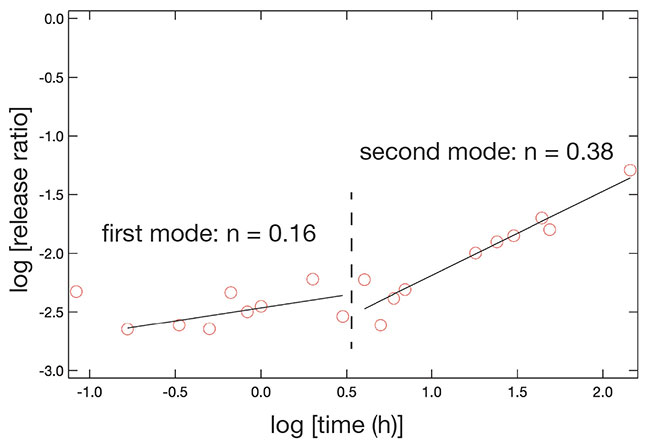
次に放出挙動の経時変化を速度論的に解析してみた。解析には製剤からの薬物放出を評価する際に用いる解析方法の一つであるKorsmeyer-Peppasプロットを用いた13。この解析方法はマトリックス型の薬物担体からの放出をべき乗関数としてフィッティングすることで、そのべき乗の乗数から拡散の種類を推定するものである。縦軸には放出量の対数を、横軸には時間の対数をプロットし、一次関数で近似した際の傾きを求める方法である。pH4でのカルサイトシェルを持つコアシェル粒子からの薬物放出挙動を解析したプロットを図 9に一例として示した。その結果、一つの直線では近似できず、二本の近似直線を用いることが適当であった。どちらの傾きの値も放出挙動がFick拡散に従っていることを示していたが、この薬物放出挙動に二つのモードが存在するということも明らかとなった。この結果を粒子がコアシェル構造を有している事と合わせると、前半の傾きはシェルの影響を受けたものであり、後半の傾きはキトサンコア粒子からの放出を反映したものであると考えられる。後半の近似直線の傾きが、シェルを持たないキトサンコア粒子からの放出に対して解析を行なった際に得られた傾きと近い値であったことからも、そのことが裏付けられる。前半のモードに対応するプロットの傾きは後半のそれよりもかなり小さく、コアシェル構造の外側成分である炭酸カルシウムシェルの存在が薬物放出に影響していることがこの解析結果からも明らかに示された。
本稿では、我々のグループが取り組んでいる海洋バイオマス「キトサン」の機能性微粒子材料しての活用を目指した、有機無機コアシェル型複合微粒子への形態制御・構造制御の一つの手法について紹介した。粒子形状へのボトムアップ的手法やバイオミネラリゼーションに倣ったカルシウム塩との複合化はまだまだ展開可能なプロセスであり、系統的・戦略的に検討を広げていきたいと考えている。我々のグループでは本稿で紹介した以外にもミリメートルスケールでの粒子化や複合化、構造制御に関する取り組みを進めており、材料としてのキトサンの可能性を今後、示していく予定である。素材であるキトサン(およびキチン)は今回紹介した以外にも様々な機能を有しており、ますます興味は尽きない。大量に利用可能なバイオマスとしてセルロースばかりが注目される現状ではあるが、さらに高機能化を望めるバイオマスの候補としてキトサンに対する研究が今後、広く展開されていくことを望む。
本項の内容は、JSPS科研費JP21K12314の助成を受けて実施された。